தயாரித்தல், பண்புகள், அமைப்பு, பயன்கள் - பொட்டாசியம் பெர்மாங்கனேட் | 12th Chemistry : UNIT 4 : Transition and Inner Transition Elements
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 4 : இடைநிலை மற்றும் உள் இடைநிலைத் தனிமங்கள்
பொட்டாசியம் பெர்மாங்கனேட்
பொட்டாசியம் பெர்மாங்கனேட் – KmnO4
தயாரித்தல்
பொட்டாசியம் பெர்மாங்கனேட்டானது பைரோலுசைட் (MnO2) தாதுவிலிருந்து தயாரிக்கப்படுகிறது. தயாரித்தல் செயல்முறையானது பின்வரும் படிநிலைகளை உள்ளடக்கியது.
(i) MnO2 வை பொட்டாசியம் மாங்கனேட் ஆக மாற்றுதல். நன்கு தூளாக்கப்பட்ட தாதுவானது KOH வுடன் காற்று அல்லது KNO3 / KCIO3 போன்ற ஆக்சிஜனேற்றி முன்னிலையில் உருக்கப்படுகிறது. பச்சை நிற பொட்டாசியம் மாங்கனேட் உருவாகிறது.
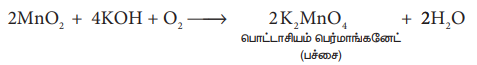
2MnO2 + 4KOH + O2 → 2K2MnO4 + 2H2O
பொட்டாசியம் பெர்மாங்கனேட்(பச்சை )
(ii) பொட்டாசியம் மாங்கனேட்டை பொட்டாசியம் பெர்மாங்கனேட்டாக ஆக்சிஜனேற்றமடையச் செய்தல்
மேற்கண்டுள்ளவாறு உருவான பொட்டாசியம் மாங்கனேட்டை, வேதி அல்லது மின்னாற் ஆக்சிஜனேற்றமடையச் செய்தல் ஆகிய இரு வழி முறைகளில் ஏதேனும் ஒரு வழிமுறையினைப் பின்பற்றி ஆக்சிஜனேற்றமடையச் செய்து பொட்டாசியம் பெர்மாங்கனேட்டைப் பெறலாம்.
வேதி ஆக்சிஜனேற்றம்
இந்த முறையில் பொட்டாசியம் மாங்கனேட்டானது ஓசோன் (O3) அல்லது குளோரினுடன் வினைபடுத்தப்பட்டு பெர்மாங்கனேட் தயாரிக்கப்படுகிறது.
2MnO3-4 + O3 + H2O → 2MnO4- + 2OH- + O2
2MnO3-4 + C12 → 2MnO4- + 2C1-
மின்னாற் ஆக்சிஜனேற்றம்
இம்முறையில் பொட்டாசியம் மாங்கனேட்டின் நீர்க்கரைசலானது சிறிதளவு காரத்தின் முன்னிலையில் மின்னாற் பகுக்கப்படுகிறது.
K2MnO4 ↔ 2K+ + MnO42−
H2O ↔ H+ + OH−
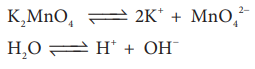
நேர்மின் வாயில் மாங்கனேட் அயனிகள் பெர்மாங்கனேட் அயனிகளாக மாற்றப்படுகின்றன.
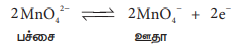
MnO42− ↔ MnO4− + e−
பச்சை ஊதா
எதிர்மின் வாயில் ஹைட்ரஜன் வெளியேறுகிறது.
2H+ + 2e- → H2 ↑
இளஞ்சிவப்பு நிறக் கரைசலை ஆவியதாலுக்கு உட்படுத்தி செறிவூட்டி பின் குளிர்விக்கும் போது பொட்டாசியம் பெர்மாங்கனேட் படிகங்கள் பெறப்படுகின்றன.
இயற்பியல் பண்புகள்
பொட்டாசியம் பெர்மாங்கனேட் அடர் இளஞ்சிவப்பு நிறப் படிகங்களாகக் காணப்படுகின்றது. இதன் உருகுநிலை 513 K. இது குளிர்ந்த நீரில் மிதமாக கரையும் ஆனால் சூடான நீரில் நன்கு கரைகிறது.
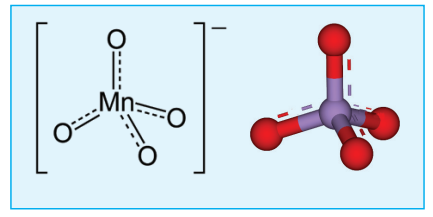
பெர்மாங்கனேட் அயனியின் வடிவமைப்பு
பெர்மாங்கனேட் அயனியில் sp3 இனக்கலப்படைந்த Mn7+ அயனியானது ஒரு நான்முகியின் மையத்தில் கீழே கண்டுள்ள படத்தில் காட்டப்பட்டுள்ளவாறு அமைந்துள்ளது.
படம் 4.9 பெர்மாங்கனேட் அயனியின் வடிவமைப்பு
வேதிப் பண்புகள்
1. வெப்பத்தின் விளைவு
பொட்டாசியம் பெர்மாங்கனேட்டை வெப்பப்படுத்தும்போது அது சிதைவடைந்து பொட்டாசியம் மாங்கனேட் மற்றும் மாங்கனீஸ் டை ஆக்சைடு ஆகியவற்றைத் தருகிறது.
2KMnO4 → K2MnO4 + MnO2 + O2
2. அடர் கந்தக அமிலத்துடன் வினை
குளிர்ந்த அடர் கந்தக அமிலத்துடன் வினைப்படுத்தும் போது இது சிதைவடைந்து மாங்கனீஸ் ஹெப்டாக்சைடையைத் தருகிறது. தொடர்ச்சியாக ஹெப்டாக்சைடு வெடிக்கும் தன்மையுடன் சிதைவடைகிறது.
2KMnO4 + 2H2SO4 → Mn2O7 + 2KHSO4 + H2O (குளிர்ந்த)
2Mn2O Δ 4MnO2 + 3O2
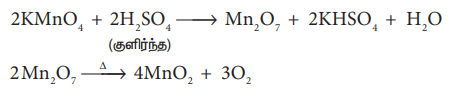
ஆனால், சூடான அடர் கந்தக அமிலத்துடன் வினைப்படுத்தும் போது மாங்கனீஸ் சல்பேட் உருவாகிறது.
4KMnO4 + 6H2SO4 → 4MnSO4 + 2K2SO4 + 6H2O + 5O2 (சூடான)
3. ஆக்சிஜனேற்றும் பண்பு
பொட்டாசியம் பெர்மாங்கனேட் ஒரு வலிமையான ஆக்சிஜனேற்றியாகும். வெவ்வேறு ஊடகங்களில் இதன் ஆக்சிஜனேற்றும் வினை வேறுபடுகிறது.
அ. நடுநிலை ஊடகங்களில்
நடுநிலை ஊடகத்தில் இது MnO2 ஆக ஒடுக்கம் அடைகிறது.
MnO4-+ 2H2O +3e- → MnO2 + 4OH-
(i) இது H2S ஐ சல்பராக ஆக்சிஜனேற்றம் அடையச் செய்கிறது.
2MnO4- + 3H2S → 2MnO2 + 3S + 2OH- + 2H2O
(ii) இது தயோ சல்பேட்டை, சல்ஃபேட்டாக ஆக்சிஜனேற்றம் அடையச் செய்கிறது.
8MnO4- + 3S2O32- + H2O → 6SO43- + 8MnO2 + 2OH-
ஆ. கார ஊடகங்களில்
கார உலோக ஹைட்ராக்சைடுகளின் முன்னிலையில், பெர்மாங்கனேட் அயனியானது மாங்கனேட் அயனியாக மாற்றமடைகிறது.
MnO4- + e- → MnO43-
இந்த மாங்கனேட் அயனியானது, ஒடுக்கும் காரணிகளால் மேலும் MnO, ஆக ஒடுக்கம் அடைகிறது.
MnO42- + H2O → MnO2 + 2OH- + [O]
எனவே, ஓட்டுமொத்த வினையினை பின்வருமாறு எழுத முடியும். MnO4- + 2H2O + 3e- → MnO2 + 4OH-
இந்த வினையானது, நடுநிலை ஊடகத்தில் நிகழும் வினையினை ஒத்துள்ளது.
பேயரின் காரணி
குளிர்ந்த, நீர்த்த, காரம் கலந்த KMnO4 ஆனது பேயரின் காரணி என அழைக்கப்படுகிறது. இது ஆல்கீன்களை டையால்களாக ஆக்சிஜனேற்றம் அடையச் செய்கிறது. எடுத்துக்காட்டாக, எத்திலீனை பேயரின் காரணியுடன், வினைப்படுத்தும் போது எத்திலீன் கிளைக்கால் உருவாகிறது. இவ்வினை நிறைவுறா தன்மையைக் கண்டறிய உதவும் ஒரு சோதனையாகப் பயன்படுகிறது.
இ. அமில ஊடகத்தில்
நீர்த்த கந்தக அமிலத்தின் முன்னிலையில், பொட்டாசியம் பெர்மாங்கனேட்டானது ஒரு வலிமைமிக்க ஆக்சிஜனேற்றியாக செயல்படுகிறது. பெர்மாங்கனேட் அயனியானது Mn2+ அயனியாக மாற்றப்படுகிறது.
MnO4- + 8H+ + 5e- → Mn2+ + 4H2O
அமில ஊடகத்தில் பொட்டாசியம் பெர்மாங்கனேட்டின் ஆக்சிஜனேற்றும் தன்மையை பின்வரும் எடுத்துக்காட்டுகள் விளக்குகின்றன.
(i) இது ஃபெர்ரஸ் உப்புகளை ஃபெர்ரிக் உப்புகளாக ஆக்சிஜனேற்றம் அடையச் செய்கிறது.
2MnO4- + 10Fe2+ + 16H+ → 2Mn2+ + 10Fe3+ + 8H2O
(ii) இது அயோடைடு அயனியை அயோடினாக ஆக்சிஜனேற்றம் அடையச் செய்கிறது.
2MnO4- + 10 I- + 16H+ → 2Mn2+ + 5I2+ 8H2O
(iii) இது ஆக்சாலிக் அமிலத்தை, கார்பன் டை ஆக்சைடாக ஆக்சிஜனேற்றம் அடையச் செய்கிறது.
2MnO4− + 5( COO)2− + 16H+ → 2Mn2+ + 10CO2 + 8H2O
(iv) இது சல்பைடு அயனியை, சல்பராக ஆக்சிஜனேற்றம் அடையச் செய்கிறது.
2MnO4- + 5 S2- + 16H+ → 2Mn2+ + 5 S + 8H2O
(v) இது நைட்ரைட்டை, நைட்ரேட்டுகளாக ஆக்சிஜனேற்றம் அடையச் செய்கிறது.
2MnO4- + 5NO2- + 6H+ → 2Mn2+ + 5NO3- + 3H2O
(vi) இது ஆல்கஹால்களை ஆல்டிஹைடுகளாக ஆக்சிஜனேற்றம் அடையச் செய்கிறது.
2KMnO4 + 3H2SO4 + 5CH3CH2OH → K2SO4 + 2MnSO4 + 5CH3CHO + 8H2O
(vii) இது சல்பைட்டை, சல்பேட்டாக ஆக்சினேற்றம் அடையச் செய்கிறது
2MnO4- + 5SO32- + 6H+ → 2Mn2+ + 5SO42- + 3H2O
பொட்டாசியம் பெர்மாங்கனேட்டின் பயன்கள்
பொட்டாசியம் பெர்மாங்கனேட்டின் சில முக்கியமானப் பயன்கள் பின்வருமாறு
1. இது வலிமைமிக்க ஆக்சிஜனேற்றியாக பயன்படுகிறது.
2. பல்வேறு தோல் தொற்றுகள் மற்றும் கால்களில் ஏற்படும் பூஞ்சை தொற்றுகளுக்கு மருந்தாகப் பயன்படுகிறது.
3. நீரை தூய்மைப்படுத்தும் தொழிற்சாலைகளில், நிலத்தடி நீரிலிலிருந்து ஹைட்ரஜன் சல்பைடு மற்றும் இரும்பை நீக்கப் பயன்படுகிறது.
4. கரிமச் சேர்மங்களின் காணப்படும் நிறைவுறாத் தன்மையை கண்டறிய பேயரின் காரணியாகப் பயன்படுகிறது.
5. ஃபெர்ஸ் உப்புகள், ஆக்சலேட்டுகள், ஹைட்ரஜன் பெராக்சைடு மற்றும் அயோடைடுகளை அளந்தறியும் பருமனறி பகுப்பாய்வுகளில் பயன்படுகிறது.
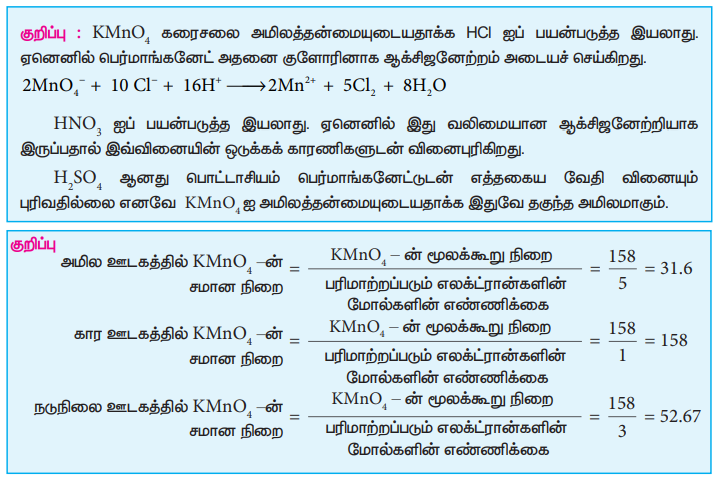
குறிப்பு : KMnO4 கரைசலை அமிலத்தன்மையுடையதாக்க HCI ஐப் பயன்படுத்த இயலாது. ஏனெனில் பெர்மாங்கனேட் அதனை குளோரினாக ஆக்சிஜனேற்றம் அடையச் செய்கிறது.
2MnO4- + 10 C1- + 16H+ → 2Mn2+ + 5C12 + 8H2O
HNO3 ஐப் பயன்படுத்த இயலாது. ஏனெனில் இது வலிமையான ஆக்சிஜனேற்றியாக இருப்பதால் இவ்வினையின் ஒடுக்கக் காரணிகளுடன் வினைபுரிகிறது.
H2SO4 ஆனது பொட்டாசியம் பெர்மாங்கனேட்டுடன் எத்தகைய வேதி வினையும் புரிவதில்லை எனவே KMnO4 ஐ அமிலத்தன்மையுடையதாக்க இதுவே தகுந்த அமிலமாகும்.
குறிப்பு : அமில ஊடகத்தில் KMnO4 -ன் சமான நிறை = KMnO4 -ன் மூலக்கூறு நிறை / பரிமாற்றப்படும் எலக்ட்ரான்களின் மோல்களின் எண்ணிக்கை / 158/5 = 31.6
கார ஊடகத்தில் KMnO4 -ன் சமான நிறை - KMnO4 - ன் மூலக்கூறு நிறை / பரிமாற்றப்படும் எலக்ட்ரான்களின் மோல்களின் எண்ணிக்கை =158/1=158
நடுநிலை ஊடகத்தில் KMnO4 -ன் சமான நிறை = KMnO4-ன் மூலக்கூறு நிறை / பரிமாற்றப்படும் எலக்ட்ரான்களின் மோல்களின் எண்ணிக்கை =158/3 = 52.67