விளைவுகள், காரணங்கள் - லாந்தனாய்டு குறுக்கம் | 12th Chemistry : UNIT 4 : Transition and Inner Transition Elements
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 4 : இடைநிலை மற்றும் உள் இடைநிலைத் தனிமங்கள்
லாந்தனாய்டு குறுக்கம்
அணு மற்றும் அயனி ஆரம்
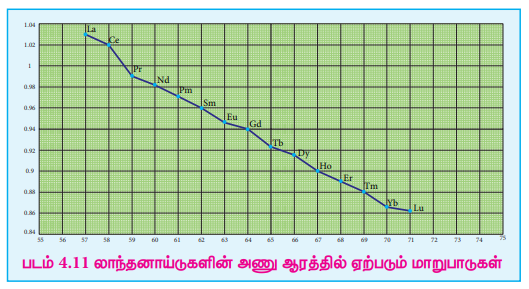
4f தொடரில் சீரியம் ( 58Ce) முதல் லுட்டீசியம் (71 Lu) வரை செல்லும் போது அணு எண் அதிகரிக்க அதிகரிக்க லாந்தனாய்டுகளின் அணு மற்றும் அயனி ஆரங்கள் சீராகக் குறைந்து வருகின்றன. இவ்வாறு அயனி ஆரம் குறைவது லாந்தனாய்டு குறுக்கம் எனப்படும்.
படம் 4.11 லாந்தனாய்டுகளின் அணு ஆரத்தில் ஏற்படும் மாறுபாடுகள்
லாந்தனாய்டு குறுக்கத்திற்கானக் காரணங்கள்
4f தொடரில் (Ce) முதல் (Lu) வரை ஒரு தனிமத்திலிருந்து மற்றொரு தனிமத்திற்குச் செல்லும் போது, அணுக்கரு மின்சுமையானது ஒரலகு அதிகரிக்கிறது. மேலும், கூடுதல் எலக்ட்ரான்கள் அதே 4f உட்கூட்டில் சேர்க்கப்படுகின்றன. 4f உட்கூடானது விரவிய வடிவத்தினைப் பெற்றுள்ளது என நாம் அறிவோம். எனவே மற்ற எலக்ட்ரான்களோடு ஒப்பிடும் போது, 4f எலக்ட்ரான்களின் திரை மறைப்பு விளைவு குறைவு. இதன் காரணமாக 4f எலக்ட்ரான்களின் மீதான அணுக்கருவின் செயலுறு மின் சுமை அதிகரிக்கிறது. மேலும், Ln'+ அயனிகளில் உருவளவு குறைகிறது. அயனி ஆர மதிப்புகளைக் குறிக்கும் கீழ்க்கண்டுள்ள வரைபடத்திலுருந்து லாந்தனாய்டு குறுக்கத்தினை உணர்ந்து கொள்ள இயலும்.
லாந்தனாய்டு குறுக்கத்தின் விளைவுகள்
1. காரத் தன்மை குறைதல்
Ce3+ யிலிருந்து Lu3+ நோக்கிச் செல்லும் போது Ln3+ அயனிகளில் காரத் தன்மை குறைகிறது. Ln3+ அயனிகளின் உருவளவுகுறைவதாலும், Ln-OH பிணைப்பின் அயனித்தன்மை குறைவதாலும் (சகப்பிணைப்புத் தன்மை அதிகரிக்கப்பதன் காரணமாகவும்) காரத் தன்மையானது குறைகிறது.
2. லாந்தனாய்டுகளுக்கிடையேயான ஒற்றுமைகள்
f தொடர் முழுமைக்கும் அணு ஆரத்தில் 10 pm குறைவும் அயனி ஆரத்தில் 20 pm குறைவும் மட்டுமே காணப்படுகிறது. இவ்வாறு லாந்தனாய்டுகளில் அயனி ஆரங்களில் மிகச் சிறிதளவே வேறுபாடுகள் காணப்படுவதால் அவைகளின் வேதிப் பண்புகள் ஏறத்தாழ ஒத்துள்ளன.
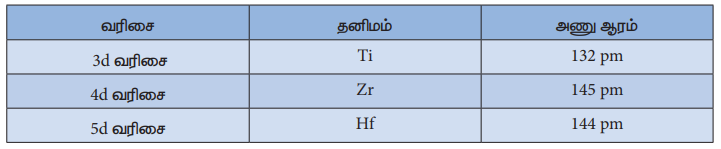
3. முதல் மற்றும் இரண்டாம் வரிசை இடைநிலைத் தனிமங்களைக் காட்டிலும்
இரண்டாம் மற்றும் மூன்றாம் இடைநிலைத் தனிம வரிசைத் தனிமங்கள் அதிகளவில் ஒன்றுக்கொன்று ஒத்துள்ளன இதனைப் பின்வரும் அணு ஆர மதிப்புகளிலிருந்து அறியலாம்.