அணு இயற்பியல் - அணு நிறையும் அணுக்கரு நிறையும் | 12th Physics : UNIT 9 : Atomic and Nuclear Physics
12 வது இயற்பியல் :அலகு 9 : அணு மற்றும் அணுக்கரு இயற்பியல்
அணு நிறையும் அணுக்கரு நிறையும்
அணு நிறையும் அணுக்கரு நிறையும்
SI அலகில் குறிப்பிடும் போது அணுக்கருவின்
நிறை மிகச் சிறிய மதிப்பு கொண்டதாக உள்ளது. (ஏறத்தாழ 10-25 kg அல்லது அதைவிடக்
குறைவு). எனவே அதை எழுதும் போது அணு நிறை அலகு (u) என்ற அலகைப்பயன்படுத்துவது எளிதாக
இருக்கும். அணு நிறை அலகு (u) என்பது இயற்கையாகக் கிடைக்கப் பெறும் கார்பன் ஐசோடோப்புகளில்
அதிக அளவில் காணப்படும் 126C ஐசோடோப்பின் நிறையில் 12 இல் ஒரு
பங்கு ஆகும். அதாவது,
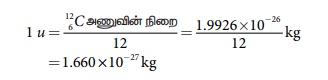
அணு நிறை அலகில், நியூட்ரானின் நிறை mN
= 1.008665 μபுரோட்டானின் நிறை Mp =
1.007276 μ, ஹைட்ரஜன் அணுவின் நிறை mH =
1.007825 μ மற்றும் 126C -ன் நிறை
12μ. பொதுவாக,
நிறையெனப்படுவது அணுக்களின் நிறையேயன்றி அணுக்கருக்களின் நிறை அல்ல. எனவே குறிப்பிட்ட
அணுக்கருவின் நிறையைக் காண அதன் அணுக்களின் நிறையிலிருந்து எலக்ட்ரான்களின் நிறையைக்
கழிக்க வேண்டும். அணுக்களின் நிறையை செய்முறை ஆய்வின் மூலம் கண்டறிய பெயின்பிரிட்ஜ்
நிறைமாலைமானி என்ற கருவி பயன்படுத்தப்படுகிறது. ஐசோடோப்புகளின் விளைவுகளைக் கருத்தில்
கொள்ளாமல் தனிமத்தின் அணு நிறையைக் கண்டறிந்தோம் என்றால் அதிலுள்ள ஐசோடோப்புகளின் அளவுகளுக்கு
(abundance) ஏற்ப கணக்கிடப்பட்ட சராசரி அணு நிறையே நமக்குக் கிடைக்கும்.
எடுத்துக்காட்டு
8.6
குளோரினின் பல்வேறு ஐசோடோப்புகளுக்கு இடையே
வேறுபாடுகள் இல்லையெனில், அவற்றின் சராசரி அணு நிறையைக் கணக்கிடுக.
தீர்வு
குளோரின் தனிமமானது 75.77% 3517CI
மற்றும் 24.23% 3717CI ஆகியவற்றின் கலவையே. எனவே, அதன் சராசரி
அணுநிறை

ஒரு தனிமத்தின் இந்த சராசரி அணுநிறை அல்லது
வேதிய அணு எடை (குளோரினுக்கு இதன் மதிப்பு 35.453u) மதிப்புகளையே வேதியியலாளர்கள்
(Chemists) பயன்படுத்துகின்றனர். எனவே, தனிம வரிசை அட்டவணையில் குறிப்பிடப்பட்டுள்ள
அணு நிறை மதிப்புகள் இவ்வாறு கணக்கிடப்பட்ட சராசரி அணுநிறை மதிப்புகளே என்பதைக் கருத்தில்
கொள்ளவும்.