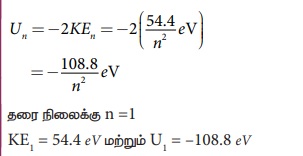12 வது இயற்பியல் :அலகு 9 : அணு மற்றும் அணுக்கரு இயற்பியல்
போர் அணு மாதிரி
போர் அணு மாதிரி
அணுவின் நிலைத்தன்மை மற்றும் ஹைட்ரஜன் அணுவின்
வரி நிறமாலை ஆகியற்றை விளக்குவதில் ரூதர்போர்டு அணு மாதிரியின் குறைபாடுகளைப் போக்கும்
வகையில், ரூதர்போர்டு அணு மாதிரியில் சில மாற்றங்களை நீல்சு போர் செய்தார். ஹைட்ரஜன்
அணுவின் வரி நிறமாலையை விளக்கும் பொருட்டு அணுவின் அமைப்பு குறித்த தகுந்த கருத்தியல்
விளக்கத்தை முதலில் கூறியவர் அவரே. அவரது எடுகோள்கள் பின்வருமாறு:

படம் 8.14 ஹைட்ரஜனின் வரி நிறமாலை
போர்
அணு மாதிரியின் எடுகோள்கள்
(அ) கூலூம் நிலைமின்னியல் கவர்ச்சி விசையினால்
அணுக்கருவைச் சுற்றி ஓர் எலக்ட்ரான் வட்டப்பாதையில் இயங்குகின்றது. வட்டப்பாதையில்
எலக்ட்ரான் இயங்கத் தேவையான மைய நோக்கு விசையை இந்த கூலூம் விசை அளிக்கின்றது.
(ஆ) அணுவில் உள்ள எலக்ட்ரான்கள் குறிப்பிட்ட
சில தனித்தனியான (discrete) பாதைகளில் அணுக்கருவைச் சுற்றி வருகின்றன; இப்பாதைகளில்
எலக்ட்ரான்கள் சுற்றும் போது அவை மின்காந்த ஆற்றலை கதிர் வீசுவதில்லை. இவ்வாறு அனுமதிக்கப்பட்ட
தனித்தனியான சுற்றுப்பாதைகள் நிலைத்தன்மை பெற்றவை.
இத்தகைய நிலைத்தன்மை பெற்ற சுற்றுப்பாதைகளில்
உள்ள எலக்ட்ரானின் கோண உந்தத்தின் (I) மதிப்பானது குவாண்டப் படுத்தப்பட்டுள்ளது. அதாவது
அதன் மதிப்பு h/2π –ன் முழு மடங்காகவே இருக்கும். இதைச் சமன்பாட்டு
வடிவில் I =nh என்று எழுதலாம். இங்கு h (h பார் என்று படிக்க வேண்டும்) என்பது சுருக்கிய
பிளாங்க் மாறிலி (h = h/2π) மற்றும் n என்பது முதன்மை குவாண்டம் எண்
ஆகும். இந்த நிபந்தனை கோண உந்த குவாண்டமாக்கல் (angular momentum quantization) அல்லது
குவாண்டமாக்கல் நிபந்தனை என அழைக்கப்படுகிறது.
குவாண்டம் இயந்திரவியலின்படி, எலக்ட்ரான்கள்
உள்ளிட்ட துகள்கள் இருமைப்பண்பு பெற்றவை. (காண்க.
+2 இயற்பியல் பாடநூல்: தொகுதி - 2 அலகு -7), நிலைத்தன்மை பெற்ற பாதையில் சுற்றி வரும்
எலக்ட்ரான்களுடன் தொடர்புள்ள நிலையலைகளின் (standing wave) அமைப்புகள் படம் 8.15-ல்
கொடுக்கப்பட்டுள்ளன.
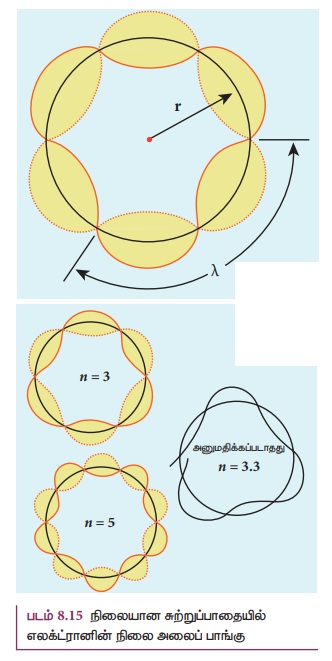
படம் 8.15 நிலையான சுற்றுப்பாதையில் எலக்ட்ரானின்
நிலை அலைப் பாங்கு
மேலும் எலக்ட்ரான் சுற்றுப்பாதையின் சுற்றளவானது
டி பிராய் அலைநீளத்தின் முழு மடங்காக இருக்க வேண்டும்.

m நிறையும் v திசைவேகமும் கொண்ட எலக்ட்ரானின்
டி ப்ராய் அலைநீளம் λ = h/mν இங்கு
h என்பது பிளாங்க் மாறிலி. எனவே
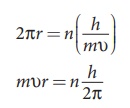
m நிறையும் v திசைவேகமும் கொண்ட எந்த ஒரு துகளும்
r ஆரம் கொண்ட வட்டப்பாதை இயக்கத்தை மேற்கொள்ளும்போது, அதன் கோண உந்தத்தின் எண் மதிப்பு
l = r(mυ)
mυr = l = nh
(இ) சுற்றுப்பாதைகளின் ஆற்றல் தொடர்ச்சியாக
இல்லாமல் தனித்தனி மதிப்புகளைக் கொண்டுள்ளன.இதையே ஆற்றலின் குவாண்டமாக்கல் என்பர்.
இரு சுற்றுப்பாதைகளின் ஆற்றல் வேறுபாட்டுக்குச் (ΔE) சமமான
ஆற்றல் கொண்ட ஃபோட்டானை உட்கவர்வதனாலோ அல்லது வெளிவிடுவதனாலோ எலக்ட்ரான் ஒரு சுற்றுப்பாதையிலிருந்து
மற்றொன்றுக்கு தாவ இயலும் (படம் 8.16)
∆E = E final − Einitial = hv = h c/λ
இங்கு c என்பது ஒளியின் திசைவேகம், λ கதிர்வீச்சின்
அலைநீளம் மற்றும் V கதிர்வீச்சின் அதிர்வெண் ஆகும். எனவே, உமிழப்படும் கதிர்வீச்சின்
அதிர்வெண் , அணுவின் ஆற்றல் மாறுபாட்டை மட்டுமே சார்ந்துள்ளது. மேலும் அது எலக்ட்ரானின்
சுற்றுப்பாதை இயக்கத்தின் அதிர்வெண்ணைச் சார்ந்ததல்ல.
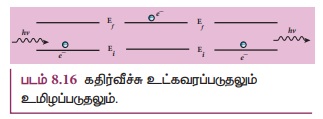
படம் 8.16 கதிர்வீச்சு உட்கவரப்படுதலும் உமிழப்படுதலும்.
எடுத்துக்காட்டு
8.1
ஹைட்ரஜன் அணுவின் 5வது சுற்றுப்பாதையின் ஆரம் 13.25 Å எனில், அச்சுற்றுப்பாதையில் உள்ள எலக்ட்ரானின் அலைநீளத்தைக் கணக்கிடுக.
தீர்வு
2 π r = nλ
2x 3.14 X 13.25Å = 5x λ
λ = 16.64Å
எடுத்துக்காட்டு
8.2
ஹைட்ரஜன் அணுவின் 5வது சுற்றுப்பாதையின்
(i) கோண உந்தம் மற்றும் (ii) அதிலுள்ள எலக்ட்ரானின் திசைவேகம் ஆகியவற்றைக் கணக்கிடுக.
(h = 6.6x 10-34Js, m = 9.1 X
10-31 kg)
தீர்வு

சுற்றுப்பாதையில் உள்ள எலக்ட்ரானின் ஆரம் மற்றும்
திசைவேகம்
நிலையாகவுள்ள அணுக்கரு மற்றும் rn
ஆரம் கொண்ட வட்டப்பாதையில் அணுக்கருவைச் சுற்றி இயங்கும் எலக்ட்ரான் கொண்ட அணு ஒன்றைக்
கருதுக. (படம் 8.17). அணுக்கருவானது புரோட்டான் மற்றும் நியூட்ரான்களை உள்ளடக்கியது.
புரோட்டான் நேர் மின்தன்மையையும் நியூட்ரான் மின் நடுநிலைமையாகவும் உள்ளதால், அணுக்கருவின்
மின்னூட்டம் முழுவதும் புரோட்டான்களின் மின்னூட்டத்தையே சாரும்.
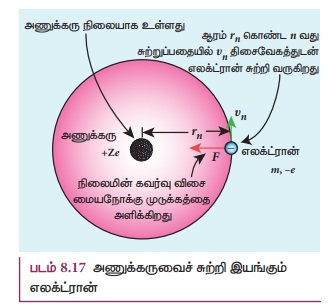
படம் 8.17 அணுக்கருவைச் சுற்றி இயங்கும் எலக்ட்ரான்
குறிப்பிட்ட ஒரு அணுவின் அணு எண் Z என்க. எனில்
+Ze என்பது அணுக்கருவின் (புரோட்டான்களின்) மின்னூட்டம் மற்றும் -e என்பது எலக்ட்ரானின்
மின்னூட்டம் ஆகும். கூலூம் விதிப்படி,
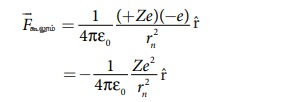
இந்த விசையே எலக்ட்ரான் சுற்றுப்பாதையில் இயங்கத்
தேவைப்படும் மைய நோக்கு விசையை அளிக்கிறது.
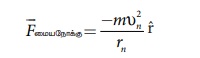
வட்ட சுற்றுப்பாதையில் இயங்கும் எலக்ட்ரானின்
நிறை m எனவும் அதன் திசைவேகம் vn எனவும் கொள்க.
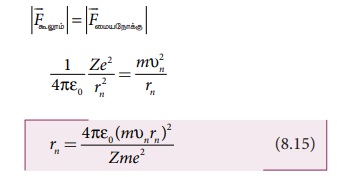
நீல்ஸ் போர் கொள்கையின் படி, கோண உந்த குவாண்டமாக்கல்
நிபந்தனை, ppppppppppppp ஆகும். எனவே,
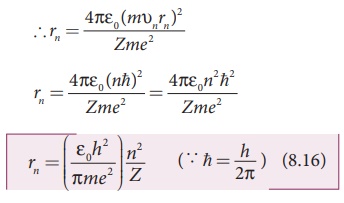
இங்கு ![]() மேலும் ∈0 ,
h, e மற்றும் π
ஆகியவை மாறிலிகள். ஆதலால் சுற்றுப்பாதையின் ஆரம்
மேலும் ∈0 ,
h, e மற்றும் π
ஆகியவை மாறிலிகள். ஆதலால் சுற்றுப்பாதையின் ஆரம்
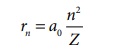
இங்கு 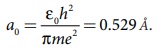 இதுவே போர் ஆரம் எனப்படும். இது அணு ஒன்றின் உள்ள
சுற்றுப்பாதையின் சிறும் ஆரம் ஆகும். போர் ஆரம் ஆனது போர் எனும் நீளத்தின் ஒரு அலகாகப்பயன்படுகிறது.
1 Bohr = 0.53 Å ஹைட்ரஜன் அணுவுக்கு (Z = 1), n ஆவது சுற்றுப்பாதையின் ஆரம்
இதுவே போர் ஆரம் எனப்படும். இது அணு ஒன்றின் உள்ள
சுற்றுப்பாதையின் சிறும் ஆரம் ஆகும். போர் ஆரம் ஆனது போர் எனும் நீளத்தின் ஒரு அலகாகப்பயன்படுகிறது.
1 Bohr = 0.53 Å ஹைட்ரஜன் அணுவுக்கு (Z = 1), n ஆவது சுற்றுப்பாதையின் ஆரம்
rn = a0n2
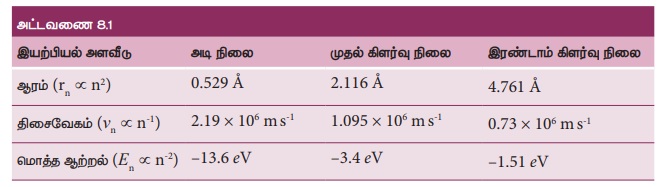
n = 1, முதல் சுற்றுப்பாதைக்கு (அடிநிலை)
r1 = a0 = 0.529 Å
n = 2, இரண்டாவது சுற்றுப்பாதைக்கு (முதல்
கிளர்வு நிலை)
r2 = 4a0 = 2.116 Å
n = 3, மூன்றாவது சுற்றுப்பாதைக்கு (இரண்டாவது
கிளர்வு நிலை),
r3 = 9a0 = 4.761 Å
மற்றும் பல ....
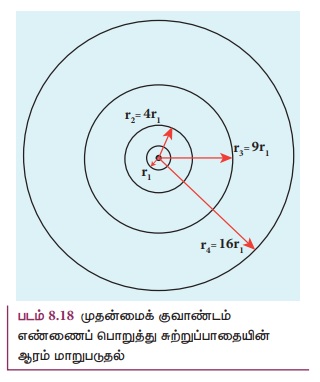
ஆகவே, சுற்றுப்பாதையின் ஆரம் rn
∝ n2 என்றவாறு அதிகரிக்கின்றது
(படம் 8.18).
மேலும், போரின் கோண உந்த குவாண்டமாக்கல் நிபந்தனைப்படி,
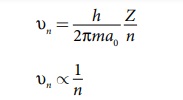
படம் 8.18 முதன்மைக் குவாண்டம் எண்ணைப் பொறுத்து
சுற்றுப்பாதையின் ஆரம் மாறுபடுதல்
படம் 8.19 இல் இருந்து, முதன்மை குவாண்டம்
எண் அதிகரிக்கும் போது எலக்ட்ரானின் திசைவேகம் குறைகிறது என்பதைக் கவனிக்கவும். இவ்வரைப்படம்
ஒரு செவ்வகப் பரவளையமாகும். கிளர்ச்சி நிலைகளுடன் ஒப்பிடும் போது, அடிநிலையிலுள்ள எலக்ட்ரானின்
திசைவேகம் பெருமமாக உள்ளதை இது உணர்த்துகிறது.
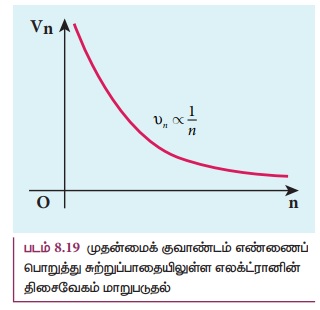
படம் 8.19 முதன்மைக் குவாண்டம் எண்ணைப் பொறுத்து
சுற்றுப்பாதையிலுள்ள எலக்ட்ரானின் திசைவேகம் மாறுபடுதல்
nஆவது
வட்டப்பாதையில் எலக்ட்ரானின் ஆற்றல்
நிலை மின்னியல் விசை ஒரு ஆற்றல் மாற்றா விசை
ஆதலால், 1 ஆவது சுற்றுப்பாதையின் நிலை மின்னழுத்த ஆற்றல்

இங்கு n என்பது முதன்மை குவாண்டம் எண். சமன்பாடு
(8-17)-ல் தோன்றும் எதிர்க்குறி அணுக்கருவுடன்எ லக்ட்ரான் பிணைக்கப்பட்டுள்ளதைக் காட்டுகிறது.
எலக்ட்ரானின் நிறை m, மின்னூட்டம் e, வெற்றிடத்தின்
விடுதிறன் ∈0 மற்றும்
பிளாங்க் மாறிலி h ஆகிய மதிப்புகளைப் பிரதியிட்டு, eV அலகில் எழுதினால்
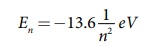
முதல் சுற்றுப்பாதையில் (அடிநிலை), எலக்ட்ரானின்
மொத்த ஆற்றல் E1 = -13.6 eV.
இரண்டாவது சுற்றுப்பாதையில் (முதல் கிளர்வு
நிலை), எலக்ட்ரானின் மொத்த ஆற்றல் E2 = -3.4eV.
மூன்றாவது சுற்றுப்பாதையில் (இரண்டாவது கிளர்வு
நிலை), எலக்ட்ரானின் மொத்த ஆற்றல் E3 = 1.51eV
இதேபோல் அடுத்தடுத்த ஆற்றல் நிலைகளும் அமையும்.
அடிநிலையின் ஆற்றலை விட, முதல் கிளர்வு நிலையின்
ஆற்றல் அதிகமாகும்; அதை (முதல் கிளர்வு நிலையின் ஆற்றல்) விட இரண்டாவது கிளர்வு நிலையின்
ஆற்றல் அதிகமாகவும் உள்ளதைக் கவனிக்கவும். அணுக்கருவுக்கு மிகவும் அருகில் அமைந்துள்ள
சுற்றுப்பாதையின் ஆற்றல், சிறும மதிப்பைப் பெற்றுள்ளது. எனவே இதை அடிநிலை ஆற்றல் (சிறும
நிலை ஆற்றல்) என்கிறோம். ஹைட்ரஜனின் அடிநிலை ஆற்றல் மதிப்பு -13.6eV ஆகும். இந்த மதிப்பு
ரிட்பெர்க் எனும் ஆற்றலின் ஒரு அலகாகப் பயன்படுத்தப்படுகிறது. அதாவது, 1 ரிட்பெர்க்
(Rydberg) = -13.6eV.
ஆற்றலின் மதிப்புகள் எதிர்க்குறியைப் பெற்றிருப்பதற்குக்
காரணம் நிலை மின்னழுத்த ஆற்றலின் சுழி மதிப்பை வரையறுக்கும் முறைதான். அணுக்கருவிலிருந்து
முடிவிலாத் தொலைவிற்கு (அதாவது, மிக அதிகத் தொலைவிற்கு ) எலக்ட்ரானை எடுத்துச் செல்லும்போது,
நிலை மின்னழுத்த மற்றும் இயக்க ஆற்றல்கள் சுழி மதிப்பை அடைகின்றன. அதாவது, மொத்த ஆற்றல்
சுழி மதிப்பை அடைகின்றது.
படம் 8.20-இல், அதிகரிக்கும் n-இன் மதிப்புக்கு
ஏற்ப ஆற்றல் மட்டப் படங்களும் சுற்றுப்பாதைகளின் வடிவங்களும் கொடுக்கப்பட்டுள்ளன. முதன்மை
குவாண்டம் எண்ணின் (n) மதிப்பு அதிகரிக்கும் போது, கிளர்ச்சி நிலைகளின் ஆற்றல் மட்டங்கள்
நெருக்கமாக உள்ளதைக் கவனிக்கவும்.
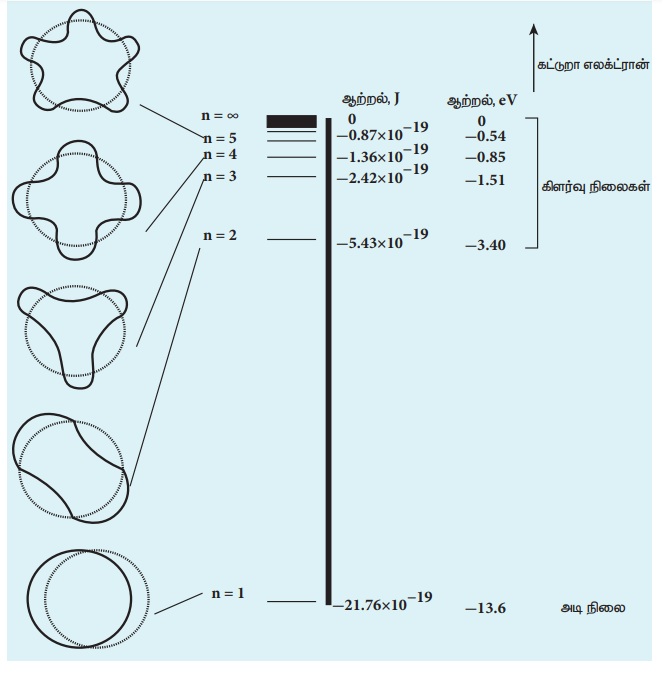
எடுத்துக்காட்டு
8.3
அ) முதல் போர் சுற்றுப்பாதையில், எலக்ட்ரானின்
திசைவேகம் ஒளியின் திசைவேகம் இடையேயான தகவு பரிமாணம் இல்லாத ஒரு எண் என்பதை நிறுவுக.
ஆ) போர் அணுமாதிரியில் அடிநிலை, முதல் கிளர்வு
நிலை மற்றும் இரண்டாவது கிளர்வு நிலைகளில் உள்ள எலக்ட்ரான்களின் திசைவேகங்களைக் கணக்கிடுக.
தீர்வு
:
n ஆவது சுற்றுப்பாதையில் எலக்ட்ரானின் திசைவேகம்
p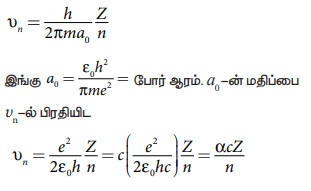
இங்கு c என்பது வெற்றிடத்தில் ஒளியின் திசைவேகம்,
இதன் மதிப்பு c = 3 x 108 m s-1 மற்றும் a என்பது நுண்வரியமைப்பு
மாறிலி (fine structure constant).
ஹைட்ரஜன் அணுவுக்கு Z=1 மற்றும் முதல் சுற்றுப்பாதைக்கு
n=1. எனவே முதல் சுற்றுப்பாதையில் எலக்ட்ரானின் திசை வேகத்திற்கு வெற்றிடத்தில் ஒளியின்
மேலும் திசைவேகத்திற்கு இடையேயான தகவு
p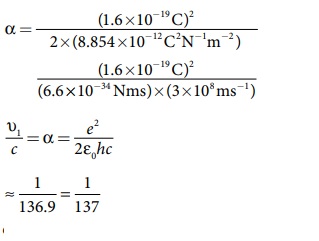
இது ஒரு பரிமாணம் இல்லாத எண் ஆகும்.
=> a = 1/137
ஆ) நுண்வரியமைப்பு மாறிலியைப் பயன்படுத்தி,
எலக்ட்ரானின் திசைவேகத்தைப் பின்வருமாறு எழுதலாம்
⇒ α = 1/137
ஹைட்ரஜன் அணுவுக்கு Z = 1. எனவே n ஆனது சுற்றுப்பாதையில்,
எலக்ட்ரானின் திசைவேகம்
υn = αcZ / n
முதல் சுற்றுப்பாதையில் (அடிநிலை), எலக்ட்ரானின்
திசைவேகம்
υn = c/137 × 1/n = (2.19×106) × 1/n ms−1
இரண்டாவது சுற்றுப்பாதையில் (முதல் கிளர்வு
நிலை), எலக்ட்ரானின் திசைவேகம்
υ = 2.19×106 ms−1
மூன்றாவது சுற்றுப்பாதையில் (இரண்டாவது கிளர்வு
நிலை), எலக்ட்ரான் திசைவேகம்
υ2 = 1.095×106 ms−1
இதிலிருந்து,
எடுத்துக்காட்டு
8.4
அணுக்கரு நிலையாகவும் அணுக்கருவைச் சுற்றி
எலக்ட்ரான்கள் இயங்குவதாகவும் கருத்தில் கொண்டு போர் அணுமாதிரியின் சமன்பாடுகள் தருவிக்கப்பட்டுள்ளன.
அணுக்கருவும் இயக்கத்தில் உள்ளதாகக் கருதினால், அத்தகைய அமைப்பில் ஆற்றலின் கோவையைத்
தருவிக்கவும்.
தீர்வு
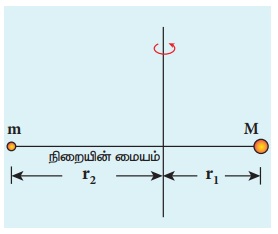
எலக்ட்ரானின் நிறை m மற்றும் அணுக்கருவின்
நிறை M என்க. புறவிசை ஏதும் இவ்வமைப்பின் மீது புறவிசை ஏதும் செயல்படாததால், ஹைட்ரஜன்
அணுவின் நிறை மையம் நிலையாக இருக்கும். எனவே, நிறையின் மையத்தைப் பொருத்து அணுக்கருவும்
எலக்ட்ரானும் இயக்கத்தில் இருக்கும் (படம் 8.21).
எலக்ட்ரானின் திசைவேகம் v மற்றும் அணுக்கருவின்
திசைவேகம் V என்க. இவ்வமைப்பின் மொத்த நேர்க்கோட்டு உந்தம் சுழி ஆகும். எனவே,

அமைப்பின் நிலை மின்னழுத்த ஆற்றல் எந்த மாறுபாடும்
அடையவில்லை ஆதலால், நிறைக்குப் பதிலாக சுருக்கிய நிறையைப் பதிலீடு செய்து ஹைட்ரஜன்
அணுவின் மொத்த ஆற்றலைப் பெறலாம்.
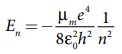
எலக்ட்ரானின் நிறையைக் காட்டிலும் அணுக்கருவின்
நிறை மிக அதிகமாதலால், சுருக்கிய நிறையின் மதிப்பு ஆனது எலக்ட்ரானின் நிறைக்கு ஏறத்தாழ
சமமாகும்.
குறிப்பு
ஹைட்ரஜன் நிறமாலை வரிகளின் குறைந்த அலைநீளப் பகுதியில், முதன்மை
) வரிகளுடன் கூட மங்கலான வரிகள் உடனிருப்பதை H.C. யுரே மற்றும் அவரது குழு 1931-ல்
கண்டறிந்தது. ஐசோடோப்பு இடப்பெயர்ச்சி விளைவு (அல்லது ஐசோடோப்பு நகர்வு) காரணமாக ஒரே
தனிமத்தின் ஐசோடோப்புகள் சற்றே வேறுபட்ட நிறமாலை வரிகளை வெளிவிடுகின்றன. இந்த மங்கலான
வரிகளின் தோற்றம் ஹைட்ரஜன் அணுவில் ஐசோடோப்பு உள்ளதை உறுதிப்படுத்தியது (இதுவே டியூட்டிரியம்
எனப் பெயரிடப்பட்டது).
நிறமாலையில் ஒளி மிகுந்த வரிகளுக்கும் மங்கலான வரிகளுக்கும் இடையே
உள்ள அலைநீள அல்லது அலை எண் வேறுபாட்டைக் கொண்டு டியூட்டிரியம் அணுவின் நிறை ஹைட்ரஜன்
அணுவின் நிறையைப் போல் இரு மடங்காகும் என்பது கணக்கிடப்பட்டது. போர் அணு மாதிரியினால்
இந்த ஐசோடோப்பு நகர்வை விளக்க இயலவில்லை . (மிகச்சிறிய அளவே இருந்தாலும், அணுக்கருவின்
இயக்கம் கண்டறியப்பட்டதால்) போரின் அணு மாதிரியில் அணுக்கரு இயக்கத்தைக் கருத்தில்
கொண்டு கருத்தியல் அடிப்படையில் கணக்கிடப்பட்ட ஹைட்ரஜன் மற்றும் டியூட்டிரிய அணுக்களின்
அலை எண் அல்லது அலைநீள வேறுபாடுகள் நிறைமாலைகளின் கண்டறியப்பட்ட மதிப்புகளுடன் பொருந்தி
வந்தன.
ஹைட்ரஜன் அணுவுக்கும் டியூட்டிரியம் அணுவுக்கும் இடையேயான வேறுபாடு
என்னவெனில் ஹைட்ரஜன் அணுவில் ஒரு எலக்ட்ரானும் ஒரு புரோட்டானும் உள்ளன. மாறாக டியூட்டிரியம்
அணுவில் ஒரு எலக்ட்ரான், ஒரு புரோட்டான் மற்றும் ஒரு நியூட்ரான் ஆகியவை உள்ளன.
கிளர்வு
ஆற்றலும் கிளர்வு மின்னழுத்தமும்
எந்தவொரு குறைந்த ஆற்றல் நிலையிலிருந்தும்
அதைவிட அதிக ஆற்றல் நிலைக்கு ஒரு எலக்ட்ரானை கிளர்வுறச் செய்ய தேவைப்படும் ஆற்றல் கிளர்வு
ஆற்றல் எனப்படும்.
அடிநிலையிலிருந்து (n=1) முதல் கிளர்வு நிலைக்கு
(n=2) ஒரு எலக்ட்ரானை எடுத்துக் செல்லத் தேவைப்படும் கிளர்வு ஆற்றலானது முதல் கிளர்வு
ஆற்றல் எனப்படுகிறது. E1 = E2 - E1 = -3.4 eV -
(-13.6eV) = 10.2eV
இதேபோல், அடிநிலையிலிருந்து (n=1) இரண்டாவது
கிளர்வு நிலைக்கு (n =3) எடுத்துச்செல்லத் தேவைப்படும் கிளர்வு ஆற்றல் இரண்டாம் கிளர்வு
ஆற்றல் எனப்படுகிறது
EII = E3 - E1
=-1.51 eV - (-13.6 eV) = 12.1 eV
அதேபோல் அடுத்தடுத்தவை.
ஓரலகு மின்னூட்டம் பெற்ற மின்துகள் ஒன்றின்
கிளர்வு ஆற்றல் கிளர்வு மின்னழுத்தம் என்றழைக்கப்படுகிறது.
முதல் கிளர்வு மின்னழுத்தம்
E1
= eV1 => V1 = 1/e E1 = 10.2 volt
இரண்டாம் கிளர்வு மின்னழுத்தம்,
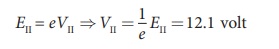
அதேபோல் அடுத்தடுத்தவை...
அயனியாக்க
ஆற்றலும் அயனியாக்க மின்னழுத்தமும்
எலக்ட்ரான் ஒன்றினை அணுவிலிருந்து முற்றிலுமாக
வெளியேற்றினால், அதாவது, En->∞ என்ற
ஆற்றல் நிலையை அது அடைந்தால், அவ்வணு அயனியாக்கம் செய்யப்பட்டுள்ளது எனலாம். அடிநிலையிலுள்ள
அணுவின் எலக்ட்ரான் ஒன்றினை அதிலிருந்து வெளியேற்றத் தேவைப்படும் சிறும ஆற்றல் பிணைப்பு
ஆற்றல் அல்லது அயனியாக்க ஆற்றல் என்று அழைக்கப்படுகிறது.
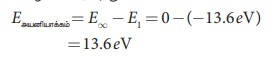
n ஆவது ஆற்றல் நிலையில் ஒரு எலக்ட்ரானை வெளியேற்றத்
தேவைப்படும் அயனியாக்க ஆற்றல்,
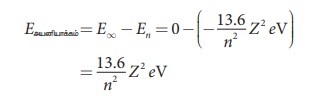
சாதாரண அறை வெப்பநிலையில், ஹைட்ரஜன் அணுவிலுள்ள (Z=1) எலக்ட்ரான் பெரும்பாலும் அடிநிலையிலேயே உள்ளது. அடிநிலையிலுள்ள (n->∞ எனில் E = 0) எலக்ட்ரான் ஒன்றை வெளியேற்றி அதனை கட்டற்றதாக மாற்றத் தேவைப்படும் ஆற்றல் (13.6 eV) முதல் அயனியாக்க ஆற்றல் எனப்படும். இப்போது, அந்த ஹைட்ரஜன் அணு அயனியாக்க நிலையில் உள்ளது அல்லது ஹைட்ரஜன் அயனி H* என அழைக்கப்படுகிறது. நாம் அளிக்கும் ஆற்றல் அயனியாக்க ஆற்றலை விட அதிகமாக இருந்தால், அதிகப்படியாக உள்ள ஆற்றல் கட்டுறா எலக்ட்ரான்களின் (free electron) இயக்க ஆற்றலாக அளிக்கப்படும்.
ஓரலகு மின்னூட்டத்திற்கான அயனியாக்க ஆற்றல்
அயனியாக்க மின்னழுத்தம் என வரையறுக்கப்படுகிறது.
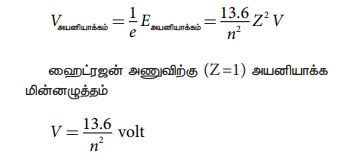
ஹைட்ரஜன் அணுவிற்கு (Z=1) அயனியாக்க மின்னழுத்தம்
V = 13.6 / n2
volt
அடிநிலை, முதல் கிளர்வு நிலை மற்றும் இரண்டாம்
கிளர்வு நிலைகளின் ஆரம், திசைவேகம் மற்றும் மொத்த ஆற்றல் ஆகியவை அட்டவணை 8.1-ல் கொடுக்கப்பட்டுள்ளன.
எடுத்துக்காட்டு
8.5
ஹைட்ரஜனைப் போன்றதொரு அணு ஒன்றின் ஆற்றல் pppppppppp
எனில் பின்வருவனவற்றைக் கணக்கிடவும். இங்கு nEN
அ) அந்த அணுவின் ஆற்றல் மட்டங்களை வரையவும்;
மேலும் அதன் அணு எண்ணைக் கணக்கிடவும்.
ஆ) அணு அடிநிலையில் உள்ளது எனில், அதன் முதல்
கிளர்வு மின்னழுத்தம் மற்றும் அயனியாக்க மின்னழுத்தம் ஆகியவற்றைக் கணக்கிடுக.
இ) முறையே 42 eV மற்றும் 56 eV ஆற்றல் கொண்ட
இரு போட்டான்களை அந்த அணுவின் மீது மோதச் செய்தால், அவற்றை அந்த அணு உட்கவருமா?
ஈ) முதல் போர் சுற்றுப்பாதையின் ஆரத்தைக் கண்டறிக.
உ) அடிநிலையில் அதன் இயக்க மற்றும் மின்னழுத்த
ஆற்றல்களைக் கணக்கிடுக.
தீர்வு
அ) En =-54.4/n2 eV
எனவே,
n = 1 எனில், அடிநிலை ஆற்றல்
n = 2 எனில், E2 = -13.6 ev; E3
= -6.04 eV, E4. = -3.4 eV அதேபோல் மற்றவை

Z என்பது அணு எண்; கொடுக்கப்பட்டுள்ள ஆற்றல்
மதிப்பை ஒப்பிடும் போது, -13.6 Z2 = - 54.4 =>
Z=±2 அணு எண் எதிர்க்குறி எண்ணாக இருக்க முடியாது. எனவே Z = 2.
இ) முதல் கிளர்வு ஆற்றல்
E1 = E2 - E1
=-13.6eV- (-54.4eV)
= 40.8eV
எனவே முதல் கிளர்வு மின்னழுத்தம்

ஈ) இரு போட்டான்களை A மற்றும் B என்க. போட்டான்
A-வின் ஆற்றல் 42 eV மற்றும் போட்டான் B-ன் ஆற்றல் 51 eV.
போர் கொள்கையின் படி, ஆற்றல் மட்டங்களுக்கு
இடையேயான வேறுபாட்டுக்குச் சமமான ஆற்றல் கொண்ட போட்டானை அணு உட்கவரும்; சமமாக இல்லையெனில்,
உட்கவராது.
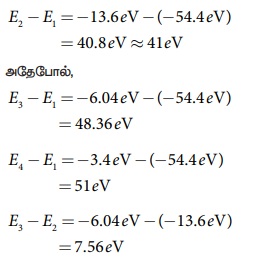
அதேபோல் அடுத்தடுத்தவை
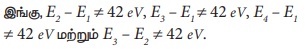 எந்தவொரு வாய்ப்பிலும்
(42 eV) போட்டான் ஆற்றல் மதிப்பின் முழு மடங்குக்குச் சமமான ஆற்றல் வேறுபாடு அமையாததால்,
போட்டான் A இந்த அணுவால் உட்கவரப்படுவதில்லை. ஆனால், போட்டான் Bயைப் பொருத்தவரை, E4
– E1 = 51 eV, ஆகையால், இவ்வணுவால், போட்டான் B உட்கவரப்படுகின்றது.
எந்தவொரு வாய்ப்பிலும்
(42 eV) போட்டான் ஆற்றல் மதிப்பின் முழு மடங்குக்குச் சமமான ஆற்றல் வேறுபாடு அமையாததால்,
போட்டான் A இந்த அணுவால் உட்கவரப்படுவதில்லை. ஆனால், போட்டான் Bயைப் பொருத்தவரை, E4
– E1 = 51 eV, ஆகையால், இவ்வணுவால், போட்டான் B உட்கவரப்படுகின்றது.
உ) போர் அணுமாதிரியில், மொத்த ஆற்றலானது இயக்க
ஆற்றலின் எதிர்க்குறி மதிப்புக்குச் சமம் ஆதலால்,
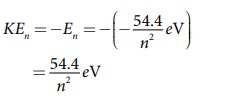
நிலைமின்னழுத்த ஆற்றலானது இயக்க ஆற்றலின் எதிர்க்குறி
மதிப்பின் இரு மடங்காகும். எனவே,