புத்தக வினாக்கள் மற்றும் முக்கிய கேள்வி பதில்கள் | வேதியியல் - அணைவு வேதியியல் : பின்வரும் வினாக்களுக்கு விடையளிக்க | 12th Chemistry : UNIT 5 : Coordination Chemistry
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 5 : அணைவு வேதியியல்
அணைவு வேதியியல் : பின்வரும் வினாக்களுக்கு விடையளிக்க
வேதியியல் : அணைவு வேதியியல்
II. பின்வரும் வினாக்களுக்கு விடையளிக்க
1. பின்வரும் அணைவுச் சேர்மங்களுக்கு IUPAC பெயர் தருக.
i) Na2 [Ni (EDTA)]
ii) [Ag (CN)2]-
iii) [Co(en)3]2 (SO4)3
v) [Co (ONO) (NH3)5]2+
i) சோடியம் 2, 2', 2", 2"' - (ஈத்தேன் - 1, 2 – டை ஐல் டை நைட்ரிலோ) டெட்ரா அசிட்டேட்டோ நிக்கலேட் (II)
ii) டைசயனிடோ K-C அர்ஜென்டேட் (1) அயனி
iii)டிரிஸ் (எத்திலீன் -1, 2 - டை அமீன்) கோபால்ட் (III) சல்பேட்
iv)பென்டா அம்மைன் நைட்ரிட்டோ _ K-O கோபால்ட் (III) அயனி
v) டை அம்மீன் குளோரிடோ நைட்ரிட்டோ - K-N
பிளாட்டினம் (II)
2. பின்வரும் பெயருடைய அணைவுச் சேர்மங்களுக்கு உரிய வாய்ப்பாட்டினைத் தருக
அ) பொட்டாசியம் ஹெக்சாசயனிடோபெர்ரேட் (II)
ஆ) பென்டாகார்பனைல் இரும்பு (0)
இ) பென் டாஅம்மைன் நைட்ரிடோ -k –N கோபால்ட் (III) அயனி
ஈ) ஹெக்ஸா அம்மைன் கோபால்ட் (III) சல்பேட்
உ) சோடியம் டெட்ரா புளுரிடோடைஹைட்ராக்ஸி டோகுரோமேட் (III)
அ) K4[Fe(CN)6]
ஆ) [Fe (CO)5]
இ) [Co(NH3)5 (NO2)]2+
ஈ) [Co[NH3)6]2 (SO4)3
உ) Na3[CrF4(OH)2]
3. பின்வரும் அணைவுச் சேர்மங்களை அவைகளின் மோலார் கடத்துத் திறனின் ஏறு வரிசையில் எழுதுக.
i) Mg[Cr(NH3)(Cl)5 ]
ii) [Cr(NH3)5Cl]3[CoF6]2
iii) [Cr(NH3)3 Cl3]
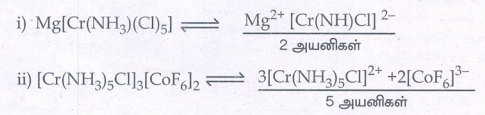
iii) [Cr(NH3)3Cl3] - நடுநிலை அணைவு. எனவே கரைசலில் அயனியுறுவதில்லை . அயனிகள் எண்ணிக்கை அதிகரிக்கும் போது, மோலார் கடத்து திறன் அதிகரிக்கிறது.
ஃ எனவே மோலார் கடத்து திறன் ஏறு வரிசை
[Cr(NH3)3Cl3] < Mg (Cr(NH3)Cl5] < [Cr(NH3) 5Cl] 3[CoF6] 2
4. டை மீத்தைல் கிளையாக்ஸைமின் ஆல்கஹால் கலந்த கரைசலைப் பயன்படுத்தி Ni + கண்டறியப்படுகிறது. இவ்வினையில் உருவாகும் ரோஜா சிவப்பு நிற அணைவுச் சேர்மத்தின் வாய்ப்பாட்டினை எழுதுக
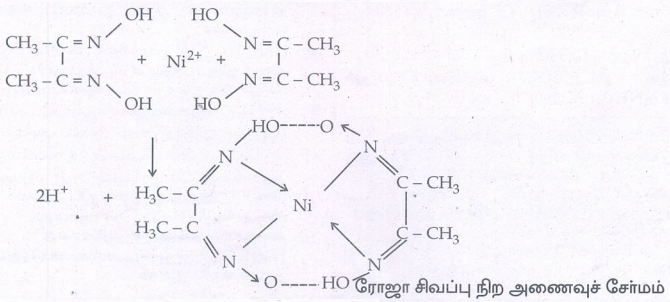
• Ni2+ அயனி டைமீத்தைல் கிளையாக்ஸைம் என்ற ஈனியுடன் இணைந்து பிஸ் (டை மீத்தைல் கிளையாக்ஸைம்) நிக்கல் (II) என்ற அணைவுச் சேர்மத்தை உருவாக்குகிறது.
• இது ஒரு சிவப்பு நிற நடுநிலை அணைவுச் சேர்மம் ஆகும்.
• இவ்வினை பண்பறி பகுப்பாய்வில் நிக்கலின் உறுதிச் சோதனையாகவும் பருமனறி பகுப்பாய்வில் நிக்கலை அளந்தறியவும் பயன்படுகிறது.
5. [CuCl4]2- சாத்தியமானது [Cul4]2-? சாத்தியமற்றது ஏன்?
• குளோரின் அணுவின் உருவளவு சிறியது, எனவே [CuCl4] 2- சாத்தியமானது.
ஆனால் அயோடின் அணுவின் உருவளவு பெரியது, எனவே [Cul4]2- சாத்தியமற்றது.
• I- அயனி Cu2+ அயனியை Cu+ அயனியாக ஒடுக்குவதால், குப்ரிக் அயோடைடு, குப்ரஸ் அயோடைடாக மாறுகிறது. எனவே [CuI4]2- சாத்தியமற்றது. ஆனால் CI- ஆல் இவ்வாறு ஒடுக்கம் நடைபெறவில்லை . எனவே [CuCl4] 2- சாத்தியமானது.
6. [Ag(NH3) 2]+ என்ற அணைவுச் சேர்மத்தின் நிலைப்பு மாறிலி 1.7 x 107 எனில், 0.2 M NH3 கரைசலில், [Ag+]/[Ag(NH3)2] விகிதத்தினைக் கண்டறிக.

7. மருத்துவத்துறையில் பயன்படும் அணைவுச் சேர்மத்திற்கு ஓர் எடுத்துக்காட்டு தருக. மேலும் உயிரியல் முக்கியத்துவம் வாய்ந்த அணைவுச் சேர்மங்களுக்கு இரு எடுத்துக்காட்டுகள் தருக.
• சிஸ் - பிளாட்டின் என்ற அணைவுச் சேர்மம் புற்று நோய் கட்டிகளுக்கு எதிரான மருந்துப்பொருளாக பயன்படுகிறது.
• உயிரியல் முக்கியத்துவம் வாய்ந்த அணைவுச் சேர்மங்கள்.
1. ஹீமோகுளோபின் - இரத்தத்தில் ஆக்சிஜனை எடுத்துச் செல்லுதல்.
2. குளோரோபில் - தாவரங்களில் ஒளிச்சேர்க்கைக்கு உதவுதல்.
8. [Cr(NHS3)6]3+ ஆனது ஏன் பாராகாந்தத் தன்மையுடையது எனவும், [Ni(CN)4]2- ஆனது ஏன் டையா காந்தத் தன்மையுடையது எனவும் VB கொள்கையின் அடிப்படையில் விளக்குக.
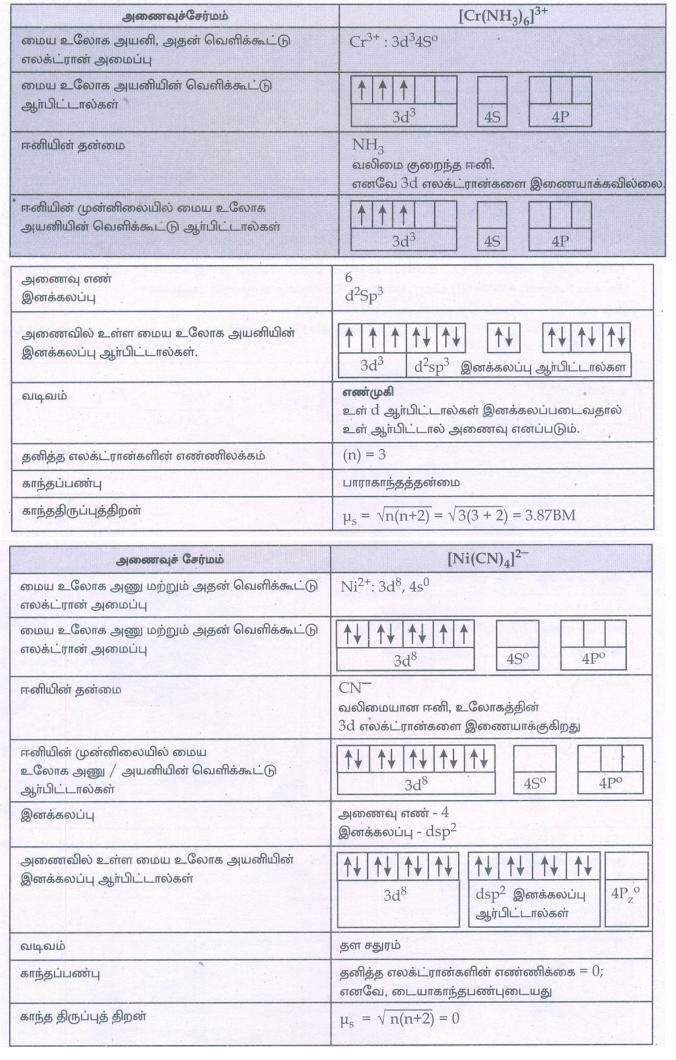
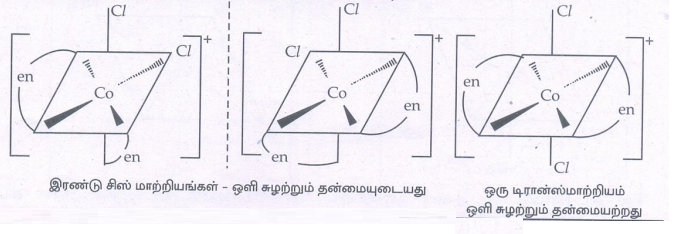
9. [Co(en)2Cl2]+ என்ற அணைவுச் சேர்மத்திற்கு சாத்தியமான அனைத்து வடிவ மாற்றியங்களையும் வரைக. அவற்றுள் ஒளி சுழற்றும் தன்மையுடைய மாற்றியங்களைக் கண்டறிக.
10. [Ti (H2O)6]3+T நிறமுடையது ஆனால் (Sc (H,O]* நிறமற்றது விளக்குக.
• [Ti (H2O)6]3+ அணைவுச் சேர்மத்தில் மைய உலோக அயனி Ti3+ ஆனது d1 எலக்ட்ரான் அமைப்பினைப் பெற்றுள்ளது.
• இது ஈனி புலத்தில் t2g. ஆர்பிட்டால் ஒன்றில் இடம்பெற்றுள்ளது.
• இந்த அணைவுச் சேர்மத்தின் மீது வெண்மை நிற ஒளி விழும் போது d எலக்ட்ரான் ஒளியினை உட்கவர்ந்து உயர் ஆற்றல் மட்டத்திற்கு கிளர்வுறுகிறது.
• இது d-d பரிமாற்றம் எனப்படுகிறது.
• நிறமாலைத் தரவுகளிலிருந்து உட்கவர் பெருமம் மதிப்பு 20000 cm-1 ஆகும். இது படிக புலப் பிளப்பு ஆற்றல் (∆0) 239.7 KJ mol-1 க்கு இணையானதாகும்.
• இந்த உட்கவர்தலால், பிரதிபலிக்கப்படும் நிறம் ஊதா ஆகும். ஆதலால் [Ti (H2O)6]3+ ஊதா நிறத்தில் காணப்படுகிறது.
• ஆனால் [Sc(H2O)6]3+ அணைவுச் சேர்மத்தில் SC3+ அயனியின் வெளிக்கூட்டு எலக்ட்ரான் அமைப்பு 3d°
• d°, d10 எலக்ட்ரான் அமைப்பை பெற்றுள்ள மைய உலோக அயனிகளில் d-d பரிமாற்றம் நிகழ வாய்ப்பில்லை.
• எனவே d° எலக்ட்ரான் அமைப்பை பெற்றுள்ள [Sc(H2O)6] 3+ அணைவு நிறமற்றது.
11. [Ma2b2c2] வகை அணைவுச் சேர்மத்திற்கு ஒரு எடுத்துக்காட்டு தருக. இங்கு a, b, c என்பன ஒரு முனை ஈனிகளாகும். மேலும் இவ் அணைவுச் சேர்மத்திற்கு சாத்தியமான அனைத்து மாற்றியங்களையும் தருக.
• [Ma2b2c2]வகை அணைவுச் சேர்மத்திற்கு எடுத்துக்காட்டு [Cr(NH3)2 (H2O)2Br2]+ ஆகும்.
• இச்சேர்மத்திற்கு ஆறு மாற்றிய அமைப்புகள் உள்ளன. வடிவ மாற்றியங்கள் ஐந்து. அவையாவன.
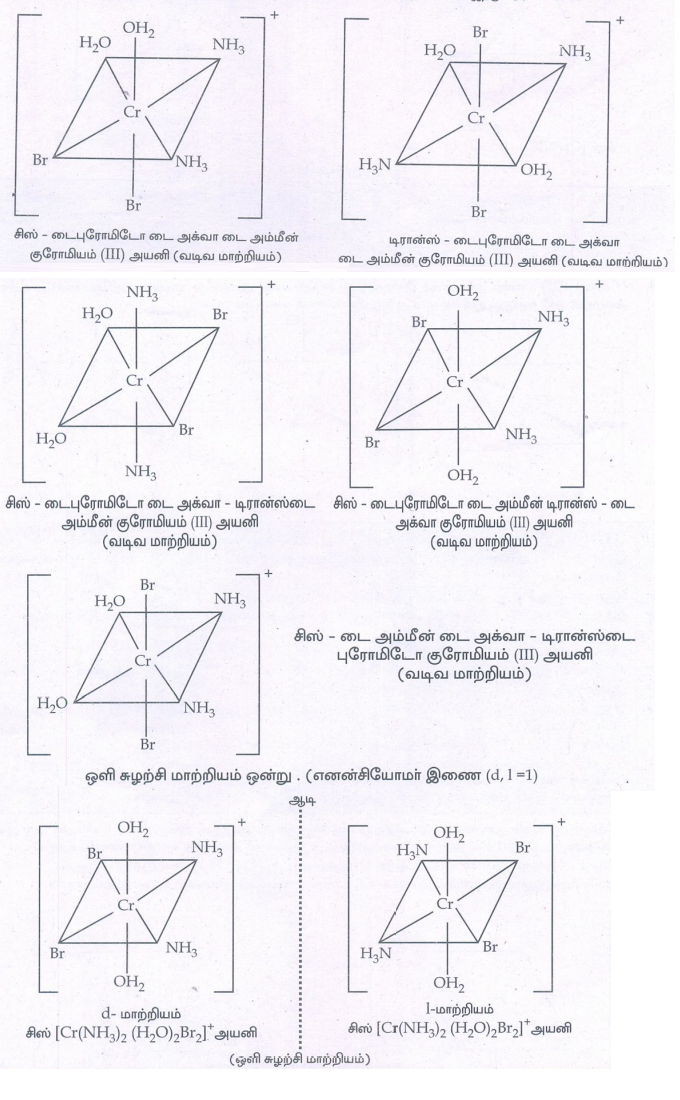
12. [Co(NH3)5Cl] So4 மற்றும் [Co(NH3)5 So4]Cl ஆகிய அணைவுச் சேர்மங்களை வேறுபடுத்தி அறிய உதவும் ஒரு சோதனையைக் கூறுக.
• [Co(NH3)5Cl] So4 மற்றும் [Co(NH3)5SO4]Cl ஆகியன அயனியாதல் மாற்றியங்கள் ஆகும்.
• பேரியம் குளோரைடு கரைசலுடன் வெண்மை நிற வீழ்படிவை உண்டாக்கினால் அந்த அணைவு [Co(NH3)5Cl] So4 ஆகும்.
• சில்வர் நைட்ரேட் கரைசலுடன் வெண்மை நிற வீழ்படிவை உண்டாக்கினால் அந்த அணைவு [Co(NH3)5Cl] So4]Cl ஆகும்.
• இவ்விரு சோதனைகளிலும் அணைவுக் கோளத்திற்கு வெளியே உள்ள அயனிகள் SO42- மற்றும் Cl-ஆகியன அவற்றிற்கான சோதனைகள் முறையே பேரியம் குளோரைடு மற்றும் சில்வர் நைட்ரேட் சோதனைகளுக்கு விடையளிக்கின்றன.
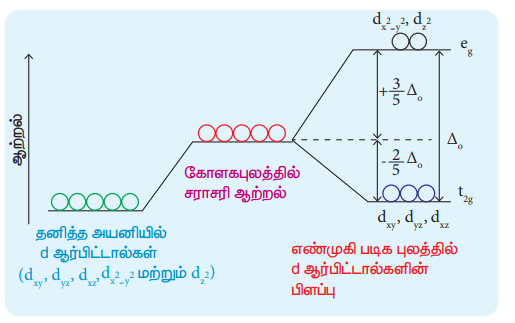
13. எண்முகி படிக புலத்தில் d- ஆர்பிட்டாலின் படிக புலப் பிளப்பினை குறிப்பிடும் வரைபடம் வரைக.
14. இணைப்பு மாற்றியம் என்றால் என்ன? ஒரு எடுத்துக்காட்டுடன் விளக்குக.
இரு வழி பிணைப்புறும் ஈனி தன்னிடம் உள்ள வெவ்வேறு வழங்கி அணுக்களின் மூலம் மைய உலோக அயனியுடன் பிணைப்பினை ஏற்படுத்தும்போது உண்டாகும் மாற்றியம் இணைப்பு மாற்றியம் எனப்படும்.
(எ.கா) [Co(NH3)5 NO2]2+
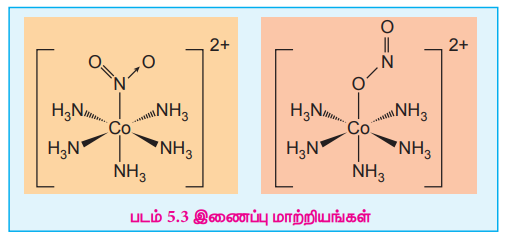
[Co(NH3)5 NO2]2+
பென்டா அம்மீன் நைட்ரைட்டோ - kN கோபால்ட் (III) அயனி N -இணைப்பு [Co(NH3)5 ONO2]2+
பென்டா அம்மீன் நைட்ரைட்டோ - kO கோபால்ட் (III) அயனி - O இணைப்பு.
15. பருமனறி பகுப்பாய்வில் அணைவுச் சேர்மங்களின் பயன்களை சுருக்கமாக விளக்குக
• சில உலோக அயனிகளை அணைவுச் சேர்மமாக்குவதன் மூலம் துல்லியமாக அளந்தறியலாம்.
• (எ.கா) நிக்கல் குளோரைடில் உள்ள Ni2+ அயனியானது, ஆல்கஹாலில் கரைக்கப்பட்ட டைமீத்தைல் கிளையாக்ஸைம் உடன் வினைப்படுத்தப்பட்டு [Ni(DMG)2] என்ற கரையாத அணைவுச் சேர்மமாக மாற்றப்பட்டு துல்லியமாக அளந்தறியப்படுகிறது.
• EDTA என்பது ஒரு கொடுக்கிணைப்பு ஈனி. இது பருமனறி பகுப்பாய்வின் மூலம் அநேக உலோக அயனிகளை அளந்தறிய பயன்படுகிறது. (எ.கா) : Zn2+, Pb2+,, Ca2+,, Co2+, , Ni2+,, Cu2+,
• ஒன்றுக்கு மேற்பட்ட உலோக அயனிகள் உள்ள கரைசலில் ஒரு உலோகத்தை அளந்தறியும் போது, மற்றொரு உலோக அயனி குறுக்கிடாமல் தடுக்கும் மறைப்புக் காரணியாக EDTA பயன்படுகிறது.
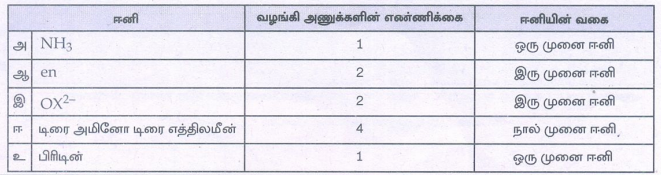
16. பின்வரும் ஈனிகளை அவற்றில் உள்ள வழங்கி அணுக்களின் எண்ணிக்கையின் அடிப்படையில் வகைப்படுத்துக.
அ) NH3
ஆ) en
இ) ox2-
ஈ) டிரைஅமினோடிரைஎத்திலமீன்
உ) பிரிடின்
17. இரட்டை உப்புகள் மற்றும் அணைவுச் சேர்மங்களுக்கு இடையேயான வேறுபாடுகள் யாவை?

இரட்டை உப்புகள்
1. இரட்டை உப்புகள் பிரிகையுற்று தங்கள் தனித்தன்மையை இழக்கின்றன
2. கரைசலில் இரட்டை உப்புகள் அதன் உட்கூறு அயனிகளாக பிரிகையடைகின்றன.
3. (எ.கா) மோர் உப்பு FeSO4(NH4)2 SO4.6H2O
4. கரைசலில் Fe2+,NH4+ So2- ஆகிய அயனிகளாக பிரிந்து அவற்றின் சோதனைகளுக்கு விடை தருகின்றன.
அணைவுச் சேர்மங்கள்
1. அணைவு அயனிகள் தங்கள் தனித்தன்மையை இழப்பதில்லை
2. அணைவு அயனிகள் அதன் உட்கூறு அயனிகளாக பிரிகையடைவதில்லை .
3. K3[Fe(SCN)6]
4. கரைசலில் Fe3+,SCN- என்ற எளிய அயனிகளாக பிரிகையடையாமல் [Fe(SCN)6]3- என்ற அணைவு அயனியாக பிரிகையடைகிறது. எனவே Fe3+, SCN- ஆகிய அயனிகளின் சோதனைக்கு விடை தருவதில்லை.
18. வெர்னர் கொள்கையின் கோட்பாடுகளைக் கூறுக
ஒவ்வொரு அணைவுச் சேர்மத்தின் உலோக அயனியும் இருவிதமான இணைதிறன்களை பெற்றுள்ளன. அவை
(i) முதன்மை இணை திறன் (ii) இரண்டாம் நிலை இணைதிறன்
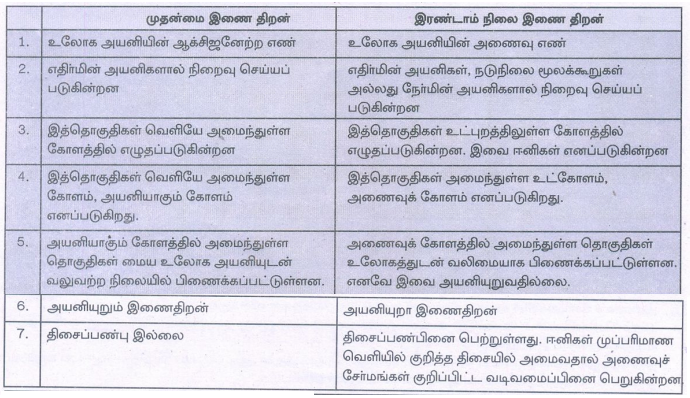
முதன்மை இணை திறன்
1. உலோக அயனியின் ஆக்சிஜனேற்ற எண்
2. எதிர்மின் அயனிகளால் நிறைவு செய்யப்படுகின்றன
3. இத்தொகுதிகள் வெளியே அமைந்துள்ள கோளத்தில் எழுதப்படுகின்றன
4. இத்தொகுதிகள் வெளியே அமைந்துள்ள கோளம் எனப்படுகிறது
5. அயனியாகும் கோளத்தில் அமைந்துள்ள தொகுதிகள் மைய உலோக அயனியுடன். வலுவற்ற நிலையில் பிணைக்கப்பட்டுள்ளன.
6. அயனியுறும் இணைதிறன்
7. திசைப்பண்பு இல்லை
இரண்டாம் நிலை இணை திறன்
1. உலோக அயனியின் அணைவு எண்
2. எதிர்மின் அயனிகள், நடுநிலை மூலக்கூறுகள் அல்லது நேர்மின் அயனிகளால் நிறைவு செய்யப்படுகின்றன
3. இத்தொகுதிகள் உட்புறத்திலுள்ள கோளத்தில் எழுதப்படுகின்றன. இவை ஈனிகள் எனப்படுகின்றன
4. இத்தொகுதிகள் அமைந்துள்ள உட்கோளம், அணைவுக் கோளம் எனப்படுகிறது.
5. அணைவுக் கோளத்தில் அமைந்துள்ள தொகுதிகள் உலோகத்துடன் வலிமையாக பிணைக்கப்பட்டுள்ளன எனவே இவை அயனியுறுவதில்லை.
6. அயனியுறா இணைதிறன்
7. திசைப்பண்பினை பெற்றுள்ளது. ஈனிகள் முப்பரிமாண வெளியில் குறித்த திசையில் அமைவதால் அணைவுச் சேர்மங்கள் குறிப்பிட்ட வடிவமைப்பினை பெறுகின்றன
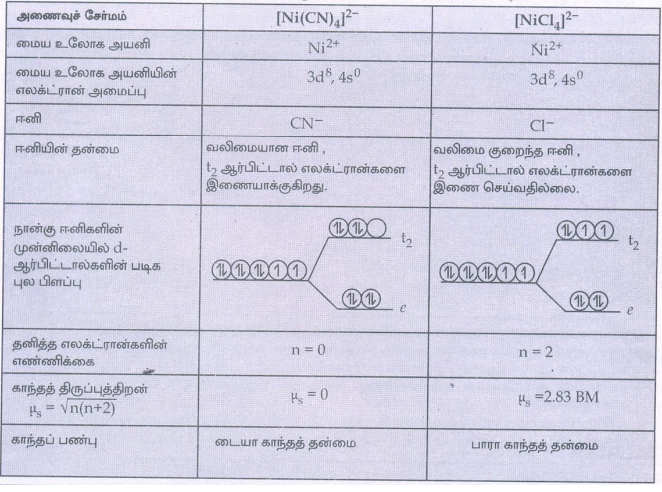
19. [Ni(CN)4]2- டையா காந்தத் தன்மை உடையது ஆனால் [Ni(Cl)4]2- பாரா காந்தத் தன்மை உடையது படிகபுலக் கொள்கையினைப் பயன்படுத்தி விளக்குக.
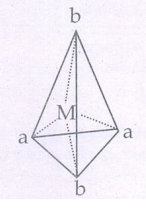
20. நான்முகி அணைவுகள் வடிவ மாற்றியங்களைப் பெற்றிருப்பதில்லை. ஏன்?
நான்முகி அணைவுகளில் உள்ள நான்கு ஈனிகளும் நான்முகியில் அடுத்தடுத்த முனைகளிலேயே அமைவதால், அவை வடிவ மாற்றியங்களைப் பெற்றிருப்பதில்லை [Ma2b2]
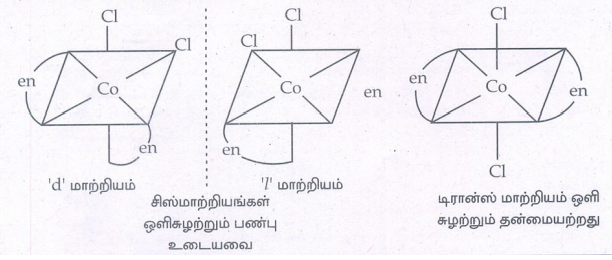
21. அணைவுச் சேர்மங்களில் காணப்படும் ஒளி சுழற்சி மாற்றியங்களை விளக்குக.
• கரிமச் சேர்மங்களைப் போன்றே, கைரல் தன்மையைப் பெற்றுள்ள அணைவுச் சேர்மங்கள் ஒளி சுழற்சி மாற்றியங்களைப் பெற்றுள்ளன.
• ஒளி சுழற்றும் தன்மையுடைய சேர்மங்கள், பொருள் மற்றும் அதன் ஆடி பிம்பம் என தொடர்புடைய மாற்றிய இணைகளாக இருந்தால் அவை இனான்சியோமெர்கள் எனப்படும்.
• இம்மாற்றியங்களின் கரைசல்களின் வழியே தளமுனைவு கொண்ட ஒளியினைச் செலுத்தும்போது அவை ஒளியின் தளத்தினை சுழற்றுகின்றன.
• ஒளியை வலப்புறமாக சுழற்றினால் அம்மாற்றியம் வலஞ்சுழி அல்லது 'd' மாற்றியம் எனவும், இடப்புறமாக சுழற்றினால் இடஞ்சுழி அல்லது ‘l’ மாற்றியம் எனவும் அழைக்கப்படுகின்றது.
• எண்முகி வடிவமைப்பு கொண்ட அணைவுகள் ஒளிசுழற்சி மாற்றியப் பண்பினைப் பெற்றுள்ளன.
• (எ.கா): [CoCl2(en) 2]+ இதன் இரண்டு சிஸ் அமைப்புகள் ஒளி சுழற்றும் பண்பு உடையவை. ஒரு டிரான்ஸ் அமைப்பு ஒளி சுழற்றும் தன்மையற்றது
22. நீரேற்ற மாற்றியங்கள் என்றால் என்ன? ஒரு உதாரணத்துடன் விளக்குக.
• படிக அணுக்கோவைத் தளத்தில் தனித்த நிலையில் காணப்படும் நீர், ஆல்கஹால், அம்மோனியா போன்ற கரைப்பான் மூலக்கூறுகள், அணைவுக் கோளத்தில் உள்ள ஈனிகளுடன் பரிமாற்றம் அடைவதால் வெவ்வேறு மாற்றியங்கள் உருவாகின்றன. இத்தகைய மாற்றியங்கள் கரைப்பானேற்ற மாற்றியங்கள் எனப்படுகின்றன.
• கரைப்பான் ஆனது நீர்மூலக்கூறுகளாக இருந்தால், இம்மாற்றியங்கள் நீரேற்ற மாற்றியங்கள் எனப்படும்.
• (எ.கா): CrCl3.6H2O என்ற அணைவு மூன்று நீரேற்ற மாற்றியங்களைக் கொண்டுள்ளது.

23. படிகப்புல பிளப்பு ஆற்றல் என்றால் என்ன? விளக்குக,
• ஆய அச்சுகளுக்கு இடைப்பட்ட பகுதியில் மடல்களைப் பெற்றிருக்கும் (dxy.dyz மற்றும் dzx) ஆர்பிட்டால்களைக் காட்டிலும் dx2y2 மற்றும் dz2 ஆர்பிட்டால்கள் அச்சுகளின் வழியே அமைந்திருப்பதால் அதிகவிலக்கு விசைக்கு உட்படுகின்றன.
• மேலும் அவைகளின் ஆற்றலும் அதிகரிக்கின்றன. இவ்வாறாக சமஆற்றலுடைய d ஆர்பிட்டால்கள் இந்நிலையில் இரு வகைகளாக பிரிக்கின்றன. இச்செயல்முறை படிகபுலபிளப்பு எனப்படும். இவ்விருவகை ஆர்பிட்டால்களுக்கிடையே உள்ள ஆற்றல் வேறுபாடு படிகப்புலபிளப்பு ஆற்றல் எனப்படும்.
24. படிகப்புல நிலைப்படுத்தல் ஆற்றல் என்றால் (CFSE) என்ன?
ஈனிப்புலம் (ELF) மற்றும் சமச்சீர்புலம் (Eiso) ஆகியவற்றில் காணப்படும் எலக்ட்ரான் அமைப்பினைப் பொருத்து அவ்வாற்றல்களுக்கு இடையேயான வேறுபாடே படிக புல நிலைப்படுத்தும் ஆற்றல் எனப் படுகிறது.
CFSE (∆E0) = {ELF} - {Eiso) = {[nt2g (-0.4)+neg (0.6)] ∆0 +npP} - {n’pP}
இங்கு nt2g = t2g ஆர்பிட்டால்களில் காணப்படும் எலக்ட்ரான்களின் எண்ணிக்கை
neg = eg ஆர்பிட்டால்களில் காணப்படும் எலக்ட்ரான்களின் எண்ணிக்கை
np = ஈனிப்புலத்தில் காணப்படும் எலக்ட்ரான் இரட்டைகளின் எண்ணிக்கை
n1p = சமச்சீர் புலத்தில் காணப்படும் எலக்ட்ரான் இரட்டைகளின் எண்ணிக்கை
P= எலக்ட்ரானை இணையாக்கத் தேவையான ஆற்றல்
25. [Ni(H2O) 6]2+ன் நீர்க்கரைசல் பச்சை நிறமுடையது ஆனால் [Ni(H2O) 6]2-ன் கரைசல் நிறமற்றது விளக்குக.
• [Ni(H2O) 6]2+,அணைவில் H2O ஆனது வலிமைகுறைந்த ஈனி. எனவே Ni2+ அயனியில் உள்ள இரண்டு தனித்த எலக்ட்ரான்களை இணை செய்யாது.
• இவ்விருதனித்த எலக்ட்ரான்களும் ஒளியை உறிஞ்சி d-d பரிமாற்றத்திற்கு உட்படுகின்றன.
• எனவே [Ni(H2O) 6]2+,ன் நீர்க்கரைசல் நிறமுடையது. அது சிவப்பு நிற ஒளியை உட்கவர்ந்து அதன் நிரப்பு நிறமான பச்சை நிறத்தை பிரதிபலிப்பதால், கரைசல் பச்சை நிறமாக தோன்றுகிறது.
• ஆனால் [Ni(CN) 4]2-,அணைவில் CN- ஆனது வலிமை மிகுந்த ஈனி. எனவே Ni2+ அயனியில் உள்ள இரண்டு தனித்த எலக்ட்ரான்களை இணை செய்கிறது.
• தனித்த எலக்ட்ரான் இல்லாத காரணத்தால் d-d பரிமாற்றம் நடைபெறுவதில்லை.
• எனவே [Ni(CN) 4]2- நீர்க்கரைசல் நிறமற்றது.
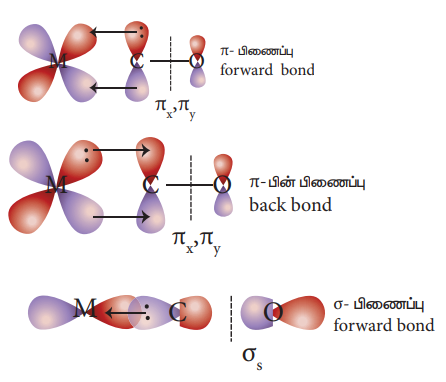
26. உலோக கார்பனைல்களில் காணப்படும் பிணைப்பின் தன்மையினை விளக்குக.
• உலோக கார்பனைல்களில் காணப்படும் உலோக அணு மற்றும் கார்பனைல் ஈனி ஆகியவற்றிற்கு இடையே காணப்படும் பிணைப்பு இரு கூறுகளை உள்ளடக்கியது.
• முதல் கூறு கார்பனைல் ஈனியின் கார்பன் அணு, மைய உலோக அயனியின் காலியான d ஆர்பிட்டாலுக்கு எலக்ட்ரான் இணையினை வழங்கிM ← CO சிக்மா பிணைப்பினை உருவாக்குகிறது. .
• இந்த சிக்மா பிணைப்பு உருவாவதால், உலோக ஆர்பிட்டால்களில் எலக்ட்ரான் அடர்த்தி அதிகரித்து, மைய உலோக அணுவில் எலக்ட்ரான் செறிந்து காணப்படுகிறது.
• இவ்வாறு அதிகரிக்கப்பட்ட எலக்ட்ரான் அடர்த்தியை ஈடு செய்யும் பொருட்டு உலோகத்தின் நிரப்பப்பட்ட d ஆர்பிட்டால்கள் கார்பனைல் ஈனியின் காலியான π* ஆர்பிட்டாலுடன் இடையீடு செய்து, எலக்ட்ரான் அடர்த்தியை மீண்டும் ஈனிக்கு பரிமாற்றம் செய்கிறது. இந்த இரண்டாவது கூறு π பின் பிணைப்பு (back bonding) எனப்படுகிறது.
• எனவே உலோக கார்பனைல்களில் ஈனிகளிலிருந்து உலோக அயனிக்கு சிக்மா பிணைப்பு வழியாகவும் மற்றும் உலோகத்திலிருந்து ஈனிக்கு π பின் பிணைப்பு வழியாகவும் எலக்ட்ரான் அடர்த்தியின் நகர்வு ஏற்படுகிறது.
• உலோக கார்பனைல்களில் வலுவானM ← COபிணைப்பு காணப்படுவதற்கு மேற்கண்ட கூட்டு விளைவே காரணமாகிறது.
• இந்நிகழ்வு, பின்வரும் வரைபடத்தில் தரப்பட்டுள்ளது.
27. காப்பர் சல்பேட்டின் நீர்க்கரைசலுடன், திரவ அம்மோனியாவைச் சேர்ப்பதால் உருவாகும் அணைவு அயனி யாது?
காப்பர் சல்பேட்டின் நீர்க்கரைசலுடன், திரவ அம்மோனியாவைச் சேர்ப்பதால் உருவாகும் அணைவுச் சேர்மம் டெட்ரா அம்மீன் காப்பர் (II) சல்பேட் ஆகும்.
CuSO4 + 4NH3 → [Cu(NH3)4]SO4. இதிலுள்ள அணைவு அயனி [Cu(NH3)4]2+ஆகும்.
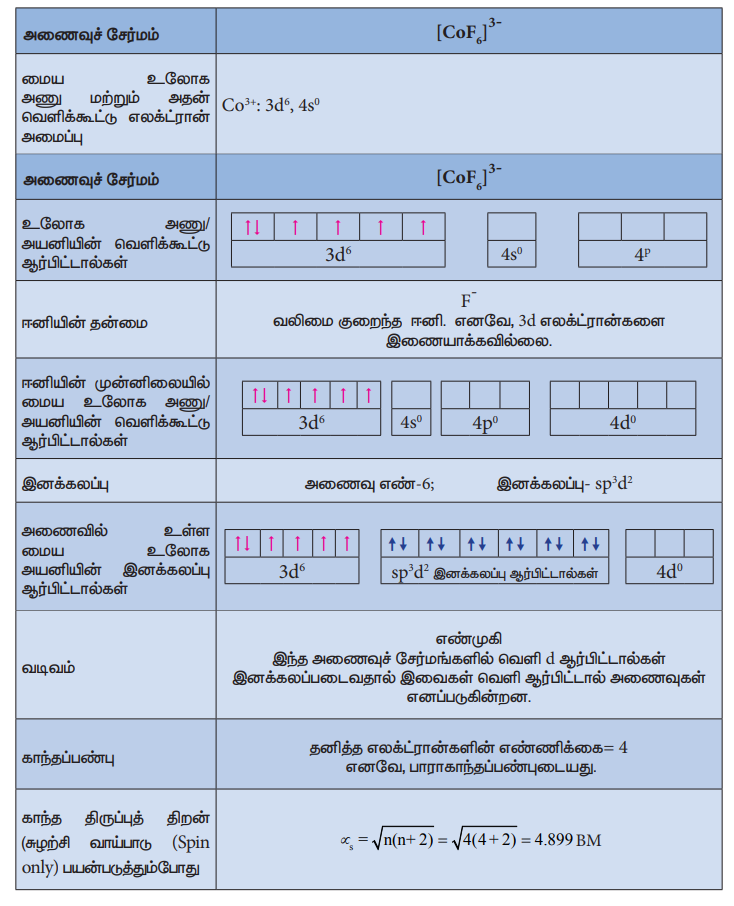
28. [Co(C2O4)3]3-ல் காணப்படும் பிணைப்பின் தன்மையை VB கொள்கையைப் பயன்படுத்தி விளக்குக.
29. VB கொள்கையின் வரம்புகள் யாவை?
VB கொள்கையின் வரம்புகள்
• அணைவுச் சேர்மங்களின் நிறங்களை விளக்க வில்லை .
• இது சுழற்சியினால் ஏற்படும் காந்தத் திருப்புத் திறனை மட்டுமே கருத்திற்க்கொண்டது. காந்தத் திருப்புத் திறனின் பிற கூறுகளை கருத்திற் கொள்ளவில்லை.
• ஒரே உலோகத்தின் அணைவுச் சேர்மங்களில் சில, உள் ஆர்ப்பிட்டால் அணைவுகளாகவும் மற்ற சில சேர்மங்கள் வெளி ஆர்பிட்டால் அணைவ,களாகவும் காணப்படுவதற்கான விளக்கத்தினை இக்கொள்கை தரவில்லை.
30. K4[Mn(CN)6] அணைவின், மைய உலோக அயனியின் ஆக்சிஜனேற்ற நிலை, அணைவு எண், ஈனியின் தன்மை, காந்தப்பண்பு மற்றும் எண்முகி படிக புலத்தில் எலக்ட்ரான் அமைப்பு ஆகியனவற்றைத் தருக.

(i) ஆக்ஸிஜனேற்ற நிலை - +2 (Mn2+)
(ii) அணைவு எண் - 6
(iii)ஈனியின் தன்மை – வலிமையானது (CN-)
(iv) காந்தப் பண்பு - பாரா காந்தத் தன்மை
(v) எண்முகி படிக புலத்தில் எலக்ட்ரான் அமைப்பு – t52gf e0g