பண்புகள், வரம்புகள் | வேதியியல் - அணைவுச் சேர்மங்களுக்கான வெர்னரின் கொள்கை | 12th Chemistry : UNIT 5 : Coordination Chemistry
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 5 : அணைவு வேதியியல்
அணைவுச் சேர்மங்களுக்கான வெர்னரின் கொள்கை
அணைவுச் சேர்மங்களுக்கான வெர்னரின் கொள்கை
அணைவுச் சேர்மங்களின் பண்புகளை விளக்கும் பொருட்டு அவைகள் பற்றிய கொள்கையினை முதலில் முன்மொழிந்தவர் சுவீடன் நாட்டைச் சார்ந்த ஆல்ஃபிரட் வெர்னர் ஆவார்.
கோபால்ட் (III) குளோரைடானது அம்மோனியாவுடன் இணைந்து உருவாக்கும் வெவ்வேறு நிறங்களையும் பண்புகளையும் உடைய பின்வரும் அணைவுச் சேர்மங்களை நாம் கருத்திற் கொள்வோம்.
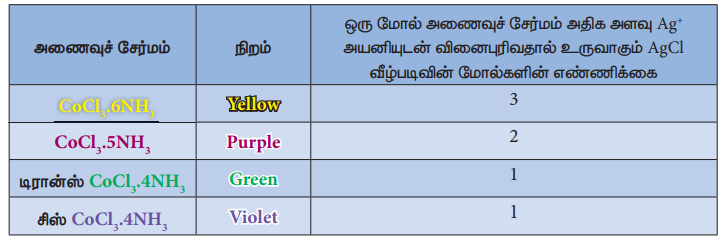
இந்நேர்வில், வினைபுரியும் கோபால்ட்(III) குளோரைடு மற்றும் அம்மோனியா ஆகிய இருமூலக்கூறுகளிலும் உள்ள தனிமங்களின் இணைதிறன்கள் முழுவதும் நிறைவு செய்யப்பட்டுள்ளன. இந்நிலையிலும், அவைகள் தங்களுக்குள் வினைபுரிந்து மேற்கண்டுள்ள அணைவுச் சேர்மங்களை உருவாக்கும் தன்மையைப் பெற்றுள்ளன.
மேற்கண்டுள்ளன போன்ற பண்புகளை விளக்குவதற்கு வெர்னர் முன்மொழிந்த கொள்கை பின்வருமாறு:
1. பெரும்பாலான தனிமங்கள், முதன்மை இணைதிறன் மற்றும் இரண்டாம் நிலை இணைதிறன் ஆகிய இரு இணைதிற மதிப்புகளைப் பெற்றுள்ளன. ஒவ்வொரு தனிமமும் இவ்விரு இணை திறன்களை நிறைவு செய்ய முற்படுகின்றன.
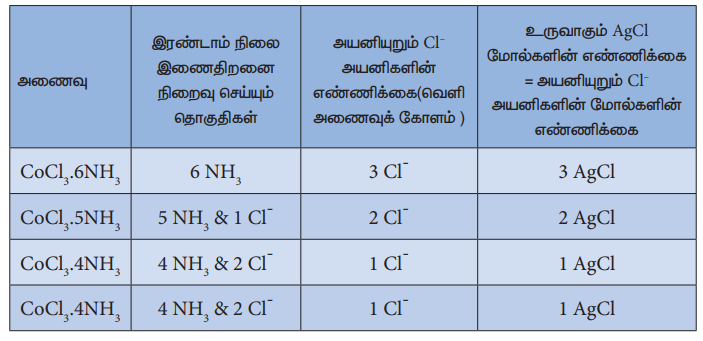
தற்போது முதன்மை இணை திறனானது உலோக அயனியின் ஆக்சிஜனேற்ற எண் எனவும், இரண்டாம் நிலை உள் இணைதிறன், அணைவு எண் எனவும் அழைக்கப்படுகின்றன. எடுத்துக்காட்டாக, வெர்னரின் கூற்றுப்படி கோபால்டின் முதன்மை மற்றும் இரண்டாம் நிலை இணைதிற மதிப்புகள் முறையே 3 மற்றும் 6 ஆகும்.
2. பெரும்பாலான நேர்வுகளில், முதன்மை இணைதிற மதிப்பானது நேர்குறியுடையது மேலும் சில நேர்வுகளில் பூஜ்யமதிப்புடையது. இவைகள் எப்போதும் எதிர் மின்சுமையுடைய அயனிகளால் நிறைவு செய்யப்படுகின்றன. எடுத்துக்காட்டாக, CoC13 6NH3ல் Coன் முதன்மை இணைதிறன் +3 மேலும் இது 3 C1- அயனிகளால் நிறைவு செய்யப்படுகிறது.
3. இரண்டாம் நிலை இணை திறனானது எதிர் அயனிகள், நடுநிலை மூலக்கூறுகள், நேர் அயனிகள் போன்றனவற்றால் நிறைவு செய்யப்படுகிறது. எடுத்துக்காட்டாக, CoC136NH3ல் கோபால்டின் இரண்டாம் நிலை இணைதிறன் 6 இது ஆறு நடுநிலை அம்மோனியா மூலக்கூறுகளால் நிறைவு செய்யப்படுகிறது. மாறாக, CoC13 5NH3 ல் கோபால்டின் இரண்டாம் நிலை இணை திறனானது ஐந்து நடுநிலை அம்மோனியா மூலக்கூறுகள் மற்றும் ஒரு C1- அயனியால் நிறைவு செய்யப்படுகிறது.
4. வெர்னரின் கூற்றுப்படி, ஒரு அணைவுச் சேர்மத்தில் மைய உலோக அயனியைச் சுற்றி இரு விதமான ஈர்ப்பு தன்மை உடைய கோளங்கள் காணப்படுகின்றன. உட்புறமுள்ள கோளமானது அணைவுக்கோளம் என அழைக்கப்படுகிறது. மேலும் இக்கோளத்தில் இடம் பெற்றுள்ள தொகுதிகள் உலோகத்துடன் வலிமையாகப் பிணைக்கப்பட்டுள்ளன. வெளியே அமைந்துள்ள கோளம், அயனியாகும் கோளம் எனப்படுகிறது. இக்கோளத்தில் இடம் பெற்றுள்ள தொகுதிகள், மைய உலோக அயனியுடன் வலுவற்ற நிலையில் பிணைக்கப்பட்டுள்ளன. எனவே, அணைவுச் சேர்மத்தினைத் தகுந்த கரைப்பானில் கரைக்கும் போது இத்தொகுதிகள் அயனிகளாகப் பிரிகையுறுகின்றன.
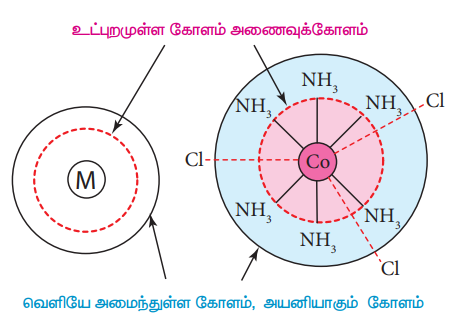
படம் 5.1 அணைவுச் சேர்மங்களில் காணப்படும் மற்றும் வெளி ஈர்ப்புக்கோளங்கள்
5. முதன்மை இணை திறனுக்கு திசைப் பண்பு இல்லை. ஆனால் இரண்டாம் நிலை இணை திறன் திசைப் பண்பினைப் பெற்றுள்ளது. இரண்டாம் நிலை இணை திறனை நிறைவு செய்யும் தொகுதிகள் முப்பரிமாண வெளியில் ஒரு குறித்த திசையில் அமைவதன் மூலம் அணைவுச் சேர்மங்கள் குறிப்பிட்ட வடிவமைப்பினைப் பெறுகின்றன. எடுத்துக்காட்டாக, ஒரு உலோக அயனியின் இரண்டாம் நிலை இணைதிறன் ஆறு எனில் அந்த அணைவு எண்முகி வடிவத்தினையும், இரண்டாம் நிலை இணைதிறன் 4 எனில் அணைவானது நான்முகி அல்லது தள சதுர வடிவமைப்பினையோ பெற்றிருக்கும்.
வெர்னர் கொள்கையின் வரம்புகள்
அணைவுச் சேர்மங்களின் சில பண்புகளை வெர்னர் கொள்கை விளக்கினாலும், அவைகளின் நிறம் மற்றும் காந்தப் பண்புகளை இக்கொள்கையால் விளக்க இயலவில்லை.
தன்மதிப்பீடு 1:
CrCl3-4H2O எனும் வாய்பாட்டினை உடைய அணைவுச் சேர்மத்தின் நீர்க்கரைசலை சில்வர் நைட்ரேட் கரைசலுடன் சேர்க்கும் போது ஒரு மோல் சில்வர் குளோரைடு வீழ்படிவாகிறது. இம் மூலக்கூறில் தனித்த நிலையில் கரைப்பான் மூலக்கூறுகள் ஏதுமில்லை. அச்சேர்மத்தின் அமைப்பு வாய்ப்பாட்டினை எழுதுக. மேலும் உலோகத்தின் இரண்டாம் நிலை ஆக்சிஜனேற்ற எண்ணைக் கண்டறிக.