அணைவு வேதியியல் | வேதியியல் - உலோக அணைவுச் சேர்மங்களின் நிலைப்புத் தன்மை | 12th Chemistry : UNIT 5 : Coordination Chemistry
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 5 : அணைவு வேதியியல்
உலோக அணைவுச் சேர்மங்களின் நிலைப்புத் தன்மை
உலோக அணைவுச் சேர்மங்களின் நிலைப்புத் தன்மை
அணைவுச் சேர்மங்களின் நிலைப்புத் தன்மையினை, இருவேறு வழிகளில் விளக்கலாம். ஒன்று, வெப்ப இயக்கவியல் நிலைப்புத் தன்மை மற்றொன்று வேதிவினைவேகவியல் நிலைப்புத் தன்மை. வெப்ப இயக்கவியல் நிலைப்புத் தன்மை என்பது, அணைவுச் சேர்மம் உருவாதலின் நிகர கட்டிலா ஆற்றல் மாற்றத்தை (∆G) குறிப்பிடுகிறது. வேதி வினைவேகவியல் நிலைப்புத் தன்மை என்பது, ஈனிகளின் பதிலீட்டினைக் குறிப்பிடுகிறது. சில நேர்வுகளில் அணைவுச் சேர்மங்களில் காணப்படும் ஈனிகள், விரைவாக பதிலீடு அடைகின்றன. அத்தகைய அணைவுச் சேர்மங்கள் நிலையற்ற அணைவுச் சேர்மங்கள் என அழைக்கப்படுகின்றன. சில அணைவுச் சேர்மங்களில், ஈனிகள் பதிலீடு அடைதல் மிக மெதுவாக நிகழ்கிறது (சில நேர்வுகளில் எவ்வித பதிலீடும் நடைபெறுவதில்லை ) இத்தகைய அணைவுச் சேர்மங்கள் மந்த அணைவுச் சேர்மங்கள் என அழைக்கப்படுகின்றன.
நிலைப்புத் தன்மை மாறிலி (β) :
ஒரு அணைவுச் சேர்மத்தில் காணப்படும் ஒரு ஈனியை, மற்றொரு ஈனி பதிலீடு செய்வதற்கு உள்ள தடையே அந்த அணைவுச் சேர்மத்தினுடைய நிலைப்புத் தன்மையின் அளவீடாகும். அணைவின் நிலைப்புத் தன்மையானது சமநிலையில் காணப்படும் இரு கூறுகளின் இணைவு வீதத்தினை குறிப்பிடுகிறது. பின்வரும் அணைவு உருவாகும் வினையைக் கருதுவோம்.
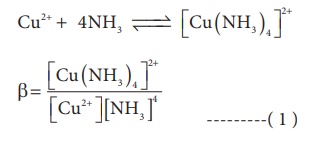
[Cu(NH3)4]2+ன் செறிவு அதிகரிக்கும் போது, நிலைப்புத் தன்மை மாறிலியின் மதிப்பும் அதிகரிக்கிறது. எனவே, நிலைப்புத் தன்மை மாறிலியின் மதிப்பு அதிகமெனில் அணைவின் நிலைப்புத் தன்மையும் அதிகம். பொதுவாக, அணைவுச் சேர்மங்கள் அவைகளின் கரைசலில், நிலைப்புத் தன்மையைப் பெற்றுள்ளன. எனினும், அணைவு அயனியானது மிகச் சிறியளவில் பிரிகையுறுகிறது. பிரிகைவீதமானது, உலோக ← ஈனி (M ← L) பிணைப்பின் வலிமையினைப் பொருத்து அமைகிறது. அதாவது, M ← L பிணைப்பு வலிமையாக இருப்பின், பிரிகையுறும் வீதம் குறைவு.
நீர்க்கரைசலில், அணைவு அயனிகள் பிரிகையுறும் போது, பிரிகையுற்ற அயனிகளுக்கும், பிரிகையுறாத அணைவிற்கும் இடையே ஒரு சமநிலை காணப்படுகிறது. எனவே, பிரிகை சமநிலை மாறிலி அல்லது நிலைப்புத்தன்மையற்ற மாறிலியின் (α) மூலமாகவும் உலோக அணைவின் நிலைப்புத் தன்மையைக் குறிப்பிடலாம்.
நீர்க்கரைசலில் [Cu(NH3)4]2+ ன் பிரிகையுறுதலை பின்வருமாறு குறிப்பிடலாம்
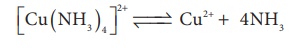
பிரிகை சமநிலை மாறிலி அல்லது நிலைப்புத் தன்மையற்ற மாறிலியினை பின்வருமாறு எழுதலாம்.
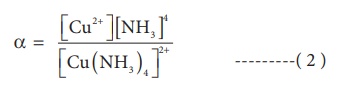
(1) மற்றும் (2) ஆகியனவற்றிலிருந்து பிரிகை சமநிலை மாறிலியின் தலைகீழ் மதிப்பானது (α), உருவாதல் சமநிலை மாறிலி அல்லது நிலைப்புத் தன்மை மாறிலிக்கு சமம் என அறிய முடிகிறது. (β)
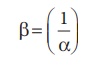
சமநிலை மாறிலிகளின் முக்கியத்துவம் :
அணைவுச் சேர்மங்களின் நிலைப்புத் தன்மையினை, நிலைப்புத் தன்மை மாறிலியி (β) மூலம் அறிந்துக் கொள்ளலாம். நிலைப்புத் தன்மை மாறிலியின் மதிப்பு அதிகமெனில், அணைவு அயனியின் நிலைப்புத் தன்மையும் அதிகம். சில முக்கிய அணைவுச் சேர்மங்களுக்கான நிலைப்புத் தன்மை மாறிலிகளின் மதிப்புகள் பின்வரும் அட்டவணையில் தரப்பட்டுள்ளன.
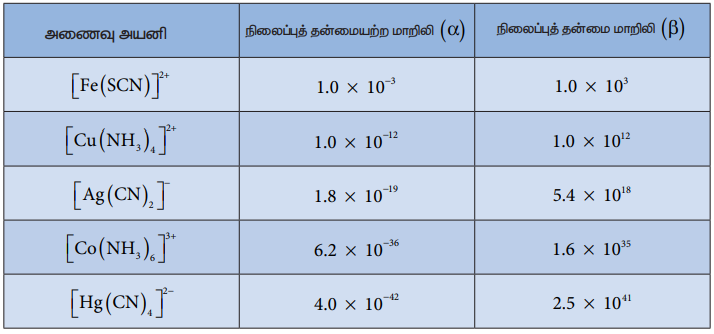
மேற்கண்டுள்ள அட்டவணையில் கொடுக்கப்பட்டுள்ள நிலைப்புத் தன்மை மாறிலிகளின் மதிப்புகளை ஒப்பிடும் போது, கொடுக்கப்பட்டுள்ள ஐந்து அணைவுச் சேர்மங்களுள் [Hg(CN)4]2- ஆனது அதிக நிலைப்புத் தன்மையினைப் பெற்றுள்ளது எனவும், [Fe(CN)]2-"ஆனது குறைவான நிலைப்புத் தன்மையினைப் பெற்றுள்ளது எனவும் அறிய முடிகிறது.
1. படிநிலை வாரியாக உருவாதல் மாறிலிகள் மற்றும் ஒட்டுமொத்த உருவாதல் மாறிலி:
நீர்ம ஊடகத்தில், ஒரு தனித்த உலோக அயனியானது, நீர் மூலக்கூறுகளால் சூழப்பட்டிருக்கும்(நீர் மூலக்கூறுகள் ஈனிகளாக அமைந்திருக்கும்). இதனை [MS6] என குறிப்பிடலாம். நீரைவிட வலிமையான ஈனியினை கரைசலில் சேர்க்கும் போது, உலோக அயனியுடன் பிணைப்பில் ஈடுபட்டிருக்கும் நீர் மூலக்கூறுகள் வலிமையான ஈனிகளால் பதிலீடு செய்யப்படுகின்றன.
நீர்ம ஊடகத்தில், ML6 என்ற அணைவுச் சேர்மம் உருவாவதை கருதுவோம்(உலோக அயனியின் மின் சுமையைப் புறக்கணிக்க). அணைவுச் சேர்மம் உருவாதல் ஒரே படிநிலையிலேயோ அல்லது தொடர்ச்சியாக ஒவ்வொரு படிநிலைகளிலோ நிகழலாம். ஈனிகள் மைய உலோக அயனியுடன்
சேர்வது ஒரே படிநிலையில் நிகழ்ந்தால், பின்
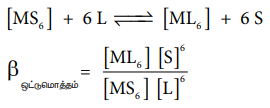
βஒட்டுமொத்தம் என்பது ஒட்டுமொத்த நிலைப்புத் தன்மை மாறிலி என அழைக்கப்படுகிறது. கரைப்பான், அதிக அளவில் காணப்படுவதால், அதன் செறிவினை மேற்கண்டுள்ள சமன்பாட்டில் புறக்கணிக்கலாம்.
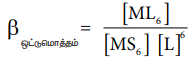
βஒட்டுமொத்தம் = [ML6] / [MS6] [L]6
இந்த ஆறு ஈனிகளும் மைய உலோக அயனியுடன் ஒவ்வொன்றாக சேர்க்கப்பட்டால் [ML6] அணைவு உருவாதல் கீழ்க்கண்டவாறு வெவ்வெறு படி நிலைகளில் நிகழும். பொதுவாக படிநிலை வாரியாக நிலைப்புத்தன்மை மாறிலி K என்ற குறியீட்டால் குறிப்பிடப்படுகிறது
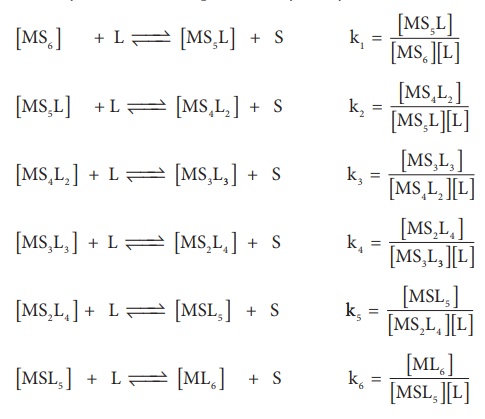
மேற்கண்டுள்ள சமநிலைகளில், k1, k2, k3, k4, k5, and k6, ஆகியன படிநிலை வாரியாக நிலைப்புத் தன்மை மாறிலிகளாகும். ஒரு சிறிய கணித செயல்பாட்டினை மேற்கொள்வதன் மூலம், ஒட்டுமொத்த நிலைப்புத் தன்மை மாறிலி β ஆனது படிநிலை வாரியான நிலைப்புத் தன்மை மாறிலிகளின் k1, k2, k3, k4, k5, and k6, பெருக்கல் பலனிற்குச் சமம் என நிறுவலாம்.
β = k1× k2× k3 × k4 ×k5 × k6
இருபுறமும் மடக்கை எடுக்க,
log (β) = log (k1)+ log (k2)+ log(k3)+ log (k4)+ log(k5) + log (k6)
2. அணைவுச் சேர்மங்களின் முக்கியத்துவம் மற்றும் பயன்கள்
அணைவுச் சேர்மங்கள் தாவரங்கள், விலங்குகள் மற்றும் கனிமங்களில் காணப்படும் முக்கியத்துவம் வாய்ந்த சேர்மங்களாகும். சில பயன்கள் பின்வருமாறு:
1. தாலோ நீலம் - இது தாமிர (II) அயனியின் ஒரு ஆழ்ந்த நீல நிற அணைவு நிறமி பொருளாகும். இச்சேர்மம் அச்சுமை தயாரிப்பில் பயன்படுகிறது.
2. நிக்கலைத் தூய்மைப்படுத்த உதவும் மாண்ட் முறையில் [Ni(CO)4) அணைவு உருவாகிறது. இதனை சிதைவடையச் செய்து, 99.5% தூய நிக்கல் தயாரிக்கப்படுகிறது.
3. EDTA என்பது ஒரு கொடுக்கிணைப்பு ஈனி. இது லாந்தனைடுகளை பிரித்தெடுத்தல், கடினநீரை மென்நீராக்கல் போன்றவற்றில் பயன்படுகிறது. மேலும், காரீய நச்சினை நீக்குவதற்கும் பயன்படுகிறது.
4. வெள்ளி மற்றும் தங்கம் ஆகியனவற்றை அவைகளின் தாதுக்களிலிருந்து பிரித்தெடுக்கும் போது, அவைகளின் கரையக்கூடிய சயனிடோ அணைவுச் சேர்மங்களாக மாற்றப்பட்டு, பின் சயனிடோ அணைவுச் சேர்மங்கள் துத்தநாகத்தால் ஒடுக்கப்பட்டு உலோகம் பெறப்படுகிறது. இம்முறை மாக் - ஆர்தர் சயனைடு முறை எனப்படுகிறது.
5. சில உலோக அயனிகளை அணைவுச் சேர்மமாக்குவதன் மூலம் துல்லியமாக அளந்தறியலாம். எடுத்துக்காட்டாக, நிக்கல் குளோரைடில் காணப்படும் Ni2+ அயனியானது, ஆல்கஹாலில் கரைக்கப்பட்ட டைமீத்தைல் கிளையாக்ஸைம் உடன் வினைபடுத்தப்பட்டு [Ni(DMG)2] என்ற கரையாத அணைவுச் சேர்மமாக மாற்றப்பட்டு துல்லியமாக அளந்தறியப்படுகிறது.
6. பெரும்பாலான அணைவுச் சேர்மங்கள் கரிம மற்றும் கனிம வினைகளில் வினைவேக மாற்றிகளாகப் பயன்படுகின்றன.
எடுத்துக்காட்டாக,
(i) [Rh(PPh3)3 C1] வில்கின்சன் வினைவேக மாற்றியானது ஆல்கீன்களின் ஹைட்ரஜனேற்ற வினைகளில் பயன்படுகிறது.
(ii) [TiC14] + A1(C2H5)3 -சிக்லர் - நட்டா வினைவேகமாற்றியானது ஈத்தீனின் பலபடியாக்கல் வினையில் பயன்படுகிறது.
7. மின்முலாம் பூசுதலில், முலாம் பூசப்பட வேண்டிய உலோகங்களின் மேற்பரப்பில் (Ag, Au, Pt etc.,) போன்ற உயர் உலோகங்களின் நுண்ணிய சீரான உலோகப் படிவினை ஏற்படுத்த [Ag(CN)2] மற்றும் [Au(CN)2] ஆகிய அணைவுச் சேர்மங்கள் பயன்படுகின்றன.
8. பல்வேறு நோய்களை குணப்படுத்த அணைவுச் சேர்மங்கள் மருந்துப்பொருளாக பயன்படுகின்றன. எடுத்துக்காட்டாக,
(1) Ca-EDTA அணைவானது, காரீயம் மற்றும் கதிர்வீச்சு நச்சினை உடலிலிருந்து நீக்கி குணப்படுத்த பயன்படுகிறது.
(2) சிஸ்-பிளாட்டின் ஆனது புற்றுநோய் கட்டிகளுக்கு எதிரான மருந்துப் பொருளாக பயன்படுகிறது.
9. புகைப்படத் தொழிலில், புகைப்படச்சுருள் மேம்படுத்தப்படும் போது சோடியம் தயோசல்பேட் கரைசலால் கழுவப்படுகிறது. எதிர் பிம்பம் நிலைநிறுத்தப்படுகிறது. சிதைவடையாத AgBr ஆனது சோடியம் டைதயோசல்பேட்டோ அர்ஜென்டேட் (I) என்ற கரையக்கூடிய அணைவுச் சேர்மத்தினை உருவாக்குகிறது. புகைப்படச்சுருளை நீரைக் கொண்டு கழுவுவதன் மூலம் இதனை பிரிக்கலாம்.
AgBr + 2 Na2S2O3 → Na3 [Ag(S2O3)2) + 2 NaBr
10. பல்வேறு உயிரியல் அமைப்புகள் உலோக அணைவுகளைக் கொண்டுள்ளன. எடுத்துக்காட்டு
(i) இரத்த சிகப்பணு (RBC) ஆனது ஹீம் தொகுதியைக் கொண்டுள்ளது. இது Fe2+ பார்பைரின் அணைவாகும். இச்சேர்மம் நுரையீரலில் இருந்து ஆக்சிஜனை திசுக்களுக்கும், அங்கிருந்து கார்பன்டைஆக்ஸைடை நுரையீரலுக்கும் பரிமாற்றம் செய்கிறது.
(ii) தாவரங்கள் மற்றும் பாசிகளில் காணப்படும் பச்சை நிற நிறமிப் பொருளான குளோரோபில் ஆனது Mg2+ ஐக் கொண்டுள்ள ஒரு அணைவுச் சேர்மமாகும். இதில், மாற்றமடைந்த பார்பைரின் ஈனி காணப்படுகிது. இது காரின் வளையம் எனப்படுகிறது. CO2 மற்றும் நீரில் இருந்து கார்போஹைட்ரேட் மற்றும் ஆக்சிஜன் உருவாகும் தாவரங்களின் ஒளிச் சேர்க்கை வினையில் இச்சேர்மம் முக்கியப் பங்காற்றுகிறது.
(iii) வைட்டமின் B12 (சயனோ கோபாலமீன்) உலோகத்தினைக் கொண்டுள்ள ஒரே வைட்டமினாகும். இதன் மையத்தில் Co+ அயனியும் அதனைச் சூழ்ந்த பார்பைரினைப்போன்றதொரு ஈனியும் காணப்படுகிறது.
(iv) உயிரியல் செயல்பாடுகளைநெறிபடுத்தும் செயல்முறைகளில் பல்வேறுநொதிகள்(என்னசம்கள்) பயன்படுகின்றன. இவைகளில் பெரும்பாலானவை உலோக அணைவுச் சேர்மங்களாகும். எடுத்துக்காட்டாக, கார்பாக்ஸிபெப்டிடேஸ் என்ற புரோட்டியேஸ் நொதியானது செரித்தலில் முக்கியப் பங்காற்றுகிறது. இந்நொதியில் துத்தநாகத்துடன் புரோட்டின் ஈனி ஈதல் சகப்பிணைப்பில் ஈடுபட்டுள்ளது.
தங்களுக்குத் தெரியுமா?
சிஸ்-பிளாட்டின்
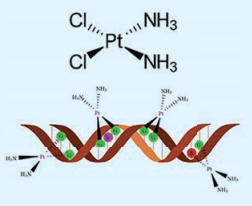
சிஸ் பிளாட்டின் ஒரு தளசதுர அணைவுச் சேர்மமாகும். (cis- [Pt (NH3)2C12]) இதில் இரு ஒத்தத் தொகுதிகள் ஒரே பக்கத்தில் இடம் பெற்றுள்ளன. இது பிளாட்டினத்தை அடிப்படையாகக் கொண்ட ஒரு எதிர் புற்றுநோய் மருந்தாகும். இம்மருந்தானது, நீராற்பகுத்தல் அடைந்து DNA உடன் வினைபட்டு பல குறுக்கு இணைப்புகளை ஏற்படுத்துகின்றன. இதன் காரணமான, DNA இரட்டிப்பதால் மற்றும் நகலெடுத்தல் தடுக்கப்படுகிறது. இதன் விளைவாக செல் வளர்ச்சி தடுக்கப்பட்டு இறுதியில் அழிக்கப்படுகிறது. செல்லுலர் புரோட்டீன்களுடன் குறுக்கு இணைப்பினை ஏற்படுத்துவதன் மூலம் செல்பிரிதலையும் (மைட்டாசிஸ்) தடுக்கிறது.