உடனிசைவு அமைப்பு, தயாரிக்கும் முறைகள், இயற்பண்புகள் மற்றும் வேதி வினைகள் - டையசோனியம் உப்புகள் | 12th Chemistry : UNIT 13 : Organic Nitrogen Compounds
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 13 : கரிம நைட்ரஜன் சேர்மங்கள்
டையசோனியம் உப்புகள்
டையசோனியம் உப்புகள்
அறிமுகம்
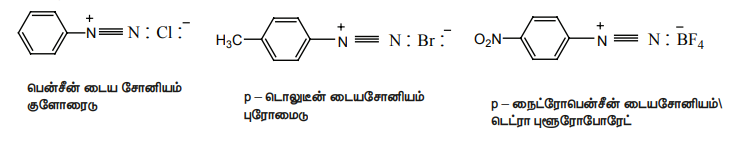
அரோமேட்டிக் அமீன்களை (NaNO2+HCl) கலவையுடன் வினைப்படுத்தும் போது டைய சோனியம் உப்புகள் உருவாகின்றன என நாம் கற்றறிந்துள்ளோம். இவைகள் குறைவான நேரத்திற்கு மட்டுமே நிலைப்புத்தன்மை உடையதாக இருக்கின்றன. எனவே தயாரித்த உடனேயே பயன்படுத்தப்படுகின்றன.
எடுத்துக்காட்டு
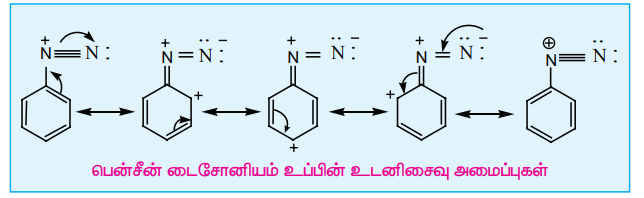
உடனிசைவு அமைப்பு
அரீன் டையசோனியம் அயனியின் மீதான நேர்மின்சுமை பென்சீன் வளையம் முழுமைக்கும் விரவும் தன்மையை பெற்றிருப்பதால் அரீன்டையசோனியம் உப்புகள் நிலைப்புத் தன்மையைப் பெறுகின்றன.
டையசோனியம் உப்புகளை தயாரிக்கும் முறைகள்
அனிலீன் பென்சின் டைய சோனியம் குளோரைடைத் தரும் என்பதை நைட்ரஸ் அமிலத்துடன் (NaNO2+ HCl கலவை 273Kல்) வினைபுரிந்து நாம் ஏற்கனவே கற்றறிந்துள்ளோம்.
இயற்பண்புகள்
• பென்சீன் டையசோனியம் குளோரைடு, நிறமற்ற படிக திண்மம்
• நீரில் நன்கு கரைகின்றன மேலும் குளிர்ந்த நீரில் நிலைப்புத்தன்மை உடையது எனினும் மித வெப்ப நீரில் வினைபுரிகிறது.
• இவைகளின் நீர்த்த கரைசல்கள் லிட்மஸ் உடன் நடுநிலைத் தன்மையை காட்டுகிறது. மேலும் அயனிகளாக காணப்படுவதால் மின்கடத்தும் தன்மையைப் பெற்றுள்ளது.
• பென்சீன்டைய சோனியம் டெட்ராபுளுரோ போரேட் நீரில் கரைகிறது. மேலும் அறைவெப்பநிலையில் நிலைப்புத் தன்மை உடையது.
வேதி வினைகள்
பென்சீன் டைய சோனியம் குளோரைடு இருவகையான வேதி வினைகளைத் தருகிறது. A. நைட்ரஜனை இழந்து நடைபெறும் பதிலீட்டு வினைகள்: இவ்வினைகளில், டைய சோனியம் தொகுதியானது, X ,CN ,H ,OH போன்ற கருக்கவர் பொருட்களால் பதிலீடு அடைகிறது. B. டையசோ தொகுதி நீங்காதிருக்கும் வினைகள்: எ.கா இணைப்பு வினை
A. நைட்ரஜனை இழந்து நடைபெறும் பதிலீட்டு வினைகள்
1. ஹைட்ரஜனால் இடப்பெயர்ச்சி
ஹைபோபாஸ்பரஸ் அமிலம் அல்லது குப்ரஸ் அயனியின் முன்னிலையில் எத்தனால் போன்ற வலிமை குறை ஒடுக்கும் காரணிகளைக் கொண்டு பென்சீன் டையசோனியம் குளோரைடை ஒடுக்கமடையச் செய்யும் போது பென்சீன் உருவாகிறது. இவ்வினை தனிஉறுப்பு சங்கிலி வினை வழிமுறையைப் பின்பற்றி நிகழ்கிறது.
C6 H5 -+N2 Cl- +H3PO2 +H2O ----CuCl→ C6 H6 + H3 PO3 +HCl + N2 ↑
C6 H5 - +N2 Cl- + CH3 CH2OH → C6 H6 + N2 + CH3CHO + HCl
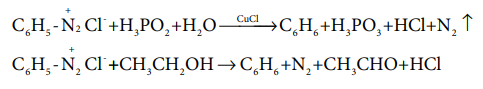
2. குளோரின், புரோமின், சயனைடு தொகுதியால் பதிலீடு
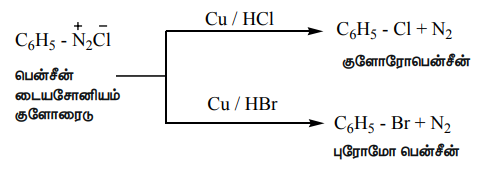
அ) சான்ட்மேயர் வினை
புதிதாகத் தயாரிக்கப்பட்ட பென்சீன்டைய சோனியம் குளோரைடு மற்றும் குப்ரஸ் ஹாலைடு கரைசல்களை ஒன்றொடொன்று சேர்க்கும் போது, அரைல் ஹாலைடுகள் உருவாகின்றன. இவ்வினை சான்ட்மேயர் வினை என்றழைக்கப்படுகிறது. பென்சீன்டைய சோனியம் குளோரைடை குப்ரஸ் சயனைடுடன் வினைபடுத்த, சயனோபென்சீன் உருவாகிறது.
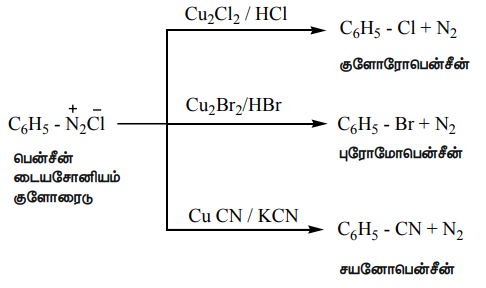
ஆ) காட்டர்மான் வினை
பென்சீன்டைய சோனியம் குளோரைடை, ஹைட்ரோ குளோரிக் ஹைட்ரோபுரோமிக் அமிலம் மற்றும் காப்பர் தூளுடன் சேர்த்து வினைபடுத்துவதன் மூலமும் குளோரோ / புரோமோ அரீன்களைப் பெறலாம்.
காட்டர்மான் வினையைக் காட்டிலும் சான்ட்மேயர் வினையில் அதிக அளவு விளைபொருள் உருவாகிறது.
3. அயோடினால் பதிலீடு
பென்சீன்டைய சோனியம் குளோரைடின் நீர்க்கரைசலை Kl உடன் கொதிக்கவைக்கும் போது அயடோபென்சீன் உருவாகிறது.
C6H5 – N2 CI- +KI → C6H5I +KCI +N2
அயடோபென்சீன்
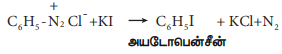
4. புளூரினால் பதிலீடு (Baltz - schiemann reaction)
பென்சீன் டையசோனியம் குளோரைடை புளுரோபோரிக் அமிலத்துடன் வினைபடுத்தும் போது, பென்சீன் டையசோனியம் டெட்ரா புளுரோ போரேட் வீழ்படிவாகிறது. இதனை வெப்பப்படுத்தும் போது சிதைவடைந்து புளுரோபென்சீனைத் தருகிறது.
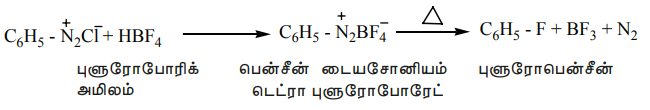
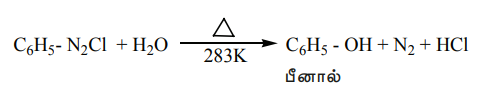
5. ஹைட்ராக்சில் தொகுதியால் பதிலீடு
அதிக அளவு கொதிக்கும் நீரில் பென்சீன்டைய சோனியம் குளோரைடு கரைசலை சேர்க்கும் போது பீனால் உருவாகிறது.
6. நைட்ரோ தொகுதியால் பதிலீடு
டைய சோனியம் புளுரோபோரேட்டை காப்பர் முன்னிலையில் நீர்த்த சோடியம் நைட்ரைட் கரைசலுடன் சேர்த்து கொதிக்க வைக்கும் போது டையசோனியம் தொகுதியானது, - NO2 தொகுதியால் பதிலீடு செய்யப்படுகிறது.
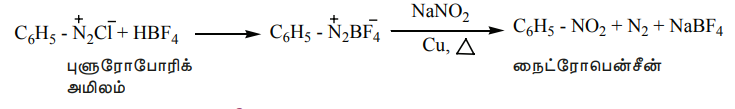
7. அரைல் தொகுதியால் பதிலீடு (காம்பெர்க் வினை)
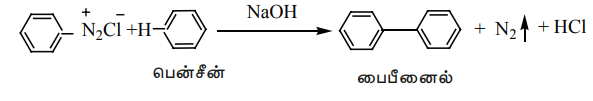
சோடியம் ஹைட்ராக்ஸைடு முன்னிலையில், பென்சீன்டைய சோனியம் குளோரைடானது பென்சீனுடன் வினைபுரிந்து பைபீனைலைத் தருகிறது. இவ்வினை காம்பெர்க் வினை எனப்படும்.
8. கார்பாக்சிலிக் தொகுதியால் பதிலீடு
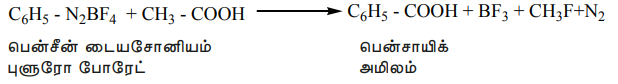
டைய சோனியம் புளுரோபோரேட்டை அசிட்டிக் அமிலத்துடன் வெப்பப்படுத்தும் போது பென்சாயிக் அமிலம் உருவாகிறது. அலிபாட்டிக் கார்பாக்சிலிக் அமிலங்களை அரோமேட்டிக் கார்பாக்சிலிக் அமிலங்களாக மாற்றுவதற்கு இவ்வினை பயன்படுகிறது.
C6H5 - N2BF4 + CH3 - COOH → C6H5 - COOH + BF3 + CH3F +N2
பென்சீன் டையசோனியம்புளுரோ போரேட் பென்சாயிக் அமிலம்
B. டையசோ தொகுதி நீங்காதிருக்கும் வினைகள்
9. SnCl2 / HCI, Zn தூள் /
CH3COOH, சோடியம் ஹைட்ரோசல்பைட், சோடியம் சல்பைட் போன்ற ஒடுக்கும் காரணிகள் பென்சீன் டைய சோனியம் குளோரைடை பீனைல் ஹைட்ரசீனாக ஒடுக்கமடையச் செய்கிறது.
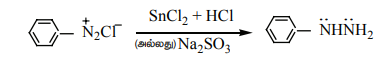
10. இணைப்பு வினைகள்
எலக்ட்ரான் அடர்வினை அதிகமாகக் கொண்டுள்ள அனிலீன், பீனால் போன்ற அரோமேட்டிக் சேர்மங்களுடன் பென்சீன்டைய சோனியம் குளோரைடுடன் வினைபுரிந்து பிரகாசமான நிறமுடைய அசோசேர்மங்களை உருவாக்குகிறது. பொதுவாக இணைப்பானது பாரா இடத்தில் நிகழ்கிறது. பாரா இடத்தில் வேறொரு தொகுதி இடம் பெற்றிருப்பின் இணைப்பு ஆர்தோ இடத்தில் நிகழும். - N2 Cl க்கு பாரா இடத்தில் எலக்ட்ரான் விடுவிக்கும் இயல்புடைய ஒரு தொகுதி இடம் பெற்றிருப்பின் இணைப்பு வினைபுரியும் தன்மை அதிகரிக்கிறது. இது ஒரு எலக்ட்ரான் கவர் பொருள் பதிலீட்டு வினை ஆகும்.
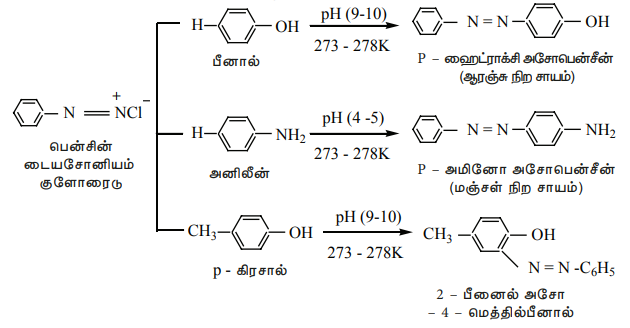
நேரடி ஹேலஜனேற்றத்தின் மூலம் அரைல் புளுரைடுகள் மற்றும் அயோடைடுகளை தயாரிக்க இயலாது. மேலும் குளோரோ பென்சீனில் குளோரினுக்கு பதிலாக சயனோ தொகுதியை பதிலீடு அடையச் செய்யவும் இயலாது. அத்தகைய ஹேலோ, சயனோ, - OH, NO2 போன்ற தொகுதிகளை உடைய சேர்மங்களை உருவாக்க பென்சீன்டைய சோனியம் குளோரைடு ஒரு மிகச்சிறந்த வினை இடைநிலைப் பொருளாகும். இணைப்பு வினையின் மூலம் பெறப்படும் டையசோ சேர்மங்கள் நிறமுடையவை. மேலும் சாயங்களாகப் பயன்படுகின்றன.