12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 13 : கரிம நைட்ரஜன் சேர்மங்கள்
இயற்ப்பண்புகள் மற்றும் அமீன்களின் வேதிப்பண்புகள்
அமீன்களின் பண்புகள்
1. இயற்நிலை மற்றும் மணம்
குறைவான கார்பன் அணுக்களைக் கொண்ட அலிபாட்டிக் அமீன்கள் (C1-C2) நிறமற்ற வாயுக்களாகும். மேலும் அம்மோனியா போன்ற மணத்தை கொண்டுள்ளது. நான்கு அல்லது அதற்கு மேற்பட்ட கார்பன் அணுக்களைக் கொண்டுள்ளவை. மீனின் மணமுடைய ஆவியாகும் நீர்மங்கள்.
அனிலீன் மற்றும் பிற அரைல் அமீன்கள் வழக்கமாக நிறமற்றவை. ஆனால் காற்றுடன் தொடர்பு ஏற்படும் போது அவைகள் ஆக்சிஜனேற்றத்தினால் நிறமுடையவையாகின்றன.
2. கொதிநிலை
ஓரிணைய மற்றும் ஈரிணைய அமீன்களின் முனைவுத் தன்மையினால் நைட்ரஜனின் தனித்த எலக்ட்ரான், இரட்டையை பயன்படுத்தி மூலக்கூறுகளுக்கிடையேயான ஹைட்ரஜன் பிணைப்பினை ஏற்படுத்துகின்றன. மூவிணைய அமீன்களில் இத்தகைய H - பிணைப்பு காணப்படுவதில்லை.
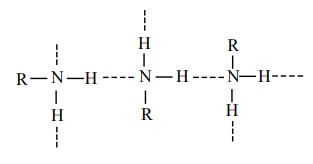
பல்வேறு அமீன்களின் கொதிநிலை வரிசை பின்வருமாறு
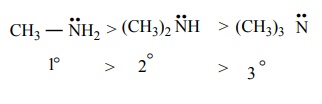
அமீன்கள், ஆல்கஹால்களைக் காட்டிலும் குறைவான கொதிநிலையுடையவை. ஏனெனில் ஆக்சிஜனைக் காட்டிலும் நைட்ரஜன் குறைவான எலக்ட்ரான் கவர் தன்மையைப் பெற்றுள்ளதால் N-H பிணைப்பானது -OH பிணைப்பைக் காட்டிலும் குறைவான முனைவுத் தன்மையுடையது.
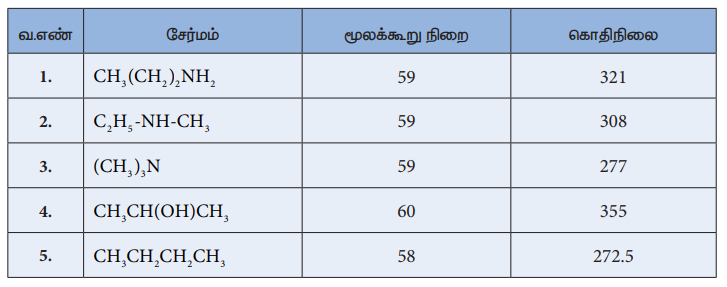
அட்டவணை : ஒப்பிடத்தக்க மூலக்கூறு எடை உடைய அமீன்கள், ஆல்கஹால்கள் மற்றும் ஆல்கேன்களின் கொதிநிலை
3) கரைதிறன்
குறைவான கார்பன் அணுக்களைக் கொண்டுள்ள அலிபாட்டிக் அமீன்கள் நீரில் கரைபவை. ஏனெனில் இவைகள் நீருடன் ஹைட்ரஜன் பிணைப்பினை ஏற்படுத்துகின்றன. எனினும், அமீன்களின் மூலக்கூறு நிறை அதிகரிக்கும் போது அவைகளின் கரைதிறன் குறைகிறது. ஏனெனில் நீர் வெறுக்கும் ஆல்கைல் தொகுதியின் உருவளவு அதிகரிக்கின்றது. அமீன்கள் நீரில் கரைவதில்லை . ஆனால் பென்சீன், ஈதர் போன்ற கரிமக்கரைப்பான்களில் எளிதில் கரைகின்றன.
வேதிப் பண்புகள்
அமீன்கள் நைட்ரஜன் அணுவின் மீது காணப்படும் தனித்த இரட்டை எலக்ட்ரான்கள் அவைகளை காரத்தன்மை உடையதாக்குகிறது. மேலும் கருக்கவர் பொருளாக செயல்படவும் காரணமாய் அமைகிறது. கனிம அமிலங்களுடன் உப்புகளைத் தருகின்றன.
எடுத்துக்காட்டு
C6H5 – NH2 + HCI ↔ C6H5 – NH3CI-
அனிலீன் அனிலீனியம்குளோரைடு
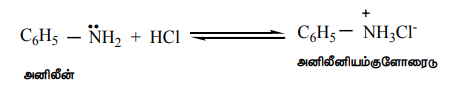
அமீன்களின் காரவலிமைக்கான கோவை
நீர்க்கரைசலில், பின்வரும் சமநிலை நிலவுகிறது. இச்சமநிலை பெரும்பாலும் இடது புறம் நோக்கி உள்ளது எனவே NaOH உடன் ஒப்பிடும் போது அமீன்கள் வலிமை குறைவான காரமாகும்.
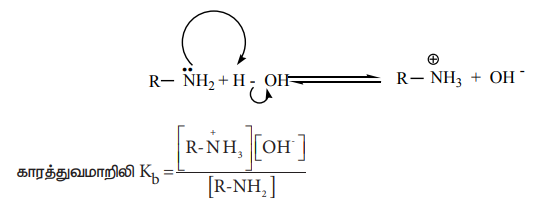
காரத்துவமாறிலி Kb = [R-NH3] [OH-] / [R-NH2 ]
அமீன்கள் நீரிலிருந்து எந்த அளவிற்கு ஹைட்ரஜன் அயனியை (H+) ஏற்கும் தன்மையை பெற்றுள்ளது என்பதனை காரத்துவமாறிலி (Kb)ன் மூலம் அறியலாம். Kb மதிப்பு அதிகம் அதாவது pKb ன் மதிப்பு குறைவு எனில், காரம் வலிமைமிக்கது என நாம் அறிவோம்.
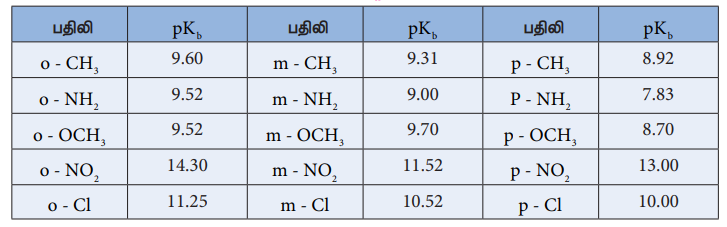
அட்டவணை : நீர்க்கரைசலில் அமீன்களின் pKb மதிப்புகள், (NH3 ன் pKb மதிப்பு 4.74).
அமீன்களின் காரத்தன்மை மீதான அவைகளின் வடிவமைப்பின் விளைவு
அமிலத்துடன் பங்கிடப்படுவதற்கு ஏதுவாக நைட்ரஜன் மீதுள்ள எலக்ட்ரான் இரட்டை அமைந்திருப்பதை அதிகரிக்கும் காரணிகள் அமீன்களின் காரத்தன்மையை அதிகரிக்கின்றன. ஆல்கைல் தொகுதி போன்ற +I தொகுதிகள் நைட்ரஜனுடன் இணைக்கப்பட்டிருப்பின் அவைகள் நைட்ரஜன் மீதான எலக்ட்ரான் அடர்த்தியினை அதிகரிக்கச் செய்கின்றன. இதன் விளைவாக எலக்ட்ரான் இரட்டையானது புரோட்டானை ஏற்பது எளிதாகிறது. எனவே, ஆல்கைல் அமீன்கள் அம்மோனியாவை விட அதிக காரத்தன்மை உடையவை.
அ) ஆல்கைல் அமீனுடன் (R-NH2) புரோட்டானின் வினையைக் கருதுவோம்.
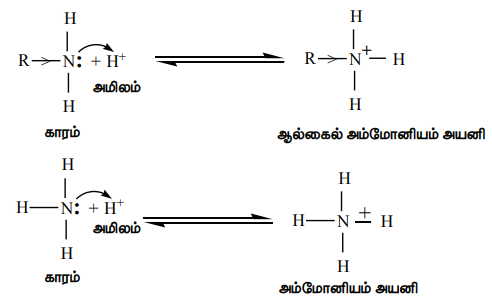
எலக்ட்ரானை விடுவிக்கும் இயல்புடைய ஆல்கைல் தொகுதி R ஆனது அமீன்களில் உள்ள நைட்ரஜனை நோக்கி (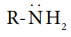 ) எலக்ட்ரான் நகர காரணமாக அமைகிறது. மேலும், புரோட்டானுடன், தனித்த எலக்ட்ரான் இரட்டை பங்கிடுவதை ஊக்குவிக்கிறது. எனவே, அலிஃபாடிக் அமீன்களின் எதிர்பார்க்கப்படும் காரத்தன்மை (வாயுநிலைமையில்) பின்வரும் வரிசையில் அமைகிறது.
) எலக்ட்ரான் நகர காரணமாக அமைகிறது. மேலும், புரோட்டானுடன், தனித்த எலக்ட்ரான் இரட்டை பங்கிடுவதை ஊக்குவிக்கிறது. எனவே, அலிஃபாடிக் அமீன்களின் எதிர்பார்க்கப்படும் காரத்தன்மை (வாயுநிலைமையில்) பின்வரும் வரிசையில் அமைகிறது.
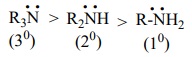
மேற்கண்டுள்ள வரிசையானது அவைகளின் நீர்க்கரைசலில் சீராக இருப்பதில்லை என்பதை அட்டவணையில் கொடுக்கப்பட்டுள்ள அவைகளின் pKb மதிப்புகளிலிருந்து அறியலாம்.
அமீன்களின் காரத்தன்மை ஒப்பிட தூண்டல் விளைவு, கரைப்பானேற்ற விளைவு கொள்ளிடத் தடை போன்ற விளைவுகளை கருத்தில் கொள்ள வேண்டும்.
கரைப்பானேற்ற விளைவு
நீர்க்கரைசலில் பதிலீடடைந்த அம்மோனியம் நேரயனிகள் ஆல்கைல் தொகுதிகளின் எலக்ட்ரான் விடுவிக்கும் (+I) விளைவு மட்டுமல்லாமல் நீர் மூலக்கூறுகளின் கரைப்பானேற்றத்தாலும் நிலைப்புத் தன்மை பெறுகின்றன. அயனியின் உருவளவு அதிகரிக்கும் போது கரைப்பானேற்றம் குறைகிறது. மேலும், நிலைப்புத்தன்மையும் குறைவு. ஈரிணைய மற்றும் மூவிணைய அமீன்களில் கொள்ளிட தடையின் காரணமாக, புரோட்டானேற்றம் அடைந்த அமீனை அணுகும் நீர் மூலக்கூறுகளின் எண்ணிக்கை குறைகிறது. எனவே காரத்தன்மையின் வரிசை பின்வருமாறு
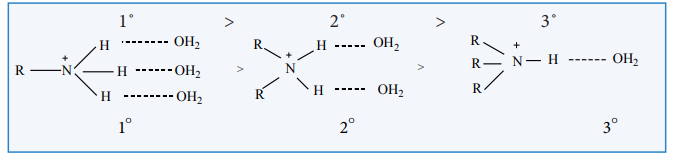
மேற்கண்டுள்ள விளைவுகளின் அடிப்படையில், நீர்க்கரைசலில் ஆல்கைல் பதிலீடு அடைந்த அமீன்களின் கார வலிமையின் வரிசை பின்வருமாறு.
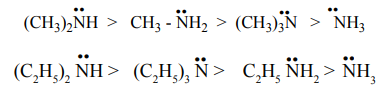
+I விளைவு, கொள்ளிடவிளைவு மற்றும் நீரேற்ற விளைவு ஆகியனவற்றின் விளைவாக 20 அமீன் ஆனது அதிக காரத்தன்மையினைப் பெறுகிறது.
அனிலீனின் கார வலிமை
அனிலீனில் NH2 தொகுதியானது பென்சீன்வளையத்துடன் நேரடியாக இணைக்கப்பட்டுள்ளது. அனிலீனின் நைட்ரஜன் அணு மீதான தனித்த இரட்டை எலக்ட்ரான் பென்சீன் வளையத்தினுள் உள்ளடங்காத் தன்மையினைப் பெற்றுள்ளது. எனவே, புரோட்டானேற்றத்திற்கு தனித்த எலக்ட்ரான் கிடைக்கக்கூடிய வாய்ப்பு குறைகிறது. இதன் விளைவாக அரோமேட்டிக் அமீன்கள் (அனிலீன்), அம்மோனியாவைக் (NH3) காட்டிலும் குறைவான காரத் தன்மையைப் பெறுகின்றது.
பதிலீடடைந்த அனிலீனில், -CH3 ,-OCH3, -NH2 போன்ற எலக்ட்ரானை விடுவிக்கும் இயல்புடைய தொகுதிகள் காரத்தின் வலிமையினை அதிகரிக்கின்றன. மேலும் எலக்ட்ரானை பெறும் இயல்புடைய தொகுதிகளான – NO2,-x,-COOH போன்றவை காரத்தின் வலிமையினைக் குறைக்கின்றது.
அட்டவணை : பதிலிடப்பட்ட அனிலீன்களின் pKb 's மதிப்புகள் (அனிலீனின் pKb மதிப்பு 9.376)
அமீன்களின் ஒப்பீட்டு காரத்துவ வரிசை பின்வருமாறு
ஆல்கைல் அமீன்கள் >அர்அல்கைல் அமீன்கள் > அம்மோனியா > N - அர்அல்கைல் அமீன்கள் > அரைல் அமீன்கள்
அமீன்களின் வேதிப்பண்புகள்
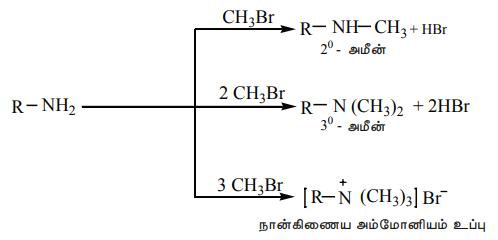
1) ஆல்கைலேற்றம்
அமீன்கள், ஆல்கைல் ஹேலைடுகளுடன் வினைபட்டு 2o மற்றும் 3o மற்றும் நான்கிணைய அம்மோனியம் உப்புக்களை தொடர்ச்சியாகத் தருகிறது.
2) அசைலேற்றம்
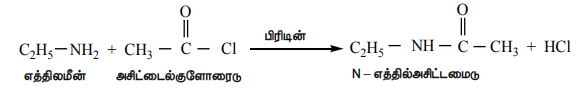
அலிபாட்டிக் / அரோமேட்டிக் ஓரிணைய மற்றும் ஈரிணைய அமீன்கள் பிரிடின் முன்னிலையில் அசிட்டைல் குளோரைடுடன் அல்லது அசிட்டிக் அமில நீரிலியுடன் வினைபட்டு N - ஆல்கைல் அசிட்டமைடைத் தருகிறது.
எடுத்துக்காட்டு
3) ஸ்காட்டன் – பௌமன்வினை
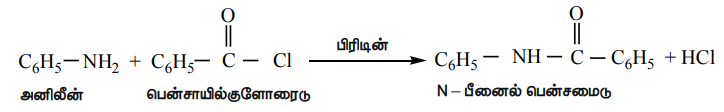
அனிலீன் ஆனது NaOH முன்னிலையில் பென்சாயில் குளோரைடுடன் வினைபட்டு N - பீனைல் பென்சமைனைத் தருகிறது. இவ்வினை ஸ்காட்டன் - பெளமன் வினை எனப்படுகிறது. அசைலேற்றம் மற்றும் பென்சாயிலேற்ற வினைகள் கருக்கவர் பொருள் பதிலீட்டு வினைகளாகும்.
4) நைட்ரஸ் அமிலத்துடன் வினை
மூன்றுவகையான அமீன்களும், வினை நிகழ் இடத்தில் NaNO2 மற்றும் அடர் HCI கலந்து உருவாக்கப்படும் நைட்ரஸ் அமிலத்துடன் வெவ்வேறு முறையில் வினைபுரிகின்றன.
அ) ஓரிணைய அமீன்கள்
i) எத்தில் அமீன் நைட்ரஸ் அமிலத்துடன் வினைபுரிந்து நிலைப்புத் தன்மையற்ற எத்தில் டைய சோனியம் குளோரைடைத்தருகிறது. மேலும் இது நைட்ரஜனை வெளியேற்றி எத்தனாலை உருவாக்குகிறது.
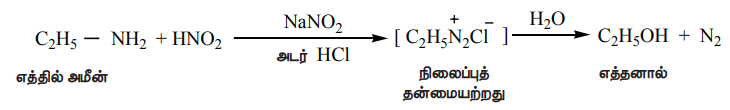
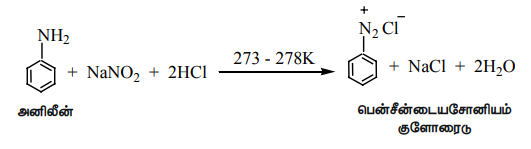
ii) அனிலீன் குறைவான வெப்பநிலையில் (273 K - 278K) நைட்ரஸ் அமிலத்துடன் வினைபட்டு பென்சீன் டையசோனியம் குளோரைடைத் தருகிறது. இது குறைவான நேரம் மட்டுமே நிலைப்புத் தன்மை உடையது. மேலும் அறை வெப்பநிலையில் கூட இது மெதுவாக சிதைவடைகிறது. இவ்வினை டையசோ ஆக்கல் வினை எனப்படுகிறது.
ஆ) ஈரிணைய அமீன்கள்
ஆல்கைல் மற்றும் அரைல் ஈரிணைய அமீன்கள் நைட்ரஸ் அமிலத்துடன் வினைபுரிந்து மஞ்சள் நிற எண்ணெய் போன்ற N - நைட்ரசோ அமீனைத் தருகிறது. இது நீரில் கரைவதில்லை .
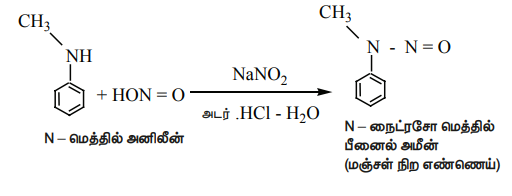
இவ்வினை லிபர்மேன் நைட்ரசோ சோதனை எனப்படுகிறது.
இ) மூவிணைய அமீன்
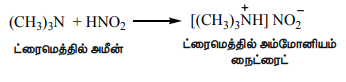
i) அலிபாட்டிக் மூவிணைய அமீன் நைட்ரஸ் அமிலத்துடன் வினைபுரிந்து நீரில் கரையக்கூடிய ட்ரை ஆல்கைல் அம்மோனியம் நைட்ரைட் உப்பினைத் தருகிறது.
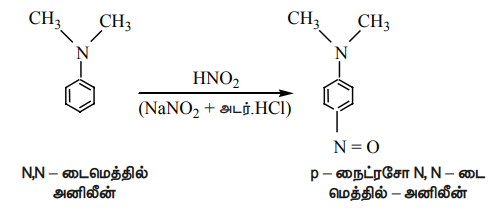
ii) அரோமேட்டிக் மூவிணைய அமீன், நைட்ரஸ் அமிலத்துடன் 273K வெப்பநிலையில் வினைபுரிந்து p - நைட்ரசோ சேர்மத்தைத் தருகிறது.
5) கார்பைலமீன் சோதனை
அலிபாட்டிக் (அல்லது) அரோமேட்டிக் ஓரிணைய அமீன்கள் குளோரோபார்ம் மற்றும் ஆல்கஹால் கலந்த KOH உடன் வினைபுரிந்து அருவெறுக்கத்தக்க மணமுடைய ஐசோசயனைடுகளைத் (கார்பைலமீன்) தருகின்றன. இவ்வினை கார்பைலமீன் சோதனை என்றழைக்கப்படுகிறது. இச்சோதனை ஓரிணைய அமீன்களை கண்டறியப் பயன்படுகிறது.
C2H5 - NH2 + CHCl3 + 3KOH → C2H5 - NC + 3KCl + 3H2O
எத்தில் அமீன் குளோரோபார்ம் எத்தில் ஐசோ சயனைடு
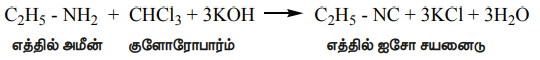
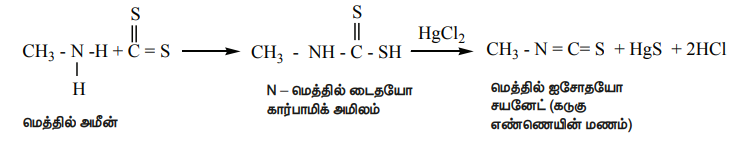
6) கடுகு எண்ணெய் வினை
i) ஓரிணைய அமீன்களை கார்பன் டைசல்பைடுடன் (CS2) வினைபடுத்தும் போது, N - ஆல்கைல்டைதயோ கார்பாமிக் அமிலம் உருவாகிறது. இதனுடன் HgCl2 சேர்த்து வினைபடுத்தும் போது ஆல்கைல்ஐசோதயோசயனேட் உருவாகிறது.
ii) அனிலீனை கார்பன்டை சல்பைடுடன் வினைபடுத்தும் போது, S-டைபீனைல் தயோயூரியா உருவாகிறது.
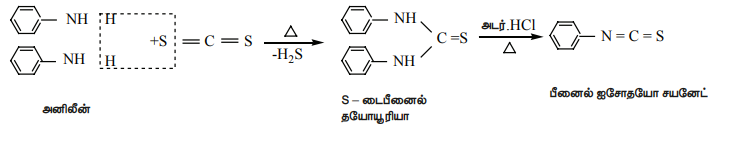
இவ்வினை ஹாஃப்மனின் கடுகு எண்ணெய் வினை அழைக்கப்படுகிறது. இவ்வினையும் ஓரிணைய அமீனிகளை கண்டறிய பயன்படுகிறது.
7. அனிலீனின் எலக்ட்ரான் கவர்பொருள் பதிலீட்டு வினை
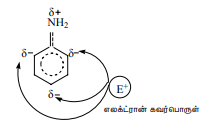
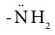 தொகுதியானது ஒரு வலிமையான கிளர்வுறுத்தும் தொகுதியாகும். அனிலீனில் NH2 தொகுதியானது பென்சீன் வளையத்துடன் நேரடியாக இணைக்கப்பட்டுள்ளது. நைட்ரஜன் மீதுள்ள தனித்த எலக்ட்ரான் இரட்டையானது பென்சீன் வளையத்துடன் உடனிசைவில் ஈடுபடுகிறது. இதன் விளைவாக ஆர்தோ மற்றும் பாரா இடங்களில் எலக்ட்ரான் அடர்வு அதிகரிக்கின்றது. எனவே எலக்ட்ரான் கவர் பொருள் ஆர்தோ மற்றும் பாரா இடங்களை தாக்க வாய்ப்பு ஏற்படுகிறது.
தொகுதியானது ஒரு வலிமையான கிளர்வுறுத்தும் தொகுதியாகும். அனிலீனில் NH2 தொகுதியானது பென்சீன் வளையத்துடன் நேரடியாக இணைக்கப்பட்டுள்ளது. நைட்ரஜன் மீதுள்ள தனித்த எலக்ட்ரான் இரட்டையானது பென்சீன் வளையத்துடன் உடனிசைவில் ஈடுபடுகிறது. இதன் விளைவாக ஆர்தோ மற்றும் பாரா இடங்களில் எலக்ட்ரான் அடர்வு அதிகரிக்கின்றது. எனவே எலக்ட்ரான் கவர் பொருள் ஆர்தோ மற்றும் பாரா இடங்களை தாக்க வாய்ப்பு ஏற்படுகிறது.
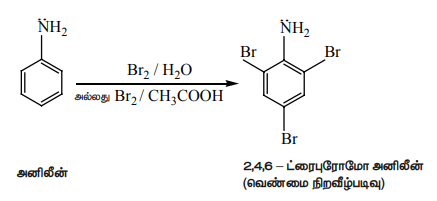
i) புரோமினேற்றம்
அனிலீன் Br2 / H2O உடன் வினைபட்டு வெண்மை நிற வீழ்படிவான 2,4,6 - ட்ரை புரோமோ அனிலீனைத் தருகிறது.
மோனோ புரோமோ பெறுதிகளைப் பெற , - NH2 தொகுதியானது அசைலேற்றம் அடையச் செய்யப்பட்டு அதன் வினைத்திறன் குறைக்கப்படுகிறது.
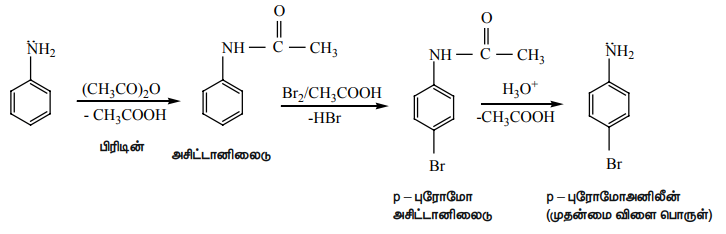
அனிலீனை அசிட்டைலேற்றம் அடையச் செய்யும் போது, நைட்ரஜனின் தனித்த இரட்டை எலக்ட்ரான் ஆனது அருகில் உள்ள கார்பனைல் தொகுதியுடன் உடனிசைவில் ஈடுபடுவதால் உள்ளடங்காத் தன்மையைப் பெறுகிறது. எனவே நைட்ரஜனின் தனித்த எலக்ட்ரான் பென்சீன் வளையத்தில் உள்ளடங்காத் தன்மையை ஏற்படுத்த வாய்ப்பு குறைகிறது.
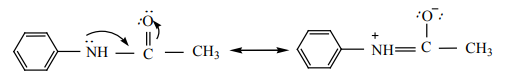
எனவே எலக்ட்ரான் கவர் பொருள் பதிலீட்டு வினைகளில் அசிட்டமினோ தொகுதியின் கிளர்வுறுத்தும் திறன் குறைவு.
i) நைட்ரோ ஏற்றம்
அனிலீனின் நேரடி நைட்ரோ ஏற்றத்தினால் o- மற்றும் p-நைட்ரோ அனிலீன் உருவாகிறது. இதனுடன் ஆக்சிஜனேற்றத்தின் காரணமாக அடர் நிற தார் (tars) உருவாகிறது. மேலும் வலிமைமிக்க அமில ஊடகத்தில் அனிலீன் புரோட்டானேற்றம் அடைந்து அனிலீனியம் அயனியைத் தருவதால் m- நைட்ரோ அனிலீன் உருவாகிறது.
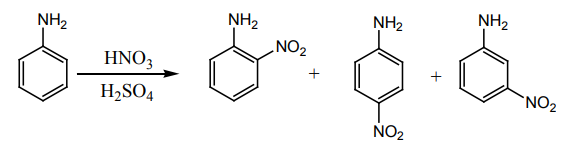
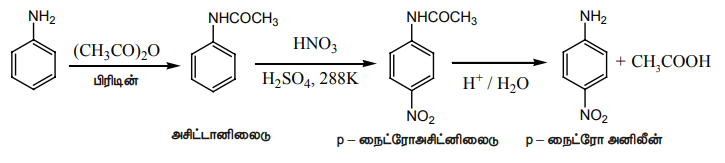
பாரா விளைபொருளைப் பெற, அசிட்டிக் அமில நீரிலியுடன் வினைப்படுத்தி அசிட்டைலேற்றம் அடையச் செய்வதன் மூலம் – NH2 தொகுதி பாதுகாக்கப்படுகிறது. பின்னர், நைட்ரோ ஏற்ற விளைபொருள் நீராற்பகுப்படையச் செய்து விளைபொருள் பெறப்படுகிறது.
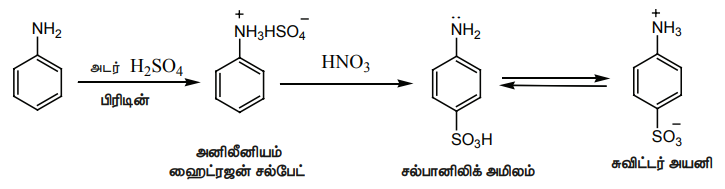
iii) சல்போனேற்றம்
அனிலீன் அடர் H2SO4 உடன் வினைபுரிந்து அனிலீனியம் ஹைட்ரஜன் சல்பேட்டைத் தருகிறது. இதனை 453 - 473Kல் H2SO4 உடன் வினைப்படுத்த p- அமினோ பென்சீன் சல்பானிக் அமிலத்தை முதன்மை விளைபொருளாக தருகிறது.
அனிலீன் பீரிடல் கிராப்ட் வினைக்கு உட்படுவதில்லை. அனிலீன் காரத்தன்மையுடையது என நாம் அறிவோம். மேலும் இது தனது தனித்த இரட்டை எலக்ட்ரானை AlCl3 போன்ற லூயி அமிலத்திற்கு வழங்கி சேர்க்கை விளைபொருளை உருவாக்குவதன் காரணமாக எலக்ட்ரான் கவர்பொருள் பதிலீட்டு வினை நிகழ்வது தடுக்கப்படுகிறது.