வகைப்பாடு, பெயரிடுதல், மாற்றியம், தயாரிப்பு, இயற்பண்புகள் மற்றும் வேதிபண்புகள் - நைட்ரோ சேர்மங்கள் | 12th Chemistry : UNIT 13 : Organic Nitrogen Compounds
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 13 : கரிம நைட்ரஜன் சேர்மங்கள்
நைட்ரோ சேர்மங்கள்
நைட்ரோ சேர்மங்கள்
நைட்ரோ சேர்மங்கள் ஹைட்ரோகார்பன்களின் வழிப்பொருட்களாக கருதப்படுகின்றன. ஹைட்ரோகார்பன்களில் காணப்படும் ஒரு ஹைட்ரஜன் அணுவானது – NO2 தொகுதியால் பதிலீடு செய்யப்படுவதால் உருவாகும் கரிமச் சேர்மங்கள் கரிம நைட்ரஜன் சேர்மங்கள் எனப்படுகின்றன.
நைட்ரோசேர்மங்களை வகைப்படுத்துல்
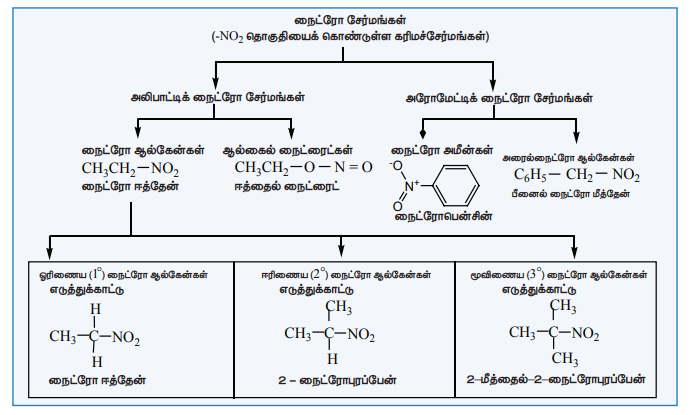
நைட்ரோ ஆல்கேன்கள் R-NO2 என்ற பொது வாய்பாட்டால் குறிக்கப்படுகின்றன. இங்கு R என்பது ஒரு ஆல்கைல் (CnH2n+1-) தொகுதியாகும். (-NO2) தொகுதி இணைக்கப்பட்டிருக்கும் கார்பன் அணுவின் தன்மையினைப் பொருத்து நைட்ரோ ஆல்கேன்கள் மேலும் ஓரிணைய, ஈரிணைய மற்றும் மூவிணைய நைட்ரோ ஆல்கேன்கள் என வகைப்படுத்தப்படுகின்றன.
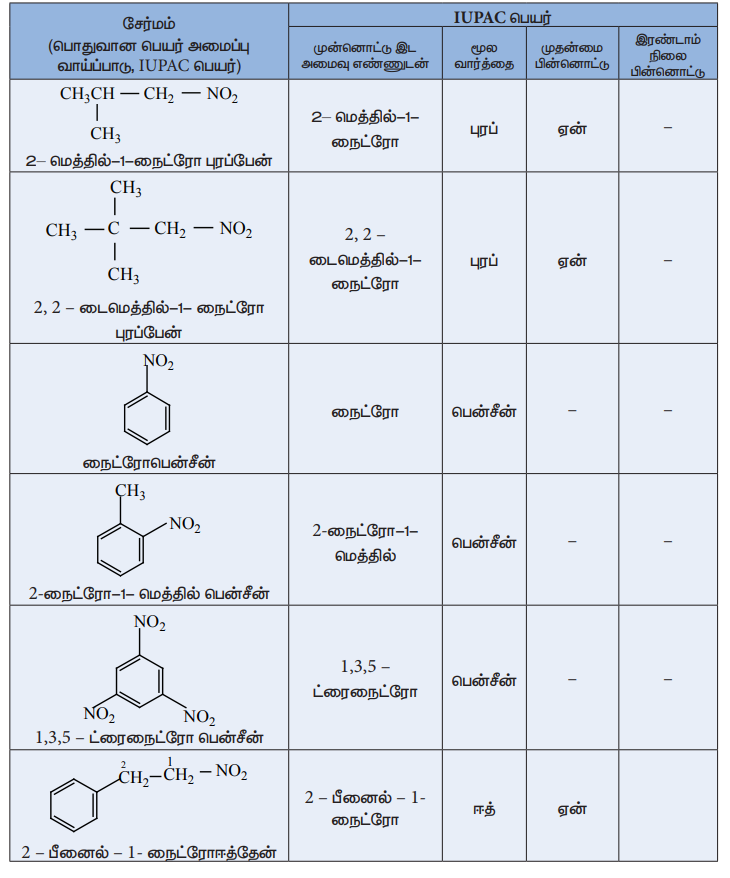
நைட்ரோ ஆல்கேன்களுக்குப் பெயரிடுதல்
IUPAC பெயரிடும் முறையில் ஆல்கேன்களின் பெயருக்கு முன்னொட்டாக நைட்ரோ தொகுதி சேர்க்கப்படுகிறது. நைட்ரோ தொகுதி இடம் பெற்றுள்ள கார்பன் எண் மூலம் குறிப்பிடப்படுகிறது.
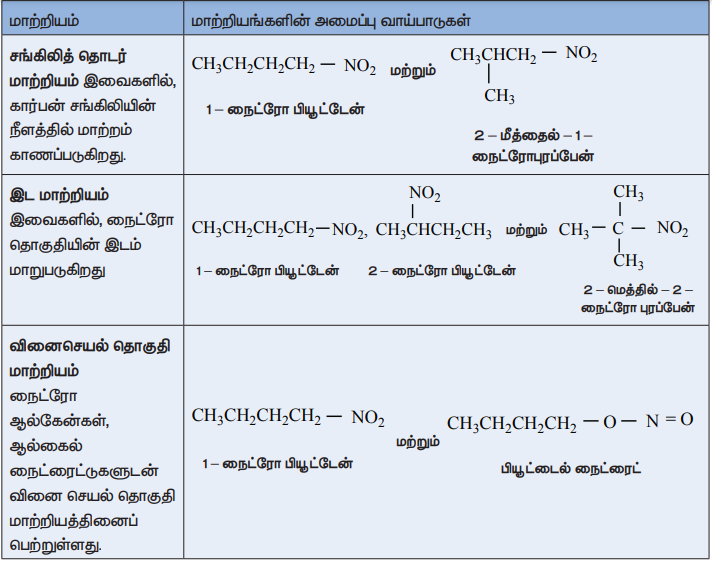
மாற்றியம்
நைட்ரோ சேர்மங்கள் சங்கிலித் தொடர் மற்றும் இட மாற்றியங்களை பெற்றிருப்பதுடன், ஆல்கைல் நைட்ரைட்டுகளுடன் வினைசெயல் தொகுதி மாற்றியத்தினையும் பெற்றுள்ளன. மேலும் α-H அனுவைக் கொண்டுள்ள நைட்ரோ ஆல்கேன்கள் இயங்கு சமநிலை மாற்றியத்தினையும் கொண்டுள்ளன. எடுத்துக்காட்டாக, C4H9NO2 என்ற மூலக்கூறு வாய்ப்பாட்டினை உடைய நைட்ரோ சேர்மங்கள் பின்வரும் மாற்றியங்களைக் கொண்டுள்ளன.
இயங்குசமநிலை மாற்றியம்: α-H ஐக் கொண்டுள்ள ஓரிணைய மற்றும் ஈரிணைய நைட்ரோ ஆல்கேன்கள் நைட்ரோ மற்றும் அசி வடிவங்களின் இயங்குசமநிலைக் கலவையாக காணப்படுகின்றது.

மூவிணைய நைட்ரோ ஆல்கேன்கள் α-Hஅணுவை பெற்றிருக்காததால், இயங்கு சமநிலை மாற்றியத்தினை பெற்றிருப்பதில்லை.
நைட்ரோ வடிவம்
1. குறைவான அமிலத்தன்மை
2. NaOHல் மெதுவாக கரைகின்றது
3. FeCl3 கரைசலை நிறமிழக்க செய்கிறது.
4. மின்கடத்துத் திறன் குறைவு
அசி வடிவம்
1. அதிக அமிலத் தன்மை
2. NaOHல் உடனடியாக கரைகிறது.
3. FeCl3 உடன் செம்பழுப்பு நிற நிறத்தைத் தருகிறது.
4. மின்கடத்துத்திறன் அதிகம்
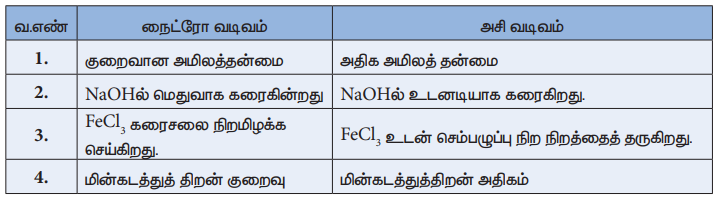
நைட்ரோ ஆல்கேன்களின் அமிலத் தன்மை
NO2 தொகுதியின் எலக்ட்ரானைக் கவரும் விளைவின் காரணமாக 1o மற்றும் 2o நைட்ரோ ஆல்கேன்களின் α-H அணு அமிலத்தன்மையைக் காட்டுகிறது. இச்சேர்மங்கள் ஆல்டிஹைடுகள், கீட்டோன்கள், எஸ்டர்கள் மற்றும் சயனைடுகளைக் காட்டிலும் அதிக அமிலத் தன்மை உடையவை.
நைட்ரோ ஆல்கேன்கள் NaOH கரைசலில் கரைந்து உப்புக்களைத் தருகின்றன. அசி நைட்ரோ பெறுதிகளானவை நைட்ரோ வடிவத்தைக் காட்டிலும் அதிக அமிலத் தன்மை உடையது. α-H கார்பனுடன் இணைக்கப்பட்டிருக்கும் ஆல்கைல் தொகுதிகளின் எண்ணிக்கை அதிகரிக்கும் போது ஆல்கைல் தொகுதிகளின் +I விளைவினால் அமிலத் தன்மையும் குறைகிறது.
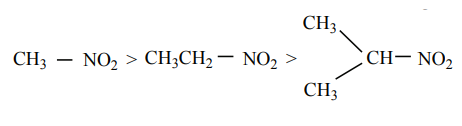
தன்மதிப்பீடு
பின்வரும் சேர்மங்களுக்கு சாத்தியமான அனைத்து மாற்றியங்களையும் எழுதுக.
i) C2H 5-NO2
ii) C3H7-NO2
நைட்ரோ ஆல்கேன்களைத் தயாரித்தல்
1) ஆல்கைல் ஹாலைடுகளிலிருந்து பெறுதல் (ஆய்வகமுறை)
அ) ஈத்தைல் புரோமைடுகள் (அல்லது) அயோடைடுகளை எத்தனாலில் கரைக்கப்பட்ட பொட்டாசியம் நைட்ரைட் கரைசலுடன் வினைப்படுத்தும் போது நைட்ரோ ஈத்தேனைத் தருகிறது.

இவ்வினை SN2 வினைவழிமுறையைப் பின்பற்றுகிறது. நைட்ரோபென்சீனை தயாரிக்க இம்முறை ஏற்றதன்று. ஏனெனில் பென்சீன் வளையத்துடன் நேரடியாக பிணைக்கப்ட்டிருக்கும் புரோமினை பிளவுறச் செய்ய இயலாது.
2) ஆல்கேன்களின் ஆவி நிலைமை நைட்ரோ ஏற்றம் (தொழிற்முறை)
மீத்தேன் மற்றும் நைட்ரிக் அமிலம் ஆகியனவற்றின் வாயுக் கலவையை செஞ்சூடான உலோக குழாயின் வழியே செலுத்தி நைட்ரோ மீத்தேன் பெறப்படுகிறது.

மீத்தேனைத் தவிர்த்த பிற ஆல்கேன்கள் (n - ஹெக்ஸேன் வரை) C - C பிளவினால் நைட்ரோ ஆல்கேன்களின் கலவையினைத் தருகின்றன. பின்ன வாலை வடித்தலின் மூலம் நைட்ரோ ஆல்கேன்கள் தனித்தனியே பிரித்தெடுக்கப்படுகின்றன.
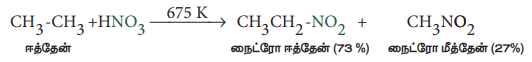
3) α- ஹேலோகார்பாக்சிலிக் அமிலங்களிலிருந்து பெறுதல்
α - குளோரோ அசிட்டிக் அமிலத் தினை சோடியம் நைட்ரைட்டின் நீர்க்கரைசலுடன் கொதிக்கச் செய்யும் போது நைட்ரோ மீத்தேன் உருவாகிறது.
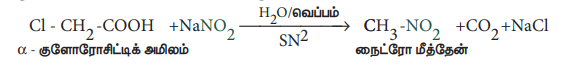
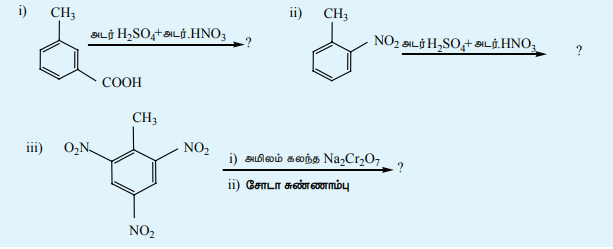
தன்மதிப்பீடு
4) பின்வரும் வினைகளில் விளைப்பொருட்களைக் கண்டறிக.
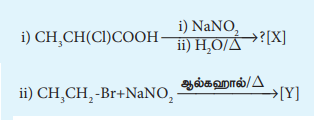
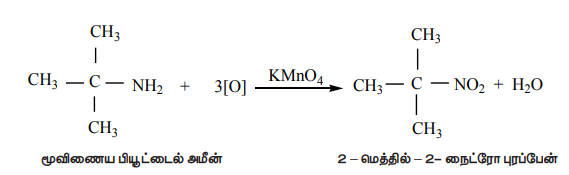
4) மூவிணைய ஆல்கைல் அமீன்களின் ஆக்சிஜனேற்றம்
மூவிணைய பியூட்டைல் அமீன் நீர்த்த KMnO4 ஆல் ஆக்சிஜனேற்றம் அடைந்து மூவிணையை நைட்ரோ ஆல்கேன்களைத் தருகின்றது.
5) ஆக்சைம்களின் ஆக்சிஜனேற்றம்
அசிட்டால்டாக்சைம் மற்றும் அசிட்டோன் ஆக்சைம் ஆகியன ட்ரைபுளுரோபெராக்ஸி அசிட்டிக் அமிலத்தால் ஆக்சிஜனேற்றம் அடைந்து முறையே நைட்ரோ ஈத்தேன் (1°) மற்றும் 2 - நைட்ரோ புரப்பேன் (2°) ஆகியனவற்றைத் தருகின்றன.
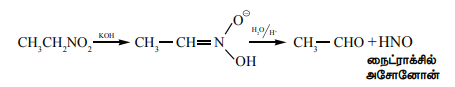
CH3 CH = N-OH ppp CH3 CH2 – NO2
அசிட்டால்டாக்சைம் நைட்ரோ ஈத்தேன்
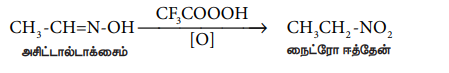
நைட்ரோ ஆரீன்களைத் தயாரித்தல்
i) நேரடி நைட்ரோ ஏற்றம்
33OK வெப்பநிலையில் பென்சீனைநைட்ரோ ஏற்றக்கலவையுடன் (அடர்.HNO3 + அடர். H2SO4) வெப்பப்படுத்தும் போது எலக்ட்ரான் கவர்பொருள் பதிலீட்டுவினை நடைபெற்று நைட்ரோ பென்சீன் (மிர்பேன் எண்ணெய்) உருவாகிறது.
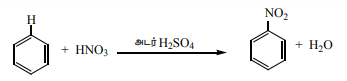
நைட்ரோபென்சீனின் நேரடி நைட்ரோ ஏற்றம் m - டைநைட்ரோ பென்சீனை உருவாக்குகிறது.
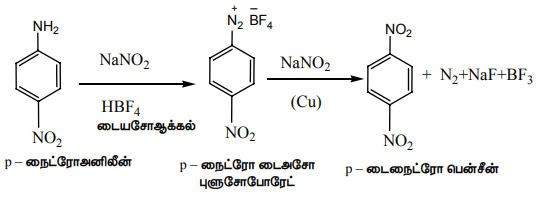
2) மறைமுக முறை
P - டைநைட்ரோ பென்சீனைத் தயாரிக்க இம்முறை பயன்படுகிறது.
எடுத்துக்காட்டு
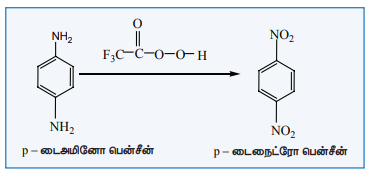
கேரஸ் அமிலம் (H2SO5) அல்லது பெர்சல்பியூரிக் அமிலம் (H2S2O8) அல்லது ட்ரைபுளுரோ பெராக்சி அசிட்டிக் அமிலம் (F3C.CO3H) போன்றவற்றை ஆக்சிஜனேற்றியாகப் பயன்படுத்தும் போது அமினோ தொகுதியானது நேரடியாக நைட்ரோ தொகுதியாக மாற்றப்படுகிறது
நைட்ரோ ஆல்கேன்களின் இயற்பண்புகள்
குறைவான கார்பன் அணுக்களைக் கொண்டுள்ள நைட்ரோ ஆல்கேன்கள் நிறமற்ற, இனிய மணமுடைய நீர்மங்கள், நீரில் சிறிதளவே கரையும் ஆனால் பென்சீன், அசிட்டோன் போன்ற கரிமக் கரைப்பான்களில் நன்கு கரைகின்றன. இவைகளின் அதிக முனைவுத் தன்மையினால் அதிக கொதிநிலைக் கொண்டுள்ளன. நைட்ரோ ஆல்கேன்களைக் காட்டிலும் ஆல்கைல் நைட்ரைட்டுகள் குறைவான கொதிநிலையைக் கொண்டுள்ளன.
நைட்ரோ ஆல்கேன்களின் வேதிப்பண்புகள்
நைட்ரோ ஆல்கேன்கள் பின்வரும் பொதுவான வினைகளில் ஈடுபடுகின்றன.
i. ஒடுக்கம் ii. நீராற்பகுப்பு iii. ஹேலஜனேற்றம்
i) நைட்ரோ ஆல்கேன்களின் ஒடுக்கம்
நைட்ரோ ஆல்கேன்களின் ஒடுக்க வினையானது முக்கியமான தொகுப்பு முறை பயன்களைக் கொண்டுள்ளது. நைட்ரோ தொகுதியின் ஒடுக்க வினையின் பல்வேறு நிலைகள் பின்வருமாறு
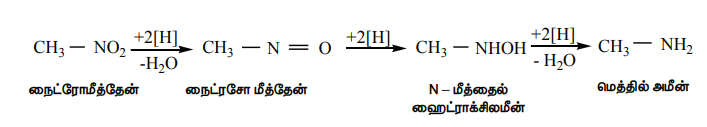
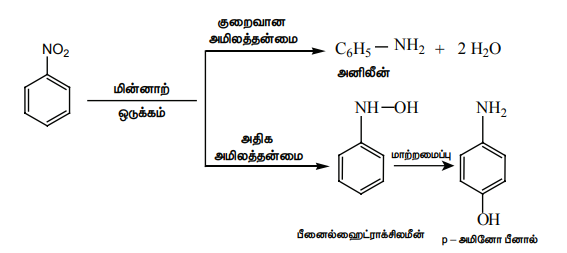
இறுதிவிளைபொருளானது ஒடுக்கும் காரணியின் தன்மை மற்றும் ஊடகத்தின் pH மதிப்பு ஆகியனவற்றைப் பொறுத்து அமையும்.
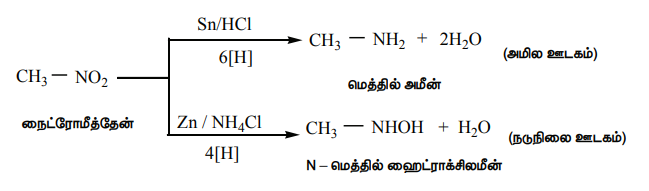
ஆல்கைல் நைட்ரைட்டுகளின் ஒடுக்கம்
Sn/ HCl ஐக் கொண்டு எத்தில்நைட்ரைட்டை ஒடுக்கும் போது எத்தனால் உருவாகிறது.
CH3CH2 - O - N=O +6[H] →Sn/HCl + CH3CH2- OH + NH3 + H2O
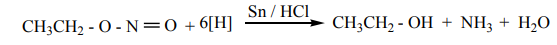
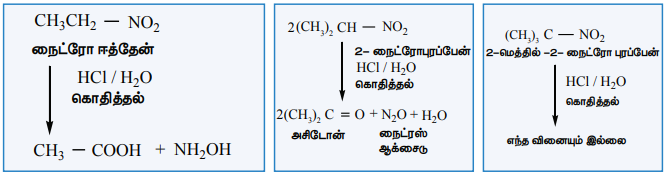
ii) நைட்ரோஆல்கேன்களின் நீராற்பகுப்பு
அடர் HCl அல்லது அடர் H2SO4 ஐப் பயன்படுத்தி நீராற்பகுத்தலை மேற்கொள்ளலாம். ஓரிணைய நைட்ரோ ஆல்கேன்களை நீராற்பகுக்கும் போது கார்பாக்சிலிக் அமிலங்கள் உருவாகின்றன. மேலும் ஈரிணைய நைட்ரோ ஆல்கேன்கள் கீட்டோன்களைத் தருகின்றன. மூவிணைய நைட்ரோ ஆல்கேன்கள் இவ்வினையில் ஈடுபடுவதில்லை.
மாறாக, எத்தில் நைட்ரைட்டின் அமில அல்லது கார நீராற்பகுப்பினால் எத்தனால் உருவாகிறது.
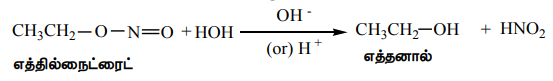
iii) நைட்ரோ ஆல்கேன்களின் ஹேலஜனேற்றம்
ஓரிணைய மற்றும் ஈரிணைய நைட்ரோ ஆல்கேன்களை Cl2, அல்லது Br2 உடன் NaOH முன்னிலையில் வினைப்படுத்த நைட்ரோ ஆல்கேன்களின் α-H அணுக்கள் ஒவ்வொன்றாக ஹேலஜன் அணுக்களால் பதிலீடு செய்யப்படுகின்றன.
CH3 – NO2 +3CI2 →NaOH CCI3- NO2 + 3HCI
குளோரோபிக்ரின் (ட்ரைகுளோரோநைட்ரோ மீத்தேன்)
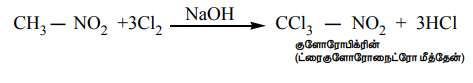
நச்சுத்தன்மை
நைட்ரோ ஈத்தேன் ஆனது மரபுத்தன்மையில் பாதிப்பை ஏற்படுத்துதல் மற்றும் நரம்பு மண்டல பாதிப்புகளுக்கு காரணமாக இருக்கலாம் என அறியப்படுகிறது.
iv) நெப்கார்பனைல் தொகுப்பு
நைட்ரோபென்சீனின் வேதிப் பண்புகள்
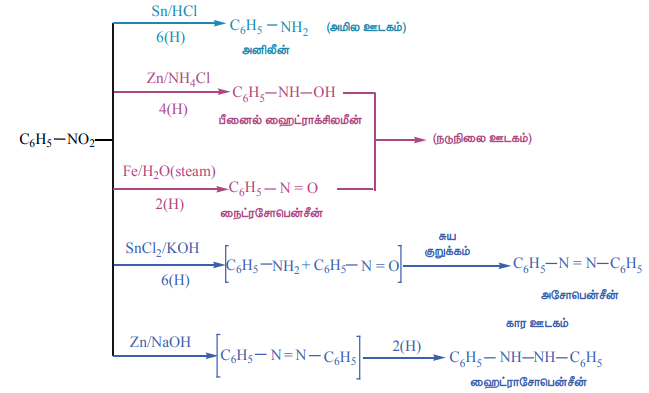
மின்னாற் ஒடுக்கம்
உலோக வினையூக்கி மற்றும் உலோக ஹைட்ரைடுகளால் ஒடுக்கம்
நைட்ரோபென்சீனை Ni (அல்லது) Pt (அல்லது) LiAlH4 ஐக் கொண்டு ஒடுக்கம் செய்யும் போது அனிலீன் உருவாகிறது.
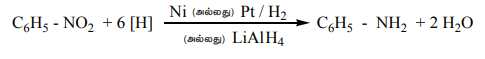
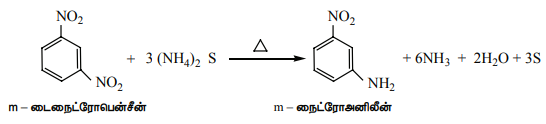
பாலிநைட்ரோ சேர்மங்களின் தெரிந்தெடுத்த ஒடுக்கம்
எலக்ட்ரான்கவர் பொருள் பதிலீட்டு வினை
பொதுவாக, நைட்ரோபென்சீனின் எலக்ட்ரான் கவர் பொருள் பதிலீட்டு வினை மிக மெதுவாக நிகழும் ஒரு வினையாகும். மேலும் தீவிரமான வினை நிகழ நிபந்தனைகளில் இவ்வினை நிகழ்த்தப்படுகிறது. (-NO2 தொகுதியானது வலிமையான கிளர்வு நீக்கும் மற்றும் m-ஆற்றுப்படுத்தும் தொகுதியாகும்)
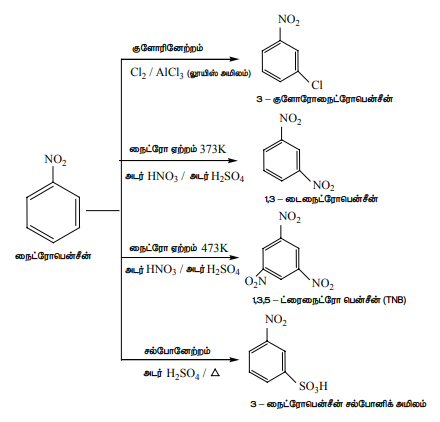
-NO2 ஆனது ஒரு வலிமையான கிளர்வு நீக்கும் தொகுதியாக இருப்பதால், நைட்ரோபென்சீன் ப்ரீடல் - கிராப்ட் வினைக்கு உட்படுவதில்லை.
தன்மதிப்பீடு
பின்வரும் சேர்மங்களின் நைட்ரோ ஏற்ற வினையினால் உருவாகும் முதன்மை விளைபொருட்களைக் கண்டறிக.