நம்மைச் சுற்றியுள்ள பருப்பொருள்கள் | முதல் பருவம் அலகு 3 | 7 ஆம் வகுப்பு அறிவியல் - தனிமங்கள் | 7th Science : Term 1 Unit 3 : Matter Around Us
7 ஆம் வகுப்பு அறிவியல் : முதல் பருவம் அலகு 3 : நம்மைச் சுற்றியுள்ள பருப்பொருள்கள்
தனிமங்கள்
தனிமங்கள்
பருப்பொருள்களை, தூய பொருள்கள் மற்றும் கலவைகள் என்று இரு பெரும் பிரிவுகளாகப் பிரிக்கலாம். தூய பொருள்கள், தனிமங்கள் மற்றும் சேர்மங்கள் என்று மேலும் பிரிக்கப்படுகின்றன.
பருப்பொருளின் எளிமையான வடிவம் தனிமம் என அழைக்கப்படுகிறது. நம் அன்றாட வாழ்வில் நாம் பல்வேறு தனிமங்களைப் பயன்படுத்துகிறோம். சாதாரண உப்பு, சோடியம் மற்றும் குளோரின் ஆகிய இரு தனிமங்களைக் கொண்டுள்ளது. நீர், ஹைட்ரஜன் மற்றும் ஆக்சிஜன் ஆகிய இரு தனிமங்களைக் கொண்டுள்ளது. மெக்னீசியம் மற்றும் பாஸ்பரஸ் வெடி பொருள்கள் தயாரிக்கப் பயன்படுகின்றன. விவசாயத்தில் உரமாக சல்பர் பயன்படுகிறது. காலியம் அலைபேசி தயாரிப்பிலும், சிலிக்கன் கணினி சிப்புகள் தயாரிப்பிலும் பயன்படுகின்றன.
இந்நாள் வரை 118 தனிமங்கள் கண்டறியப்பட்டுள்ளன. இவற்றுள், 94 தனிமங்கள் இயற்கையாகக் கிடைக்கின்றன. 24 தனிமங்கள் ஆய்வகங்களில் செயற்கையாகத் தயாரிக்கப்படுகின்றன.
தனிமங்களின் வகைப்பாடு
நாம் தனிமங்களை அவற்றின் வேதியியல் பண்புகளின் அடிப்படையில் உலோகங்கள், அலோகங்கள் மற்றும் உலோகப் போலிகள் என வகைப்படுத்தலாம்.
இராபர்ட் பாயில் என்ற விஞ்ஞானியே முதன் முதலில் தனிமம் என்ற வார்த்தையைப் பயன்படுத்தினார். இவரே பருப்பொருள்கள் தனிமங்களாகவே காணப்படுகின்றன என்பதை முதலில் கூறினார். வெற்றிடத்தின் தன்மையை முதன்முதலில் கூறியவரும் இவரே. பாயில் விதியின் மூலம் இவர் நன்கு அறியப்பட்டவர்.

உலோகங்கள்
நாம் கருவிகள், பாத்திரங்கள் மற்றும் நகைகள் போன்றவற்றை வெள்ளி, காப்பர், இரும்பு, தங்கம், அலுமினியம் போன்ற பொருள்களிலிருந்து பெறுகிறோம். அடித்தல் அல்லது உருட்டுதல் போன்ற செயல்களின் மூலம் இப்பொருள்களை பல்வேறு வடிவங்களில் மாற்றமுடியும். இவ்வாறு, தகடாக அல்லது பல்வேறு வடிவங்களில் மாற்றப்படத்தக்க வகையில் அமைந்துள்ள பொருள்களே உலோகங்கள் என அழைக்கப்படுகின்றன.
பொதுவாக உலோகங்கள் கடினமானவை மற்றும் பளபளப்பானவை. விதிவிலக்காக, சோடியம் இதில் மாறுபட்டுள்ளது. அது மென்மையான உலோகம் ஆகும். பாதரசம் தவிர பிற உலோகங்கள் அறை வெப்பநிலையில் திண்ம நிலையில் காணப்படுகின்றன. உலோகங்களை வளைக்க முடியும் அல்லது தகடாக மாற்ற முடியும். இவற்றைக் கம்பியாக நீட்ட முடியும். இவை மின்னோட்டம் மற்றும் வெப்பத்தினை நன்கு கடத்தக்கூடியவை. தாமிரம், காரீயம், டின், நிக்கல், இரும்பு, துத்தநாகம், தங்கம், மெக்னீசியம் மற்றும் கால்சியம் போன்றவை உலோகங்களுக்கான சில எடுத்துக்காட்டுகளாகும்.

அலோகங்கள்
பொதுவாக அலோகங்கள் பளபளப்பற்ற, மிருதுவான தனிமங்கள் ஆகும். ஆனால், வைரம் பளபளப்பானதும் பூமியில் கிடைக்கக்கூடிய தனிமங்களுள் கடினமானதும் ஆகும். அலோகங்கள் திண்மம், நீர்மம் மற்றும் வாயு நிலையில் இருக்கலாம். ஆக்சிஜன், ஹைட்ரஜன் மற்றும் குளோரின் போன்றவை அறை வெப்பநிலையில் வாயு நிலையில் உள்ளன. கார்பன், அயோடின், சல்பர் மற்றும் பாஸ்பரஸ் போன்றவை அறை வெப்பநிலையில் திண்மநிலையில் காணப்படுகின்றன.
அறைவெப்பநிலையில் திரவ நிலையில் காணப்படும் ஒரே அலோகம் புரோமின் ஆகும். அலோகங்கள் வெப்பம் மற்றும் மின்சாரத்தை அரிதாகக் கடத்தக்கூடியவை. இருப்பினும் கார்பனின் புறவேற்றுமை வடிவமான கிராபைட் நன்கு மின்சாரத்தைக் கடத்தக்கூடியதாகும்.
அட்டவணை 3.3 உலோகங்கள் – அலோகங்கள் வேறுபாடுகள்
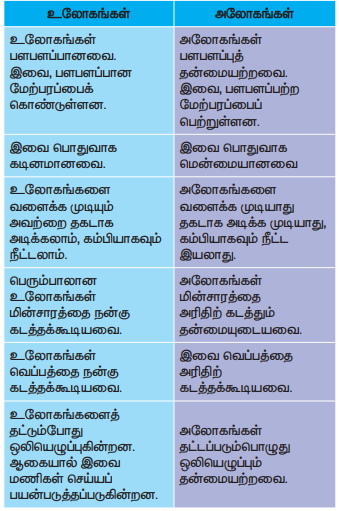
உலோகங்கள்
1. உலோகங்கள் பளபளப்பானவை. இவை, பளபளப்பான மேற்பரப்பைக் கொண்டுள்ளன.
2. இவை பொதுவாக கடினமானவை.
3. உலோகங்களை வளைக்க முடியும் அவற்றை தகடாக அடிக்கலாம், கம்பியாகவும் நீட்டலாம்.
4. பெரும்பாலான உலோகங்கள் மின்சாரத்தை நன்கு கடத்தக்கூடியவை.
5. உலோகங்கள் வெப்பத்தை நன்கு கடத்தக்கூடியவை.
6. உலோகங்களைத் தட்டும்போது ஒலியெழுப்புகின்றன. ஆகையால் இவை மணிகள் செய்யப் பயன்படுத்தப்படுகின்றன.
அலோகங்கள்
1. அலோகங்கள் பளபளப்புத் தன்மையற்றவை. இவை, பளபளப்பற்ற மேற்பரப்பைப் பெற்றுள்ளன.
2. இவை பொதுவாக மென்மையானவை
3. அலோகங்களை வளைக்க முடியாது தகடாக அடிக்க முடியாது, கம்பியாகவும் நீட்ட இயலாது.
4. அலோகங்கள் மின்சாரத்தை அரிதிற் கடத்தும் தன்மையுடையவை.
5. இவை வெப்பத்தை அரிதிற் கடத்தக்கூடியவை.
6. அலோகங்கள் தட்டப்படும்பொழுது ஒலியெழுப்பும் தன்மையற்றவை.
உலோகப்போலிகள்
உலோகங்கள் மற்றும் அலோகங்களின் பண்புகளை வெளிப்படுத்தும் தனிமங்கள் உலோகப்போலிகள் எனப்படுகின்றன. சிலிக்கன், ஆர்சனிக், ஆன்டிமணி மற்றும் போரான் ஆகியவை உலோகப்போலிகளுக்கு எடுத்துக்காட்டுகளாகும்.

தனிமங்களின் குறியீடு
ஒரு தனிமத்தின் குறியீடு என்பது அத்தனிமத்தினைச் சுருக்கமாகக் குறிப்பிடக்கூடிய முறையாகும். ஒவ்வொரு தனிமமும் தனிப்பட்ட குறியீட்டைக் கொண்டுள்ளது. இக்குறியீடு அத்தனிமத்தின் ஒரு அணுவினைக் குறிக்கிறது. இக்குறியீடுகள் பொதுவாக தனிமத்தின் பெயர்களிலிருந்து பெறப்படுகின்றன. இவை ஆங்கிலம் அல்லது இலத்தீன் மொழிப் பெயர்களாக உள்ளன. இக்குறியீடுகள் International Union of Pure and Applied Chemistry (IUPAC) என்ற அமைப்பினால் அங்கீகரிக்கப்பட்டுள்ளன.
குறியீடுகளை, தகுந்த முறையில் பயன்படுத்திய முதல் வேதியியல் அறிஞர் டால்டன் ஆவார். அவர் ஒரு தனிமத்தினைக் குறிப்பதற்கு பயன்படுத்திய குறியீடு ஒரு குறிப்பிட்ட அளவையும் குறித்தது. அதாவது, அது அத்தனிமத்தின் ஒரு அணுவைக் குறித்தது. ஒரு தனிமத்தின் பெயரில் உள்ள ஒன்று அல்லது இரண்டு எழுத்துகளைப் பயன்படுத்தி ஒரு தனிமத்தின் பெயரை எழுதலாம் என்று பெர்சிலியஸ் என்பவர் பரிந்துரைத்தார்.
தனிமங்களின் குறியீட்டை எழுதும்போது பின்வரும் விதிமுறைகள் பின்பற்றப்படுகின்றன.
• தனிமங்களின் குறியீட்டில் ஒன்று அல்லது இரண்டு எழுத்துகள் மட்டுமே இடம்பெறுகின்றன.
• பெரும்பாலான தனிமங்களின் குறியீடுகள் அவற்றின் ஆங்கிலப் பெயரின் முதல் எழுத்து கொண்டு குறிக்கப்படுகின்றன. உதாரணமாக, ஆக்சிஜனின் குறியீடு O எனவும், ஹைட்ரஜனின் குறியீடு H எனவும் குறிக்கப்படுகின்றது. தனிமங்களின் குறியீடு பற்றி நீங்கள் எட்டாம் வகுப்பில் விரிவாகக் காண்பீர்கள்.
ஆரம்ப நாட்களில் தனிமங்களின் பெயர்கள் அத்தனிமம் முதன்முதலில் எந்த இடத்தில் கிடைத்ததோ அந்த இடத்தின் பெயரிலிருந்து வருவிக்கப்பட்டது. உதாரணமாக காப்பர் என்ற பெயர் சைப்ரஸ் என்ற பெயரில் இருந்து உருவாக்கப்பட்டது. சில தனிமங்களின் பெயர்கள் அத்தனிமத்தின் நிறங்களிலிருந்து உருவாக்கப்பட்டன. உதாரணமாக, தங்கம் (Gold) என்பது மஞ்சள் எனப் பொருள் தரும் ஆங்கில வார்த்தையிலிருந்து வருவிக்கப்பட்டது. தற்காலங்களில் IUPAC அமைப்பே தனிமங்களுக்கான பெயர்களை அங்கீகரிக்கிறது. பல தனிமங்களின் குறியீடுகள் அத்தனிமங்களின் ஆங்கிலப் பெயர்களின் ஒன்று அல்லது இரண்டு எழுத்துகளை இணைத்து உருவாக்கப்படுகின்றன. குறியீட்டின் முதல் எழுத்தானது எப்போதும் பெரிய ஆங்கில எழுத்தினாலும் இரண்டாவது எழுத்தானது சிறிய ஆங்கில எழுத்தினாலும் எழுதப்படுகின்றது.
செயல்பாடு 1
கீழ்க்காணும் தனிமங்களின் குறியீடுகளை எழுதவும்.
தனிமம் குறியீடு
தங்கம் Au
வெள்ளி Ag
தாமிரம் Cu
இரும்பு Fe
நைட்ரஜன் N2
ஆக்சிஜன் O2
அலுமினியம் Al
கால்சியம்
Ca
பாஸ்பரஸ் P
மெக்னீசியம் Mg
பொட்டாசியம் K
சோடியம் Na
மனித உடலில் உள்ள தனிமங்கள்
மனித உடலின் நிறையில் ஏறத்தாழ 99 சதவீதம் நிறையானது ஆறு வேதியியல் தனிமங்களால் மட்டும் ஆனதாகும். அவை: ஆக்சிஜன், கார்பன், ஹைட்ரஜன், நைட்ரஜன், கால்சியம் மற்றும் பாஸ்பரஸ். மற்ற ஐந்து தனிமங்களான பொட்டாசியம், சல்பர், சோடியம், குளோரின் மற்றும் மக்னீசியம் போன்றவை மிகக் குறைந்த சதவீத அளவில் காணப்படுகின்றன.
காற்றில் உள்ள தனிமங்கள்
காற்றானது பல்வேறு வாயுக்களின் கலவையாகும். காற்றில் நைட்ரஜன் மற்றும் ஆக்சிஜன் ஆகிய தனிமங்களின் மூலக்கூறுகளே 99 சதவீதம் காணப்படுகின்றன. இவற்றைத் தவிர ஆர்கான் மற்றும் கரியமில வாயு ஆகியவையும் சிறிய அளவில் காணப்படுகின்றன. நியான், ஹீலியம் மற்றும் மீத்தேன் போன்றவை மிகக் குறைந்த அளவில் காணப்படுகின்றன. காற்றில் காணப்படும் உயிர் கொடுக்கும் தனிமம் ஆக்சிஜன் ஆகும்.