10வது அறிவியல் : அலகு 9 : கரைசல்கள்
கரைதிறனை பாதிக்கும் காரணிகள்
கரைதிறன்
ஒரு குறிப்பிட்ட வெப்பநிலையில், குறிப்பிட்ட அளவு
கரைப்பானில் கரையக்கூடிய கரைபொருளின் அளவிற்கு ஒர் எல்லை உண்டு (குறிப்பிட்ட அளவே
கரையும்). இந்த எல்லையை அடையும் போது தெவிட்டிய கரைசல் உருவாகிறது. மேலும்
கூடுதலாக சேர்க்கப்படும் கரைபொருளானது கரையாமல் கரைசலின் அடியில் தங்கிவிடுகிறது
ஒரு கரைப்பானில் கரையக்கூடிய கரைபொருளின் அளவை கரைதிறன் என்ற பண்பினால்
விளக்க முடியும். கரைதிறன் என்பது எவ்வளவு கரைபொருள் குறிப்பிட்ட அளவு கரைப்பானில்
கரையும் என்பதற்கான அளவீடாகும்.
ஒரு குறிப்பிட்ட வெப்பநிலை மற்றும்
அழுத்தத்தில் 100 கி கரைப்பானில் கரைந்து தெவிட்டிய கரைசலை உருவாக்க தேவையான கரைபொருளின்
கிராம்களின் எண்ணிக்கை அதன் கரைதிறன் எனப்படும். உதாரணமாக 25°C ல் 100 கி நீரில், 36 கி
சோடியம் குளோரைடு கரைந்து தெவிட்டிய கரைசலை உருவாக்குகிறது.
கரைதிறன் என்பதை பின்வரும்
சமன்பாட்டை கொண்டு கணக்கிடலாம்.

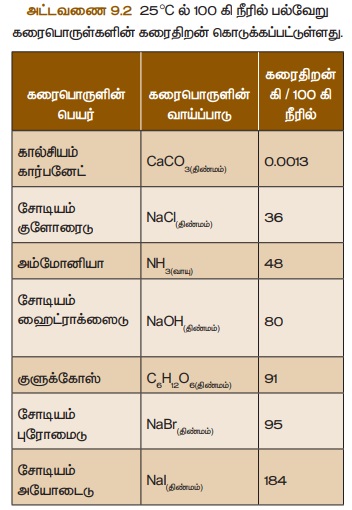
அட்டவணை 9.2 25 °C ல் 100 கி நீரில்
பல்வேறு கரைபொருள்களின் கரைதிறன் கொடுக்கப்பட்டுள்ளது.
கரைதிறனை
பாதிக்கும் காரணிகள்
ஒரு கரைபொருளின் கரைதிறனை மூன்று
முக்கிய காரணிகள் தீர்மானிக்கின்றன. அவைகளாவன.
(1) கரைபொருள் மற்றும் கரைப்பானின் தன்மை
(2) வெப்பநிலை
(3) அழுத்தம்
(1) கரைபொருள் மற்றும் கரைப்பானின் தன்மை
கரைதிறனில், கரைப்பான் மற்றும்
கரைபொருளின் தன்மை முக்கிய பங்கு வகிக்கிறது. நீர் பெரும்பான்மையான பொருட்களை
கரைக்கும் தன்மையை கொண்டிருந்தாலும், சில பொருள்கள் நீரில்
கரைவதில்லை. இதனையே வேதியியலாளர்கள் கரைதிறனை பற்றிக் குறிப்பிடும் போது "ஒத்த
கரைபொருட்கள் ஒத்த கரைப்பானில் கரைகிறது" (Like dissolves like) என்கின்றனர். கரைபொருளுக்கும் கரைப்பானுக்கும் இடையே ஒற்றுமை காணப்படும்
போது தான் கரைதல் நிகழ்கிறது. உதாரணமாக, சமையல் உப்பு
முனைவுறும் சேர்மம் எனவே இது முனைவுறும் கரைப்பானான நீரில் எளிதில் கரைகிறது.
அதுபோலவே முனைவுறாச் சேர்மங்கள்
முனைவுறா கரைப்பானில் எளிதில் கரைகிறது. உதாரணமாக, ஈதரில் கரைக்கப்பட்ட கொழுப்பு. ஆனால்,
முனைவுறாச் சேர்மங்கள் முனைவுறும் கரைப்பானில் கரைவதில்லை. அதுபோல
முனைவுறும் சேர்மங்கள் முனைவுறா கரைப்பானில் கரைவதில்லை.
(2) வெப்பநிலை
i) திரவத்தில் திண்மங்களின் கரைதிறன்
பொதுவாக வெப்பநிலை அதிகரிக்கும்
போது நீர்ம கரைப்பானில் திண்மப் பொருளின் கரைதிறன் அதிகரிக்கிறது. உதாரணமாக, குளிர்ந்த நீரில்
கரைவதை விட சர்க்கரை, சுடுநீரில் அதிக அளவில் கரைகிறது.
வெப்பக்கொள் செயல்முறையில், வெப்பநிலை
அதிகரிக்கும் போது கரைதிறன் அதிகரிக்கிறது.
வெப்பஉமிழ் செயல்முறையில், வெப்பநிலை
அதிகரிக்கும் போது கரைதிறன் குறைகிறது.
ii) திரவத்தில்
வாயுக்களின் கரைதிறன்
நீரை வெப்பப்படுத்தும் போது
குமிழிகள் வருகின்றன; ஏன்? திரவத்தின் வெப்பநிலையை அதிகரிக்கும் போது
வாயுவின் கரைதிறன் குறைகிறது. ஆகையால் ஆக்ஸிஜன் குமிழிகளாக வெளியேறுகிறது.
நீர்வாழ் உயிரினங்கள் குளிர்
பிரதேசங்களில் அதிகமாக வாழ்கின்றன. குளிர் பிரதேசங்களில் உள்ள நீர்நிலைகளில் அதிக
அளவு ஆக்ஸிஜன் கரைந்துள்ளது. ஏனெனில், வெப்பநிலை குறையும் போது ஆக்ஸிஜனின் கரைதிறன்
அதிகரிக்கிறது.
(3) அழுத்தம்
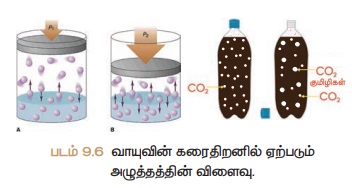
வாயுக்களை கரைபொருளாக கொண்ட திரவ
கரைசல்களில் மட்டுமே அழுத்தத்தின் விளைவு குறிப்பிடதக்கதாக இருக்கும். அழுத்தத்தை
அதிகரிக்கும் போது ஒரு திரவத்தில் வாயுவின் கரைதிறன் அதிகரிக்கிறது.
வாயுக்களை கரைபொருளாக கொண்ட திரவ
கரைசல்களுக்கு சில எடுத்துக்காட்டுகள் குளிர்பானங்கள், வீட்டு உபயோக
அம்மோனியா, பார்மலின் போன்றவைகள்.
மேலும் அறிந்து கொள்க
திரவத்தில்
வாயுவின் கரைதிறனில் அழுத்தத்தின் விளைவை ஹென்றியின் விதி விளக்குகிறது.
இவ்விதிப்படி அழுத்த அதிகரிப்பு, வாயுக்களில் கரைதன்மையை அதிகரிக்கும்.
ஒரு குறிப்பிட்ட வெப்பநிலையில், ஒரு குறிப்பிட்ட பருமனளவு
நீர்மத்தில் கரைந்துள்ள வாயுவின் நிறை அதன்மீது செலுத்தப்பட்ட அழுத்தத்திற்கு
நேர்விகிதப் பொருத்தமுடையது.