10வது அறிவியல் : அலகு 7 : அணுக்களும் மூலக்கூறுகளும்
மோல் கருத்து
மோல் கருத்து
இதுவரை நாம் பருப்பொருள்களில் உள்ள
தனித்த அணுக்கள் மற்றும் மூலக்கூறுகளைப் பற்றிப் படித்தோம். அணு நிறை அலகானது
தனிமங்களின் அணுநிறைகளுக்கு இடையேயான ஒரு ஒப்பீட்டு மதிப்பினை வழங்குகிறது. ஆனால்
அணுக்கள் மிகச்சிறிய நிறையை கொண்டிருப்பதால், அணு நிறை அலகைக் கொண்டு பெரும் எண்ணிக்கையிலான
அணுக்களின் நிறையைக் கணக்கிடுவது என்பது சரியான முறையல்ல. நாம் பெரும் மாதிரிகளின்
எண்ணிக்கையை அளவிட பல்வேறு அளவிடும் முறைகளை ஏற்கனவே வழக்கத்தில் கொண்டுள்ளோம்.
உதாரணமாக ஜோடி (2 உருப்படிகள்) மற்றும் டஜன் (12 உருப்படிகள்) போன்றவை அனைவருக்கும் நன்கு
தெரிந்த அலகுகள் ஆகும். அதுபோல அதிக எண்ணிக்கை கொண்ட அணுக்கள் மற்றும்
மூலக்கூறுகளைக் குறிப்பிடுவதற்கு ஒரு சிறப்பு அலகு தேவைப்பட்டது. எனவே
வேதியியலாளர்கள் அணுக்களையும் மூலக்கூறுகளையும் அளவிடுவதற்கு "மோல்” என்ற அலகைப் பயன்படுத்துகின்றனர். இங்கு மோல் என்ற சொல் துகள்களின்
எண்ணிக்கையை மட்டுமே குறிப்பிடுகிறது.
SI அளவீட்டு முறையில்
ஒரு மோல் என்பது கார்பன்-12 (C-12) ஐசோடோப்பின் 12 கி (அல்லது 0.012 கிகி) நிறையில் உள்ள அணுக்களின்
எண்ணிக்கைக்குச் சமமான அடிப்படை துகள்களை (அணுக்கள், மூலக்கூறு
மற்றும் பிற) கொண்ட பொருளின் அளவு ஆகும். 12 கி நிறை கொண்ட C-12
ஐசோடோப்பில் உள்ள அணுக்களின் எண்ணிக்கை சோதனை முறையில் நிர்ணயம்
செய்யப்பட்டுள்ளது. இது இத்தாலிய அறிவியல் அறிஞர் அவகாட்ரோ என்பவரால் முன்மொழியப்பட்டதால்
அவரது பெயரிலேயே ‘அவகாட்ரோ எண்’
என அழைக்கப்படுகிறது. இதன் மதிப்பு 6.023 × 1023
ஆகும். ஆகவே ஒரு மோல் என்பது 6.023 × 1023 துகள்களால்
(மூலக்கூறுகளால்) ஆனது. உதாரணமாக 5 மோல் ஆக்சிஜன்
மூலக்கூறுகளில் 5 × 6.023 × 1023 மூலக்கூறுகள்
உள்ளன.
மோல் தத்துவம் : மோல் என்பதனை எண்ணிக்கை அலகாகப்
பயன்படுத்தி மூலக்கூறுகளின் நிறை மற்றும் பருமனை கணக்கிடும் முறையே மோல்
தத்துவம் ஆகும்.
மோல்களின் எண்ணிக்கையானது
கிடைக்கப்பெற்ற கீழ்கண்ட பல்வேறு வகையான தரவுகளிலிருந்து பின்வருமாறு
கணக்கிடப்படுகிறது.
· அணுக்களின் மோல்களின் எண்ணிக்கை
· மூலக்கூறுகளின் மோல்களின் எண்ணிக்கை
· வாயுக்களின் மோல்களின் எண்ணிக்கை (திட்ட வெப்ப அழுத்த
நிலையில் (S.TP) திட்ட மோலார் பருமன் = 22.4 லிட்டர் )
· அயனிகளின் மோல்களின் எண்ணிக்கை
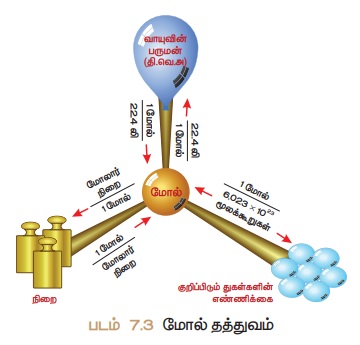
(குறிப்பு: தி.வெ.அ - திட்ட வெப்பநிலை மற்றும்
அழுத்த நிலை என்பது 273.15
K மற்றும் வளிமண்டல அழுத்தத்தைக் குறிக்கும்.)
ஒரு அணுவின்
மோல்:
ஒரு மோல் அணு என்பது 6.023 × 1023 அணுக்களைக் குறிப்பிடுவதாகும். இது அந்த அணுவின் கிராம் அணு நிறைக்குச்
சமம்.
உதாரணமாக ஒரு மோல் ஆக்சிஜன் அணு
என்பது 6.023 × 1023 ஆக்சிஜன் அணுக்களைக் கொண்டது அதன் கிராம் அணுநிறை 16கி.
ஒரு மூலக்கூறின்
மோல்:
ஒரு மோல் மூலக்கூறு என்பது 6.023 × 1023 மூலக்கூறுகளை குறிப்பிடுவதாகும். இது அந்த மூலக்கூறின் கிராம்
மூலக்கூறுநிறைக்குச் சமம்.
உதாரணமாக ஒரு மோல் மூலக்கூறு
ஆக்சிஜன் என்பது 6.023
× 1023 ஆக்சிஜன் மூலக்கூறுகளைக் கொண்டது. அதன் கிராம்
மூலக்கூறு நிறை 32 கி.
மோலார் பருமன்:
திட்ட வெப்ப அழுத்த நிலையில் (S.T.P) ஒரு மோல்
வாயுவானது 22.4 லிட்டர் அல்லது 22400
மிலி பருமனை ஆக்கிரமிக்கும். இது மோலார் பருமன் எனவும் அழைக்கப்படும்.
மோல்களின்
எண்ணிக்கையைக் கணக்கிடும் பல்வேறு முறைகள்
மோல்களின் எண்ணிக்கை
= நிறை / அணு நிறை
= நிறை / மூலக்கூறு நிறை
= அணுக்களின்
எண்ணிக்கை / 6.023 × 1023
= மூலக்கூறுகளின்
எண்ணிக்கை / 6.023 × 1023
