அணுக்களும் மூலக்கூறுகளும் | அறிவியல் - தீர்க்கப்பட்ட கணக்குகள் | 10th Science : Chapter 7 : Atoms and Molecules
10வது அறிவியல் : அலகு 7 : அணுக்களும் மூலக்கூறுகளும்
தீர்க்கப்பட்ட கணக்குகள்
அணுக்களும் மூலக்கூறுகளும் (அறிவியல்)
தீர்க்கப்பட்ட கணக்குகள்
I. மூலக்கூறு நிறை
கணக்குகள்
கீழ்கண்டவற்றின் மூலக்கூறு நிறையைக்
காண்க.
1) H2O
2) CO2 3) Ca3 (PO4)2
தீர்வுகள்
1. H2O
Hன் அணு நிறை = 1,
O - ன் அணு நிறை = 16
H2O ன் மூலக்கூறு நிறை = (1 × 2) + (16 × 1) = 2 + 16
H2O ன் மூலக்கூறு நிறை = 18 கி
2. CO2
C ன் அணு நிறை = 12,
O -ன் அணு நிறை = 16
CO2 ன் மூலக்கூறு நிறை = (12 × 1) + (16 × 2)
= 12 + 32
CO2 ன் மூலக்கூறு நிறை = 44 கி
3. Ca3 (PO4)2
Ca ன் அணு நிறை = 40,
P-ன் அணு நிறை = 30,
O ன் அணு நிறை = 16.
Ca3 (PO4)2 ன் மூலக்கூறு நிறை
= (40 × 3) + [30 + (16 × 4)] × 2
= 120 + (94 × 2)
= 120 + 188
Ca3 (PO4)2 ன் மூலக்கூறு நிறை = 308 கி
II. நிறை மற்றும்
பருமனைப் பயன்படுத்தி மோல்களைக் கணக்கிடுதல்
1. 46 கி சோடியத்தின்
மோல்களைக் கணக்கிடு

2. S.T.P இல் 5.6 லிட்டர் ஆக்சிஜன்
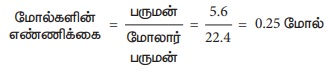
3. 12.046 × 1023 இரும்பின் மோல்களைக் கணக்கிடு.

III. மோல்களின் எண்ணிக்கையிலிருந்து
நிறையைக் கணக்கிடுதல்.
1. 0.3 மோல்
அலுமினியம் (Al ன் அணுநிறை = 27)
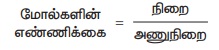
நிறை = மோல்களின் எண்ணிக்கை × அணுநிறை
நிறை = 0.3 x 27 = 8.1 கி
2. S.T.P இல் 2.24 லிட்டர் SO2
மூலக்கூறு நிறை = 32 + (16 × 2) = 32 + 32 = 64 கி

நிறை = மோல்களின் எண்ணிக்கை × மூலக்கூறு நிறை
நிறை = 0.1 × 64 = 6.4 கி
3. 1.51 × 1023 மூலக்கூறு நீர்
நீரின் மூலக்கூறு நிறை = 18 கி

நிறை = மோல் × மூலக்கூறு நிறை
நிறை = 0.25 × 18 = 4.5 கி
4. 5 × 1023 மூலக்கூறு குளுக்கோஸ்
குளுக்கோஸின் மூலக்கூறு நிறை = 180 கி

=
(180 × 5 × 1023) / 6.023 × 1023
= 149.43 கி
IV. மூலக்கூறுகளின் எண்ணிக்கை
மற்றும் அணுக்களின் எண்ணிக்கையைக் கணக்கிடுதல்.
1. 11.2 லி CO2 இல் உள்ள
மூலக்கூறுகளின் எண்ணிக்கையைக் கணக்கிடு
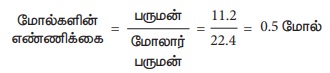
மூலக்கூறுகளின் எண்ணிக்கை = மோல்களின் எண்ணிக்கை
× அவகாட்ரோ எண்
= 0.5 × 6.023 × 1023 =
3.011 × 1023 மூலக்கூறுகள்
2. 1கி தங்கத்தில் உள்ள
அணுக்களின் எண்ணிக்கையைக் கணக்கிடு (Au ன் அணுநிறை = 198 கி)

3. 54 கி H2O இல் உள்ள மூலக்கூறுகளின் எண்ணிக்கை யாது?

4. 5 மோல் CO2
ல் உள்ள கார்பன் மற்றும் ஆக்சிஜன் அணுக்களின் எண்ணிக்கையைக் காண்க.
• 1 மோல் CO2
இல் 2 மோல் ஆக்சிஜன் அணுக்கள் உள்ளது
* 5 மோல் CO2 இல்
10 மோல் ஆக்சிஜன் அணுக்கள் உள்ளது அணுக்களின் எண்ணிக்கை
= மோல்களின் எண்ணிக்கை × அவகாட்ரோ எண்
= 10 × 6.023 × 1023 =
6.023 × 1024 ஆக்சிஜன் அணு
* 1 மோல் CO2 இல்
1 மோல் கார்பன் அணுக்கள் உள்ளது
* 5 மோல் CO2
இல் 5 மோல் கார்பன் அணுக்கள் உள்ளது
அணுக்களின் எண்ணிக்கை = மோல்களின் எண்ணிக்கை
× அவகாட்ரோ எண்
= 5 × 6.023 × 1023 =
3.011 × 1024 கார்பன் அணு
V. மோலார் பருமன் கணக்குகள்
கீழ்கண்டவற்றின் பருமனைக் கண்க்கிடு:
1. 2.5 மோல் CO2
பருமன் = மோல்களின் எண்ணிக்கை
× மோலார் பருமன்
பருமன் = 2.5 × 22.4 = 56 லிட்டர்
2. 12.046 × 1023 மூலக்கூறு அம்மோனியா

பருமன் = மோல்களின் எண்ணிக்கை × மோலார் பருமன்
பருமன் = 2 × 22.4 = 44.8 லிட்டர்
3. 14 கி நைட்ரஜன் வாயு

பருமன் = மோல்களின் எண்ணிக்கை
× மோலார் பருமன்
பருமன் = 0.5 × 22.4 = 11.2 லிட்டர்
VI. சதவீத இயைபு கணக்குகள்
1. H2SO4 ல் உள்ள S ன் சதவீத இயைபினைக் காண்க
H2SO4 ன் மூலக்கூறு நிறை
= (1 × 2) + (32 × 1) + (16 × 4)
= 2 + 32 + 64 = 98 கி
