வேதிப் பிணைப்புகள் | வேதியியல் - பிணைப்பு அளவீட்டுக் காரணிகள் | 11th Chemistry : UNIT 10 : Chemical bonding
11 வது வேதியியல் : அலகு 10 : வேதிப் பிணைப்புகள்
பிணைப்பு அளவீட்டுக் காரணிகள்
பிணைப்பு அளவீட்டுக் காரணிகள்
ஒரு சகப்பிணைப்பானது பிணைப்பு நீளம், பிணைப்புக் கோணம், பிணைப்புத் தரம் போன்ற அளவீட்டுக் காரணிகளால் வரையறுக்கப்படுகிறது. சில பிணைப்பு அளவீட்டுக் காரணிகள் பின்வரும் பகுதியில் சுருக்கமாக தரப்பட்டுள்ளன.
1. பிணைப்பு நீளம்
சகப்பிணைப்பால் பிணைக்கப்பட்டுள்ள இரு அணுக்களின் அணுக்கருக்களுக்கு இடைப்பட்ட தொலைவு பிணைப்பு நீளம் எனப்படுகின்றது. A-B என்ற சகப்பிணைப்பு மூலக்கூறினைக் கருதுக. பிணைப்பு நீளமானது பிணைக்கப்பட்டுள்ள அணுக்களின் அணு ஆரங்களின் கூடுதல் (rA + rB ) மதிப்பால் பெறப்படுகிறது. நிறமாலை முடிவுகள் X-கதிர் விளிம்பு விளைவு மற்றும் எலக்ட்ரான் விளிம்பு விளைவு நுட்பங்களைப் பயன்படுத்திப் பிணைப்பு நீளத்தினைக் கண்டறியலாம். இணையும் அணுக்களின் உருவளவு மற்றும் அவைகளுக்கிடையேயான பிணைப்புகளின் எண்ணிக்கை ஆகியவற்றினைப் பொறுத்து பிணைப்பு நீளம் அமைகின்றது.
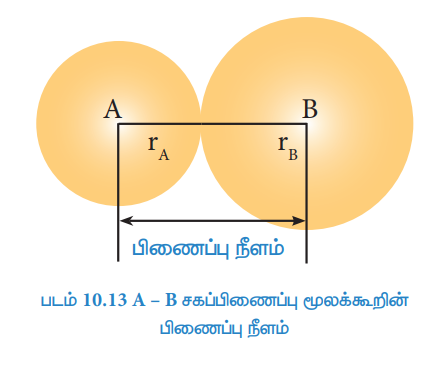
அணுவின் உருவளவு அதிகமாக உள்ளபோது, பிணைப்பு நீளம் அதிகமாக இருக்கும். எடுத்துக்காட்டாக கார்பன் - கார்பன் ஒற்றை பிணைப்பின் நீளமானது (1.54 Å) கார்பன் – நைட்ரஜன் ஒற்றை பிணைப்பின் நீளத்தைக் (1.43 Å) காட்டிலும் அதிகமாகும்.
இணையும் இரு அணுக்களுக்கிடையேயான பிணைப்புகளின் எண்ணிக்கை அதிகமாக இருப்பின் பிணைப்பு நீளம் குறைவாக இருக்கும். எடுத்துக்காட்டாக கார்பன் -கார்பன் ஒற்றை பிணைப்பின் நீளம் (1.54 Å) ஆனது, கார்பன் -கார்பன் முப்பிணைப்பின் நீளம் (1.20 Å) மற்றும் கார்பன் -கார்பன் இரட்டைப் பிணைப்பு நீளம் (1.33 Å) ஆகியவற்றைக்காட்டிலும் அதிகம்.
2. பிணைப்புத்தரம்
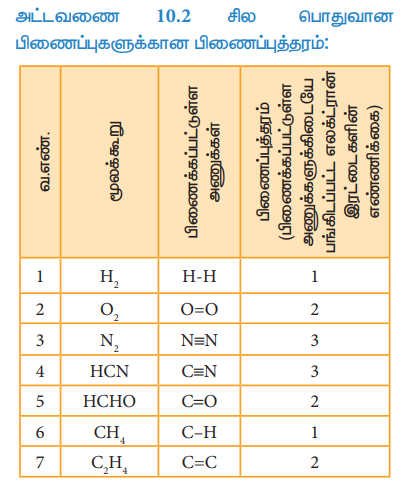
ஒரு மூலக்கூறில் உள்ள இரு அணுக்களுக்கு இடையேயான பிணைப்புகளின் எண்ணிக்கை பிணைப்புத்தரம் என்றழைக்கப்படுகிறது. லூயிஸ் கொள்கையில், பிணைப்புத் தரம் என்பது பிணைக்கப்பட்டுள்ள இரு அணுக்களுக்கிடையே சமமாகப் பங்கிடப்பட்டுள்ள எலக்ட்ரான் இரட்டைகளின் எண்ணிக்கை ஆகும்.
எடுத்துக்காட்டாக ஹைட்ரஜன் மூலக்கூறில், ஒரே ஒரு எலக்ட்ரான் இரட்டையானது இரு ஹைட்ரஜன் அணுக்களுக்கிடையே பங்கிடப்பட்டுள்ளது. எனவே, ஹைட்ரஜனின் பிணைப்புத்தரம் ஒன்று. இதைப் போலவே H2O, HCl, மீத்தேன் போன்றவற்றில் மைய அணுவானது ஒற்றைப் பிணைப்பை கொண்டுள்ளது, எனவே அம்மைய அணுவின் பிணைப்புத்தரம் ஒன்று.
அட்டவணை 10.2 சில பொதுவான பிணைப்புகளுக்கான பிணைப்புத்தரம்:
3. பிணைப்புக் கோணம்
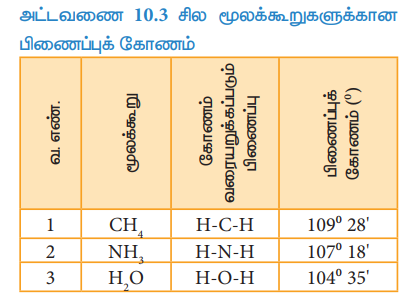
சகப்பிணைப்புகள் திசைப்பண்புடையவை அவைகள் புறவெளியில் குறித்த திசையினை நோக்கி அமைகின்றன. இத்திசைப் பண்பின் காரணமாக ஒரு மூலக்கூறின் இருசகப் பிணைப்புகளுக் கிடையே குறிப்பிட்ட நிலையான கோணம் உருவாகிறது. இக்கோணம் பிணைப்புக் கோணம் என்றழைக்கப்படுகின்றது. இது வழக்கமாக டிகிரி (o) அலகில் குறிப்பிடப்படும். நிறமாலை முறைகளைப் பயன்படுத்தி பிணைப்புக் கோணத்தைக் கண்டறியலாம். மேலும் பிணைப்புக் கோணம் மூலக்கூறின் வடிவமைப்பு பற்றிய கருத்தினைத் தருகிறது.
அட்டவணை 10.3 சில மூலக்கூறுகளுக்கான பிணைப்புக் கோணம்
4. பிணைப்பு ஆற்றல்
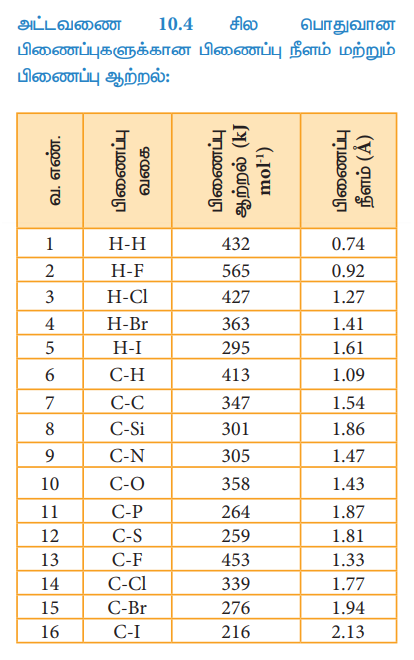
ஒரு மூலக்கூறானது அதன் வாயுநிலையில் உள்ளபோது அதிலுள்ள ஒரு மோல் அளவுள்ள ஒரு குறிப்பிட்ட பிணைப்பினை பிளப்பதற்குத் தேவைப்படும் குறைந்தபட்ச ஆற்றல் அக்குறிப்பிட்ட பிணைப்பின் பிணைப்பு ஆற்றல் என வரையறுக்கப்படுகிறது. பிணைப்பு ஆற்றலின் அலகு KJmol-1 பிணைப்பு ஆற்றலின் மதிப்பு அதிகமெனில், பிணைப்பு அதிகவலிமை உடையது. பிணைக்கப்பட்டிருக்கும் அணுக்களின் உருவளவு மற்றும் அவைகளுக்கிடையேயான பிணைப்புகளின் எண்ணிக்கை ஆகியவற்றினைப் பொறுத்து பிணைப்பு ஆற்றல் அமையும். பிணைப்பில் ஈடுபட்டுள்ள அணுவின் உருவளவு அதிகம் எனில், பிணைப்பு ஆற்றலின் மதிப்பு குறைவாகும்.
இரண்டு அல்லது அதற்கு மேற்பட்ட ஒரே மாதிரியானப் பிணைப்பினைக் கொண்டுள்ள பல்லணு மூலக்கூறுகளில் சராசரி பிணைப்பு ஆற்றல் என்ற சொற்கூறு (term) பயன்படுத்தப்படுகிறது. அத்தகைய பிணைப்புகளில் ஒரே மாதிரியான பிணைப்புகளின் பிணைப்பு ஆற்றல்களின் கூட்டு சராசரி மதிப்பானது சராசரி பிணைப்பு ஆற்றலாகக் கருதப்படுகிறது. எடுத்துக் காட்டாக நீர்மூலக்கூறில் இரு O-H பிணைப்புகள் காணப்படுகின்றன. மேலும் இவ்விரண்டு பிணைப்புகளை பிளப்பதற்கு தேவையான ஆற்றல் வெவ்வேறு மதிப்புகளை உடையது.
H2O(g) → H(g) + OH(g) ΔH1 = 502 kJ mol-1
OH(g) → H(g) + O(g) ΔH2 = 427 kJ mol-1
எனவே, நீர்மூலக்கூறில் உள்ள O-H பிணைப்புகளின் பிணைப்பு ஆற்றல்களின் சராசரி மதிப்பு = 502+427/2 = 464.5 kJ mol-1
அட்டவணை 10.4 சில பொதுவான பிணைப்புகளுக்கான பிணைப்பு நீளம் மற்றும் பிணைப்பு ஆற்றல்:
5. உடனிசைவு
சில நேர்வுகளில், ஒரு மூலக்கூறிற்கு ஒன்றிற்கும் மேற்ப்பட்ட சாத்தியமான லூயிஸ் வடிவமைப்புகளை வரைய இயலும் எடுத்துக்காட்டாக, கார்பனேட் அயனியின் (CO32-). லூயிஸ் வடிவமைப்புகளைக் கருதுவோம்.
கார்பனேட் அயனியின் அணு அமைவு அமைப்பு (ஆக்சிஜன் அணுக்கள் OA , OB மற்றும் OC என குறிப்பிடப்பட்டுள்ளன.)
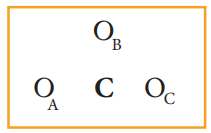
இணைதிற எலக்ட்ரான்களின் மொத்த எண்ணிக்கை = [1 × 4 (கார்பன்)]
+ [3 × 6(ஆக்ஸிஜன்)] + [2 (எதிர் மின்சுமை)] = 24 எலக்ட்ரான்கள்.
இந்த இணைதிறன் எலக்ட்ரான்களைப் பங்கீடு செய்வதால் பின்வரும் அமைப்பு கிடைக்கப் பெறுகிறது.
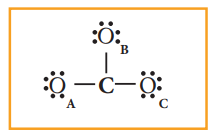
கார்பன் எட்டு எலக்ட்ரான்களைப் பெறும் வகையில் ஒரு ஆக்சிஜன் அணுவிலிருந்து (OA) ஒரு தனித்த எலக்ட்ரான் இரட்டையினை இடம் பெயரச் செய்து அவற்றிற்கிடையே கூடுதல் பிணைப்பை உருவாக்குக. படத்தில் காட்டியுள்ளவாறு வலது மேல்புறத்தில் மின்சுமை (2-) ஐ குறித்துக்காட்டுக
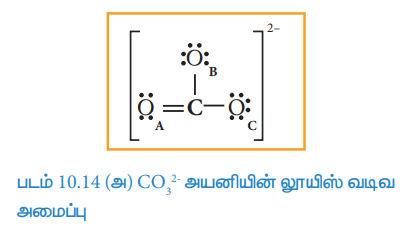
படம் 10.14 (அ) CO2-3 அயனியின் லூயிஸ் வடிவ அமைப்பு
இந்நேர்வில் OA விற்கு பதிலாக மற்ற இரு ஆக்சிஜனில் (OB மற்றும் OC) உள்ள தனித்த இரட்டை எலக்ட்ரான்களை இடம் பெயரச் செய்வதன் மூலமாகவும், மேலும் இரு லூயிஸ் வடிவங்களை நாம் வரைய இயலும்.
எனவே, நாம் (CO2-3) அயனிக்கு கீழ்கண்டவாறு மூன்று ஒத்த லூயிஸ் வடிவமைப்புகளை வரைய இயலும். இவ்வடிவமைப்புகளில் அணுக்களின் ஒப்பீட்டு இட அமைவு மாறுவதில்லை. ஆனால் பிணைப்பின் இட அமைவு மற்றும் தனித்த இரட்டை எலக்ட்ரான்களின் இட அமைவு ஆகியன மட்டுமே மாறுபடுகின்றன. இத்தகைய வடிவமைப்புகள் உடனிசைவு அமைப்புகள் என அழைக்கப்படுகின்றன. மேலும் இந்நிகழ்வு உடனிசைவு எனப்படுகிறது.
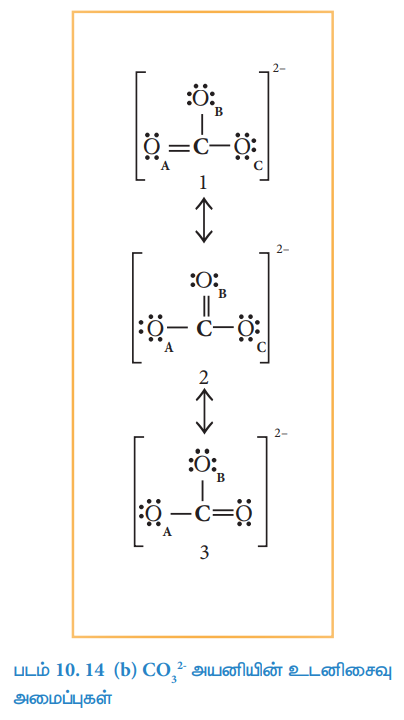
கார்பனேட் அயனியில் உள்ள அனைத்து கார்பன் - ஆக்சிஜன் பிணைப்புகளும் சமமாக உள்ளன என சோதனை முடிவுகளின் அடிப்படையில் அறிய முடிகிறது. எனவே கார்பனேட் அயனியின் உண்மையான அமைப்பு என்பது. மேற்கண்டுள்ள மூன்று உடனிசைவு வடிவமைப்புகளின் சராசரி இனக்கலப்பு உடனிசைவு ஆகும். இந்நேர்வில், கார்பனேட் அயனியானது ஒரு வடிவமைப்பிலிருந்து மற்றொரு வடிவமைப்பிற்கு மாறுவதாக கருதக்கூடாது. கார்பனேட் அயனியை ஒரே ஒரு லூயிஸ் வடிவமைப்பினைக் கொண்டு குறிப்பிட்டுக் காட்ட இயலாது, எனினும் பின்வரும் அமைப்பானது அதன் சரியான வடிவமைப்பு பற்றிய ஒரு கருத்தினைத் தருகிறது.
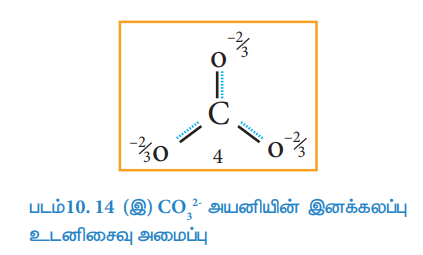
படம்10. 14 (இ) CO2-3 அயனியின் இனக்கலப்பு உடனிசைவு அமைப்பு
இனக்கலப்பு உடனிசைவு அமைப்பின் (வடிவம் 4) ஆற்றலானது மற்ற அனைத்து உடனிசைவு அமைப்புகளின் (வடிவம் 1, 2 மற்றும் 3) ஆற்றலைக் காட்டிலும் குறைவானது. அதிக நிலைப்புத் தன்மையுடைய உடனிசைவு அமைப்பின் (வடிவம் 1 (அ) 2 (அ) 3) ஆற்றலுக்கும் இனக்கலப்பு உடனிசைவு அமைப்பின் ஆற்றலுக்கும் (வடிவம்4) இடையேயான ஆற்றல் வேறுபாடு உடனிசைவு ஆற்றல் என்றழைக்கப்படுகின்றது.
தன்மதிப்பீடு
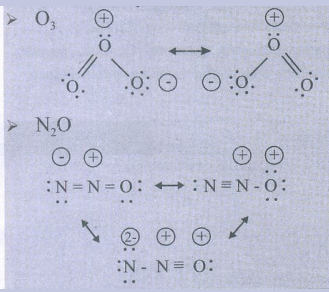
4. i) ஓசோன் மூலக்கூறு
ii) N2O ஆகியவற்றிற்கான உடனிசைவு அமைப்புகளை வரைக.
தீர்வு:
6. பிணைப்புகளின் முனைவுத் தன்மை சகப்பிணைப்பின் பகுதி அயனித் தன்மை:
இரு ஒத்த அணுக்களுக்கிடையே (H2, O2, Cl2 போன்றவற்றில் உள்ளவாறு) சகப்பிணைப்பு உருவாகும் போது இணைந்துள்ள இரண்டு அணுக்களும் பிணைப்பு எலக்ட்ரான் இரட்டையை தங்களை நோக்கி சமஅளவில் ஈர்க்கின்றன. எனவே பங்கிடப்பட்ட பிணைப்பு எலக்ட்ரான் மிகச்சரியாக பிணைக்கப்பட்டுள்ள இரு அணுக்களுக்கு மையத்தில் அமையும். எனினும், மாறுபட்ட எலக்ட்ரான் கவர்தன்மை மதிப்புகளைக் கொண்டுள்ள அணுக்களுக்கு இடையே சகப்பிணைப்பு உருவாகும். நேர்வுகளில், பிணைக்கப்பட்டுள்ள அணுக்களில் அதிக எலக்ட்ரான் கவர்தன்மை கொண்ட அணுவானது மற்றொரு அணுவைக்காட்டிலும் சகப்பிணைப்பு எலக்ட்ரான்களை தனக்கு அருகில் ஈர்க்கும் தன்மையினை அதிகமாகப் பெற்றுள்ளது. இதன் விளைவாக பங்கிடப்பட்ட எலக்ட்ரான் இரட்டையின் திரள் முகில் (cloud of shared electron pair) உருக்குலைகிறது.
ஹைட்ரஜன் புளூரைடில் உள்ள ஹைட்ரஜனுக்கும் புளூரினுக்கும் இடையேயான சகப்பிணைப்பைக் கருதுக. பாலிங் அளவீட்டு முறையில் ஹைட்ரஜன் மற்றும் புளூரினின் எலக்ட்ரான் கவர் தன்மை மதிப்புகள் முறையே 2.1 மற்றும் 4. இதிலிருந்து புளூரினானது, ஹைட்ரஜனைக் காட்டிலும் ஏறத்தாழ இரு மடங்கு கவர்ச்சி விசையுடன் சகப்பிணைப்பு எலக்ட்ரான்களை தன்னை நோக்கி கவரும் தன்மையினைப் பெற்றுள்ளது என அறிய முடிகிறது. இதன் விளைவாக HFல் உள்ள புளூரின் ஆனது பகுதி எதிர்மின் சுமையையும், ஹைட்ரஜன் ஆனது பகுதி நேர்மின் சுமையையும் பெறுகின்றன. எனவே HF பிணைப்பானது முனைவுற்ற சகப்பிணைப்பு என அழைக்கப்படுகிறது. இங்கு, மிகச் சிறிய சமமான எதிர் எதிர் மின்சுமையுடைய மின்சுமைகள் மிகச்சிறு தொலைவில் (91pm) பிரித்து வைக்கப்பட்டுள்ளன. இத்தகைய அமைப்பு இருமுனை (dipole) என அழைக்கப்படுகிறது.
இருமுனை திருப்புத் திறன்:
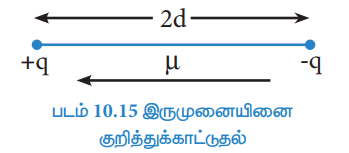
ஒரு சகப்பிணைப்பின் முனைவுத் தன்மையை இருமுனை திருப்புத் திறனின் அடிப்படையில் அளவிட இயலும். இது,
µ = q × 2d
என்று வரையறுக்கப்படுகிறது.
இங்கு µ என்பது இருமுனை திருப்புத் திறனையும், q என்பது மின்சுமை மற்றும் 2d என்பது இரு மின்சுமைகளுக்கு இடையேயானத் தொலைவினையும் குறிப்பிடுகின்றன. இருமுனை திருப்புத் திறனானது ஒரு வெக்டர் அளவீடாகும். இவ்வெக்டரின் திசையானது எதிர்மின் சுமையிலிருந்து நேர்மின்சுமையினை நோக்கி அமையும்
இருமுனை திருப்புத் திறனின் அலகு கூலூம் மீட்டர் (Cm), இது பொதுவாக டிபை அலகில் (D) குறிப்பிடப்படுகிறது. 1டிபை = 3.336 × 10-30 Cm என்ற சமன்பாட்டினைப் பயன்படுத்தி டிபை அலகினை கூலூம் –மீட்டர் அலகிற்கு மாற்றலாம்.
H2,O2, F2, போன்ற ஈரணு மூலக்கூறுகள் பூஜ்ய இருமுனைதிருப்புத் திறனைப் பெற்றுள்ளன. மேலும் இவைகள் முனைவற்ற மூலக்கூறுகள் (non polar molecules) எனப்படுகின்றன. HF, HCl, CO, NO போன்ற மூலக்கூறுகள் பூஜ்யமற்ற இருமுனை திருப்புத்திறன் மதிப்புகளைப் பெற்றுள்ளன. இத்தகைய மூலக்கூறுகள் முனைவுற்ற மூலக்கூறுகள் (Polar Molecules) என அழைக்கப்படுகின்றன.
முனைவுற்ற பிணைப்புகளைப் பெற்றுள்ள மூலக்கூறுகள் அனைத்தும் இருமுனை திருப்புத் திறன்களைப் பெற்றிருப்பதற்கான அவசியமில்லை எடுத்துக்காட்டாக நேர்கோட்டு வடிவமைப்பைப் பெற்றுள்ள கார்பன்-டை-ஆக்ஸைடானது இரண்டு முனைவுற்ற (Cδ+ Oδ-) பிணைப்புகளைப் பெற்றிருந்த போதிலும், அதன் இருமுனை திருப்புத் திறன் பூஜ்ஜியமாகும். நேர்கோட்டு CO2ல் இரு முனைவுற்ற (CO) பிணைப்பு சம மதிப்புடைய எதிரெதிர் திசையிலான இருமுனை திருப்புத்திறன்களைப் பெற்றுள்ளன. எனவே CO2 ன் இருமுனை திருப்புத் திறனின் நிகர மதிப்பு பூஜ்யமாகும்
µ = µ1 + µ2 = µ1 + (-µ1) = 0
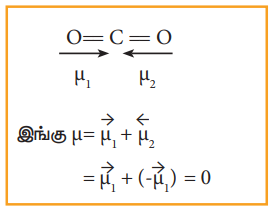
நீர் மூலக்கூறை பொறுத்த வரையில், நிகர இருமுனை திருப்புத்திறன் என்பது µ1, µ2 ஆகியவற்றின் வெக்டர் கூடுதலாகும். இவை கீழே காட்டப்பட்டுள்ளது,
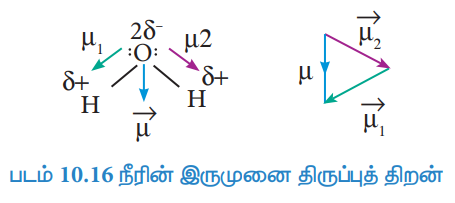
நீரின் இருமுனை திருப்புத் திறனின் மதிப்பு 1.85D
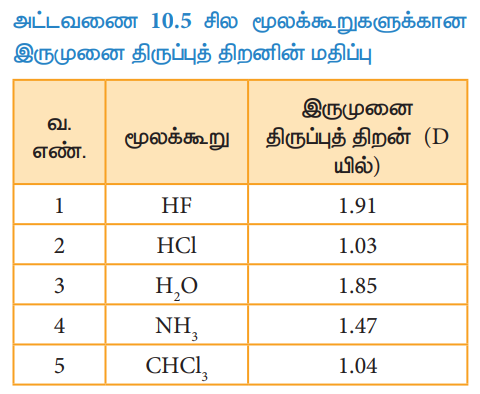
அட்டவணை 10.5 சில மூலக்கூறுகளுக்கான இருமுனை திருப்புத் திறனின் மதிப்பு
ஒரு சகப்பிணைப்பில் எந்த அளவிற்கு அயனித்தன்மை காணப்படுகிறது. என்பதனை இணைக்கப்பட்டுள்ள இரு அணுக்களுக்கிடையேயான எலக்ட்ரான் கவர் தன்மை வேறுபாடோடு தொடர்புபடுத்த இயலும்.
Aδ-Bδ+ என்ற முனைவுற்ற மூலக்கூறினைக் கருதுவோம். இம்மூலக்கூறிலுள்ள அணுக்களின் எலக்ட்ரான் கவர் தன்மை வேறுபாடு (XA – XB ) ஆனது
i) 1.7க்குச் சமம் எனில் பிணைப்பு A-Bயானது 50% அயனித் தன்மையைப் பெற்றுள்ளது.
ii) 1.7ஐ விட அதிகமாக இருந்தால், பிணைப்பு A-Bயானது 50%க்கும் அதிகமான அயனித் தன்மையைப் பெற்றிருக்கும்,
iii) 1.7ஐ விடக் குறைவு எனில், பிணைப்பு A - B. யானது 50% க்கும் குறைவாக அயனித் தன்மையைப் பெற்றிருக்கும்.
தன்மதிப்பீடு
5. OCS மற்றும் CS2 ஆகிய இரு மூலக்கூறுகளில் எம்மூலக்கூறு அதிக இருமுனை திருப்புத் திறனைப் பெற்றிருக்கும்? ஏன்?
தீர்வு:
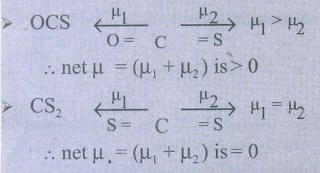
எனவே, OCS அதிக இருமுனைத் திருப்புத் திறன் பெற்றிருக்கும்
அயனிப் பிணைப்பில் பகுதி சகப்பிணைப்புத் தன்மை:
சகப்பிணைப்பு சேர்மங்களில் பகுதி அயனித் தன்மை காணப்படுவது போன்று, அயனிச் சேர்மங்களும் பகுதி சகப்பிணைப்புத் தன்மையினைப் பெற்றுள்ளன. எடுத்துக்காட்டாக அயனிச் சேர்மமான லித்தியம் குளோரைடானது சகப்பிணைப்புத் தன்மையினை பெற்றிருப்பதால் எத்தனால் போன்ற கரிமக் கரைப்பான்களில் கரைகிறது.
அயனிச் சேர்மங்களில் காணப்படும். பகுதி சகப்பிணைப்புக் தன்மையினை முனைவுறுதல் (polarisation) என்ற நிகழ்வின் மூலம் விளக்கலாம். அயனிச் சேர்மங்களில் நேர் அயனிக்கும், எதிர் அயனிக்கும் இடையில் நிலை மின்னியியல் கவர்ச்சி விசை காணப்படுகிறது என்பதை நாம் அறிவோம். நேர் மின்சுமை உடைய நேர் அயனியானது எதிர் அயனியின் இணைதிறன் எலக்ட்ரான்களைக் கவருகிறது. அதே நேரத்தில் அதன் அணுக்கருவினை விலக்குகிறது. இதன் விளைவாக எதிர் அயனியின் எலக்ட்ரான் திரள் முகில் உருக்குலைவுறுகிறது. மேலும், எலக்ட்ரான் அடர்த்தியானது நேர்மின் அயனியை நோக்கி நகர்கிறது. இதன் விளைவாக இவ்விரு அயனிகளுக்கிடையே இனைதிற எலக்ட்ரான்களின் பங்கீடு சிறிதளவு ஏற்படுகிறது. எனவே அவைகளுக்கிடையே பகுதி சகப்பிணைப்புத் தன்மை ஏற்படுகிறது. இந்நிகழ்வு முனைவுறுதல் எனப்படும்.
ஒரு எதிர் அயனியை முனைவுறச் செய்யும் ஒரு நேர் அயனியின் திறன் அதன் முனைவுறுத்தும் திறன் (polarising ability) எனப்படும். மேலும் எதிர் அயனியின் முனைவுறும் தன்மை அதன் முனைவுறும் திறன் (polarisibility) எனப்படும்.
ஒரு அயனிச் சேர்மத்தில் எந்த அளவிற்கு முனைவுறுதல் நிகழ்கிறது என்பதனை பெஜான்ஸ் விதி மூலம் அறியலாம்
பெஜான்ஸ் விதிகள்
அதிக சகப்பிணைப்புத் தன்மையினை பெற்றிருக்க வேண்டுமெனில் நேர்அயனி மற்றும் எதிர் அயனி ஆகிய இரண்டின் மின்சுமைகளும் அதிகமாக இருக்க வேண்டும். நேர்அயனியின் மீதுள்ள மின்சுமை அதிகமாக இருப்பின், எதிர் அயனியின் எலக்ட்ரான் திரள்முகிலின் மீது செலுத்தும் கவர்ச்சி விசையும் அதிகமாக இருக்கும். இதைப் போலவே எதிர் அயனியின் மீதுள்ள எதிர் மின்சுமையின் எண்மதிப்பு அதிகம் எனில் அதன் முனைவுறும் திறன் அதிகம். எனவே, நேர் அயனி அல்லது எதிர் அயனியின் மின்சுமை அதிகமாக இருப்பின் சகப்பிணைப்புத் தன்மை அதிகரிக்கும்.
அலுமினியம் குளோரைடு, மெக்னீசியம் குளோரைடு மற்றும் சோடியம் குளோரைடு ஆகிய மூன்று வகை அயனிச் சேர்மங்களை நாம் கருதுவோம். நேர் அயனிகள் மீதுள்ள மின்சுமை Na+ < Mg2+ < Al3+ என்ற வரிசையில் அதிகரிப்பதால் சகப்பிணைப்புத் தன்மையும் NaCl < MgCl2 < AlCl3 என்ற அதே வரிசையில் அதிகரிக்கின்றது.
நேர் அயனியின் உருவளவு சிறியதாகவும், எதிரயனியின் உருவளவு பெரியதாகவும் இருப்பின் முனைவுறுத்தும் திறன் அதிகமாக இருக்கும். மேலும் சகப்பிணைப்புத் தன்மை அதிகமாக அமையும்.
சோடியம் குளோரைடைக் காட்டிலும் லித்தியம் குளோரைடு அதிக சகப்பிணைப்புத் தன்மை உடையது. Na+ அயனியைக் காட்டிலும் Li+ ன் உருவளவு சிறியது. எனவே Li+ன் முனைவுறுத்தும் திறன் அதிகம். லித்தியம் குளோரைடைக் காட்டிலும் லித்தியம் அயோடைடு அதிக சகப்பிணைப்புத் தன்மை உடையது. ஏனெனில் Cl- ஐக் காட்டிலும் I-ன் உருவளவு பெரியது. எனவே Li+ நேர் அயனியால், Cl- ஐக் காட்டிலும் I- அயனியானது அதிகமாக முனைவுறுகின்றது.
iii. ns2 np6 nd10 எலக்ட்ரான் அமைப்பினைப் பெற்றுள்ள நேர் அயனிகள் ns2 np6 எலக்ட்ரான் அமைப்பினைப் பெற்றுள்ள நேர்அயனிகளைக் காட்டிலும் அதிக முனைவுறுத்தும் திறனைப் பெற்றுள்ளன, எனவே அதிக சகப்பிணைப்புத் தன்மையினைப் பெற்றுள்ளன.
CuCl ஆனது NaCl ஐக் காட்டிலும் அதிக சகப்பிணைப்புத் தன்மையினைப் பெற்றுள்ளது. Na+ அயனியோடு ஒப்பிடும்போது (1.13Å),Cu+(0.6Å) அயனியானது உருவளவில் சிறியது. மேலும் 3s2 3p6 3d10 எலக்ட்ரான் அமைப்பிணைப் பெற்றுள்ளது.
Cu+ ன் எலக்ட்ரான் அமைப்பு
[Ar] 3d10
Na+ ன் எலக்ட்ரான் அமைப்பு
[He] 2s2, 2p6