11 வது வேதியியல் : அலகு 10 : வேதிப் பிணைப்புகள்
சகப்பிணைப்பைக் குறித்துக் காட்டுதல் - லூயிஸ் வடிவமைப்புகள்
சகப்பிணைப்பைக் குறித்துக் காட்டுதல் - லூயிஸ் வடிவமைப்புகள்
இரு அணுக்களுக்கிடையேயான சகப்பிணைப்பினை உருவகப்படுத்தி குறித்துக்காட்டும் வடிவங்கள் லூயிஸ் வடிவமைப்புகள் எனப்படுகின்றன. இந்த வடிவமைப்பில், இணையும் அணுக்களுக்கிடையே பங்கிடப்பட்ட இணைதிற எலக்ட்ரான்கள் அவ்வணுக்களுக்கிடையே இரட்டை புள்ளிகளாகவும் (சிறு நேர் கோடாகவும்), பங்கிடப்படாத பிணைப்பில் ஈடுபடாத எலக்ட்ரான்கள் அவ்வணுவின் மீது தனித்த இரட்டைகளாகவும் குறிப்பிடப்படுகின்றன.
கொடுக்கப்பட்ட ஒரு சேர்மத்திற்கு, லூயிஸ் வடிவமைப்பினை பின்வரும் படிநிலைகளைப் பின்பற்றி எழுத முடியும். நீர் மூலக்கூறிற்கு லூயிஸ் வடிவமைப்பை எழுதுவதன் மூலம் இப்படிநிலைகளை நாம் புரிந்து கொள்வோம்.
1. மூலக்கூறில் உள்ள அணுக்களின் அமைப்பினை குறித்தல்:
பொதுவாக, குறைந்த எலக்ட்ரான் கவர்தன்மை உடைய அணுவானது மையத்தில் குறிக்கப்பட வேண்டும். ஹைட்ரஜன் மற்றும் புளூரின் அணுக்கள் வடிவமைப்பின் இறுதி முனைப்பகுதியில் குறிக்கப்பட வேண்டும். நீர் மூலக்கூறுக்கான அணுக்களின் அமைவு வடிவமைப்பு பின்வருமாறு

2. ஒரு மூலக்கூறில் உள்ள அனைத்து அணுக்களின் இணைதிற எலக்ட்ரான்களின் மொத்த எண்ணிக்கையினைக் கணக்கிடுதல்:
பல அணுக்களைக் கொண்ட அயனிகளைப் பொறுத்த வகையில், இணைதிற எலக்ட்ரான்களைக் கணக்கிடும் போது அயனியின் மின்சுமையினையும் கருத்திற்கொள்ள வேண்டும். எதிரயனிகளைப் பொறுத்தவரையில், இணைதிற எலக்ட்ரான்களின் எண்ணிக்கையுடன் எதிரயனியின் மின்சுமை எண்ணிக்கையும் சேர்த்துக் கொள்ள வேண்டும். நேர் அயனிகளைப் பொறுத்த வரையில், ஒட்டு மொத்த இணைதிற எலக்ட்ரான்களின் எண்ணிக்கையிலிருந்து நேர் அயனியின் மின்சுமை கழிக்கப்பட வேண்டும்.
நீர் மூலக்கூறில், ஒட்டு மொத்த எலக்ட்ரான்கள் = [2×1 (ஹைட்ரஜனின் இணைதிற எலக்ட்ரான்)] + (1 × 6(ஆக்சிஜனின் இணைதிற எலக்ட்ரான்கள்)]
= 2 + 6 = 8.
3. மூலக்கூறின் அணு அமைவு அமைப்பில், அணுக்களுக்கிடையே ஒற்றைப் பிணைப்பை வரைதல்:
ஒவ்வொரு பிணைப்பும், இரு இணைதிற எலக்ட்ரான்களைக் (ஒரு பிணைப்பு இரட்டை) குறிப்பிடுகின்றது. நீர் மூலக்கூறில் நான்கு இணைதிற எலக்ட்ரான்களுக்கு பின்வருமாறு இரு பிணைப்புகளை நாம் வரைய முடியும்.
H ---------- O ---------- H
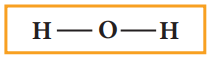
4. மீதமுள்ள இணைதிற எலக்ட்ரான்களை இரட்டைகளாக (தனித்த இரட்டை) மூலக்கூறில் உள்ள அனைத்து அணுக்களும் எட்டு எலக்ட்ரான்களைப் (ஹைட்ரஜனைப் பொறுத்த வரையில் இரட்டை எலக்ட்ரான்) பெறும் வகையில் பங்கிடுதல்.
முதலில் அதிக எலக்ட்ரான்கவர் தன்மை கொண்ட அணுவில் தொடங்கி பின்னர் அதனைத் தொடர்ந்து மற்ற அணுக்களுக்கு தனித்த எலக்ட்ரான் இரட்டை பங்கிடப்படுதல் வேண்டும்.
நீர் மூலக்கூறில், மீதமுள்ள நான்கு எலக்ட்ரான்களும் அதிக எலக்ட்ரான் கவர் தன்மை உடைய மைய ஆக்சிஜன் மீது இரு தனித்த இரட்டைகளாக குறிக்கப்படுகிறது, ஆக்சிஜன் எட்டு எலக்ட்ரான்களைப் பெறுகிறது.
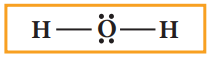
5. அனைத்து அணுக்களும் எட்டு எலக்ட்ரான் விதியினை நிறைவு (H அணுவிற்கு இரட்டை எலக்ட்ரான்) செய்கின்றனவா என சரிபார்த்தல். நிறைவு செய்யவில்லை எனில், தனித்த இரட்டை எலக்ட்ரான்களைப் பயன்படுத்தி அணுக்களுக்கிடையே கூடுதல் பிணைப்புகளை உருவாக்குவதன் மூலம் எட்டு எலக்ட்ரான் விதியினை நிறைவு செய்ய வேண்டும்.
நீர் மூலக்கூறைப் பொறுத்த வரையில், மேற்கண்டுள்ள அமைப்பில், ஆக்சிஜன் எட்டு எலக்ட்ரான்களையும், ஹைட்ரஜன் இரு எலக்ட்ரான்களையும் பெற்று இருப்பதால், தனித்த இரட்டையைப் பயன்படுத்தி கூடுதல் பிணைப்பினை உருவாக்க வேண்டிய நிலை எழவில்லை. எனவே நீரின் லூயிஸ் அமைப்பு
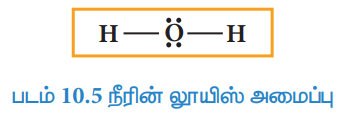
நைட்ரிக் அமிலத்திற்கான லூயிஸ் அமைப்பினை நாம் வரைவோம்.
1. அணுக்களின் அமைவு அமைப்பு

2. HNO3 ல் உள்ள ஒட்டு மொத்த இணைதிற எலக்ட்ரான்கள் = [1 (ஹைட்ரஜன்) × 1] + [1 (நைட்ரஜன்) × 5) + (3(ஆக்சிஜன்) × 6] = 1+5+18=24
3. அணுக்களுக்கிடையே ஒற்றைப் பிணைப்பினை வரைக. HNO3 -க்கு படத்தில் காட்டியுள்ளவாறு நான்கு பிணைப்புகளை வரைய இயலும் இது எட்டு எலக்ட்ரான்களால் (4 பிணைப்பு இரட்டை) உருவாக்கப்பட்டதாகும்.
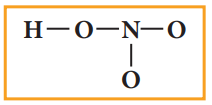
4. மீதமுள்ள 16 எலக்ட்ரான்களை (24 – 8 = 16) அதிக எலக்ட்ரான் கவர் தன்மையுடைய ஆக்சிஜன் அணுவிலிருந்து துவங்கி ஒவ்வொரு அணுவும் எட்டு எலக்ட்ரான்களைப் பெறும் வகையில் பங்கீடு செய்ய வேண்டும். வடிவமைப்பின் முனைப் பகுதியில் உள்ள ஒவ்வொரு ஆக்சிஜன் மீதும் தலா மூன்று ஜோடி தனித்த எலக்ட்ரான்கள் என மொத்தம் ஆறு தனித்த ஜோடி எலக்ட்ரான்கள், எட்டு எலக்ட்ரான் விதியை நிறைவு செய்யும் வகையில் பங்கிடப்படுகின்றது. மீதமுள்ள இரு தனித்த இரட்டைகளை ஹைட்ரஜனோடு இணைக்கப்பட்டுள்ள, ஆக்சிஜன் மீது பங்கிடுவதன் மூலம் அது எட்டு எலக்ட்ரானைப் பெறும்.
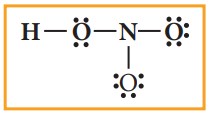
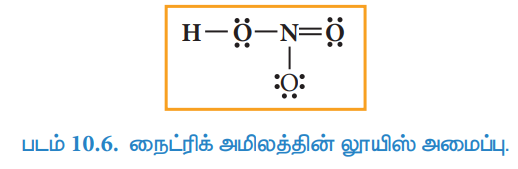
5. அனைத்து அணுக்களும் எட்டு எலக்ட்ரான் அமைப்பினைப் பெற்றுள்ளதா என்பதை சரிபார்க்க வேண்டும். மேற்கண்டுள்ள பங்கீட்டில், நைட்ரஜனானது எட்டு எலக்ட்ரான்களைப்பெற ஒரு இரட்டை குறைவாக உள்ளது. எனவே வடிவமைப்பில் இறுதியில் உள்ள ஆக்சிஜனிலிருந்து ஒரு தனித்த இரட்டையினை பயன்படுத்தி அந்த ஆக்சிஜனுக்கும், நைட்ரஜனுக்கும் இடையே மற்றுமொரு பிணைப்பினை உருவாக்குக. நைட்ரிக் அமிலத்தின் லூயிஸ் வடிவமைப்பானது
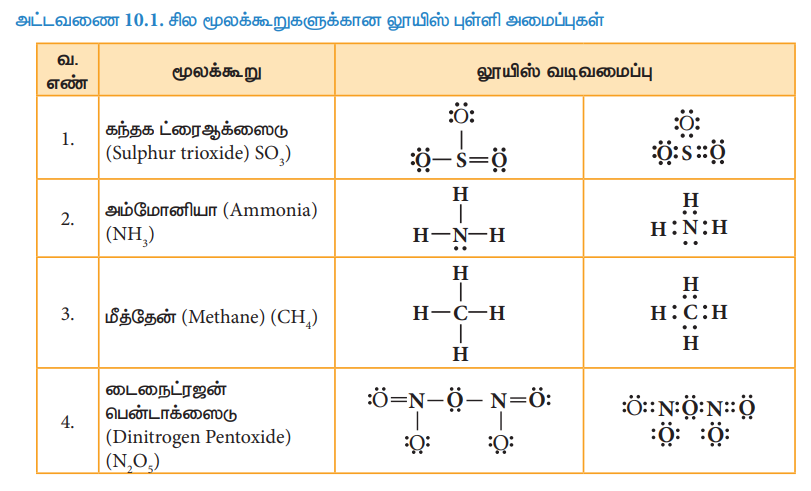
அட்டவணை 10.1. சில மூலக்கூறுகளுக்கான லூயிஸ் புள்ளி அமைப்புகள்
குறிப்பு:
சில தனிமங்கள் அவற்றின் பெரும்பாலான சேர்மங்களில் குறிப்பிட்ட எண்ணிக்கை உடைய பிணைப்புகளை உருவாக்குகின்றன என்பது குறிப்பிடத்தக்கது. எடுத்துக்காட்டாக புளூரின் ஒரே ஒரு பிணைப்பை மட்டும் ஏற்படுத்துகிறது. ஹைட்ரஜன், ஆக்சிஜன், நைட்ரஜன் மற்றும் கார்பன் ஆகியன முறையே ஒன்று, இரண்டு, மூன்று மற்றும் நான்கு பிணைப்புகளை உருவாக்குகின்றன.