வேதிப் பிணைப்புகள் - இணைதிற பிணைப்புக் கொள்கை (valence bond theory) | 11th Chemistry : UNIT 10 : Chemical bonding
11 வது வேதியியல் : அலகு 10 : வேதிப் பிணைப்புகள்
இணைதிற பிணைப்புக் கொள்கை (valence bond theory)
இணைதிற பிணைப்புக் கொள்கை (valence bond theory)
ஹைய்ட்லர் மற்றும் லண்டன் ஆகிய அறிவியல் அறிஞர்கள் ஹைட்ரஜன் மூலக்கூறில் சகப்பிணைப்பு உருவாதலை, எலக்ட்ரானின் அலை இயக்கவியலை அடிப்படையாகக் கொண்டு கருத்தியலாக விளக்கினார்கள். இக்கருத்துக்கள் பாலிங் மற்றும் ஸ்லேட்டர் ஆகியோர்களால் மேலும் மேம்படுத்தப்பட்டது. இணைதிறன் பிணைப்புக் கொள்கையினை (VB கொள்கை) அலை இயக்கவியல் கோட்பாடுகளின் அடிப்படையில் விளக்கவது இப்பாடப்பகுதியின் நோக்கத்திற்கு அப்பாற்பட்டது. ஹைட்ரஜன் மூலக்கூறு உருவாவதலுக்கு, VB கொள்கையின் அடிப்படையில் அமைப்பு ஒரு எளிய, பண்புகள் அடிப்படையிலான விளக்கம் பின்வருமாறு
இரு ஹைட்ரஜன் அணுக்கள் (Ha மற்றும் Hb ஆகியன) முடிவில்லாத தொலைவில் பிரித்து வைக்கப்பட்டிருக்கும் ஒருநிலையினைக் (படம் 10.17ஆ- நிலை 1 ) கருத்திற்கொள்க. இந்நிலையில் அவ்விரு ஹைட்ரஜன் அணுக்களுக்கிடையே எவ்வித இடையீடுகளும் இல்லை. மேலும் இந்த அமைப்பின் நிலை ஆற்றல் பூஜ்யம் என தன்னிச்சையாக எடுத்துக்கொள்ளப்படுகிறது. இவ்விரு ஹைட்ரஜன் அணுக்களும் ஒன்றை ஒன்று நெருங்கும் பொழுது, ஒவ்வொரு அணுவின் அணுக்கருக்களுக்கும், அவற்றினுடைய எலக்ட்ரான்களுக்கும் இடையேயான கவர்ச்சி விசை (ஊதா நிற அம்புக் குறியால் காட்டப்பட்டுள்ளது) யுடன் பின்வரும் புதியவிசைகளும் செயல்பட துவங்குகின்றன.
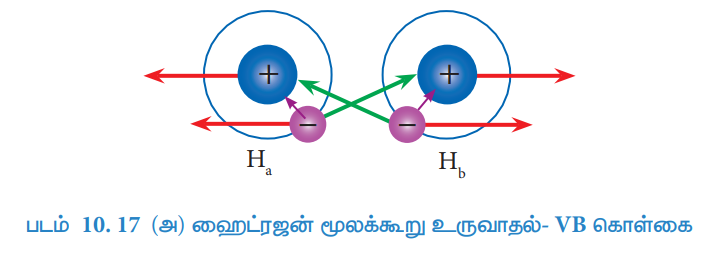
புதிய கவர்ச்சி விசைகள் (பச்சை நிற அம்புக்குறி)
1. Ha ன் அணுக்கருவிற்கும், Hb ன் இணைதிற எலக்ட்ரானுக்கும் இடையே உருவாகிறது.
2. Hb ன் அணுக்கருவிற்கும், Ha ன் இணைதிற எலக்ட்ரானுக்கும் இடையே உருவாகிறது. புதிய விலக்கு விசைகள் (சிவப்பு நிற அம்புக்குறி)
i. Ha மற்றும் Hb ஆகியவற்றின் அணுக்கருக்களுக்கிடையே உருவாகிறது.
ii. Ha மற்றும் Hb ஆகிய இணைதிறன் எலக்ட்ரான்களுக்கு இடையே உருவாகிறது.
கவர்ச்சி விசையின் காரணமாக Ha மற்றும் Hb ஆகியன ஒன்றோடொன்று நெருங்குகின்றன (படம் 10.17ஆ- நிலை 2). ஆனால் அதே நேரத்தில் விலக்குவிசைகள் அவைகளை விலகலடையுமாறுச் செய்கின்றன. ஆரம்ப நிலையில், இரு ஹைட்ரஜன் அணுக்களும் ஒன்றோடொன்று நெருங்கும்போது, விலக்குவிசையினைக் காட்டிலும், கவர்ச்சி விசைகள் அதிக வலிமையுடையதாக உள்ளன. மேலும் நிலை ஆற்றல் குறைந்துக் கொண்டே வருகின்றது. ஒரு குறிப்பிட்ட நிலையை அடைந்ததும் நிகர கவர்ச்சி விசையானது விலக்கு விசைகளுக்குச் சரி சமமாகிறது. இந்நிலையில் (படம் 10.17ஆ- நிலை 3) அமைப்பானது, மிகக் குறைந்த நிலை ஆற்றலைப் பெற்றிருக்கும்.
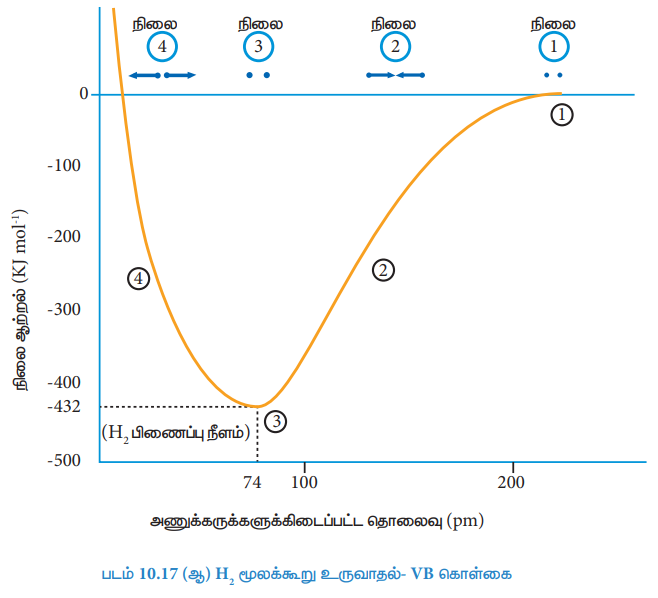
படம் 10.17 (ஆ) H2 மூலக்கூறு உருவாதல்- VB கொள்கை
இந்நிலையில் ஹைட்ரஜன் அணுக்களின் (Ha மற்றும் Hb) அணு ஆர்பிட்டால்களுக்கிடையே அதிகபட்ச மேற்பொருந்துதல் நிகழ்கிறது. மேலும் அவைகள் ஒன்றோடொன்று சகப்பிணைப்பால் பிணைக்கப்பட்டுள்ளன. எனப்படுகின்றது. இந்நிலையில் அவ்விரு ஹைட்ரஜன் அணுக்கருக்களுக்கிடையேயானத் தொலைவு H-H பிணைப்பு நீளத்தைத் தருகிறது. இதன் மதிப்பு 74pm. இந்நிலையில் வெளியிடப்படும் ஆற்றல் 436 KJ mol-1 ஆகும். மேலும், இவ்வாற்றல் பிணைப்பாற்றல் (bond energy) எனப்படுகிறது.
இந்த பிணைப்பு உருவாதலின்போது, ஆற்றல் வெளியிடப்படுகிறது. எனவே உருவான மூலக்கூறானது அதிக நிலைப்புத்தன்மை உடையது. இவ்விரு அணுக்களுக்கு இடையேயான தொலைவினை மேலும் குறைக்கும் பொழுது கவர்ச்சி விசையினைக் காட்டிலும் விலக்குவிசையானது அதிகரிப்பதால் அமைப்பின் நிலையாற்றல் அதிகரிக்கிறது[படம் 10.17ஆ-நிலை 4)
1. VB கொள்கையின் முக்கிய அம்சங்கள்:
i. இரு அணுக்களின் சரிபாதி அளவு நிரப்பப்பட்ட ஆர்பிட்டால்கள் ஒன்றோடொன்று மேற்பொருந்தும் பொழுது அவைகளுக்கிடையே சகப்பிணைப்பு உருவாகின்றது.
ii. உருவான மேற்பொருந்திய ஆர்பிட்டாலில் எதிரெதிர் சுழற்ச்சியினைப் பெற்றுள்ள இரு எலக்ட்ரான்கள் இடம்பெறுகின்றன. எடுத்துக்காட்டாக, H2 மூலக்கூறு உருவாகும்போது இரு ஹைட்ரஜன் அணுக்களின் 1s எலக்ட்ரான்களும் எதிர்சுழற்சியுடன் இரட்டை ஆகின்றன. மேலும் அவைகள் மேற்பொருந்திய ஆர்பிட்டாலில் இடம்பெறுகின்றன.
iii. அணு ஆர்பிட்டால்கள் எந்த அளவிற்கு மேற்பொருந்துகின்றனவோ, அதைப் பொருத்து சகப் பிணைப்பின் வலிமை அமைகிறது. மேற்பொருந்துதல் அதிகமாக இருக்கும் போது, வெளியிடப்படும் ஆற்றல் அதிகமாகும், மேலும் உருவாகும் பிணைப்பும் வலிமையுடையதாக இருக்கும்.
iv. ஒவ்வொரு அணு ஆர்பிட்டாலும் குறிப்பிட்ட திசையில் அமைந்துள்ளது (s-ஆர்பிட்டால் மட்டும் சீர்மைக்கோள வடிவம் பெற்றுள்ளது) எனவே, அணு ஆர்பிட்டால்கள் மேற்பொருந்துதலானது, அதிகபட்சமாக மேற்பொருந்துதல் நிகழும் திசையில் நடைபெறுகிறது.
ஹைட்ரஜன், புளூரின் மற்றும் ஹைட்ரஜன் புளுரைடில் சகப்பிணைப்பு உருவாதலை VB கொள்கையினைப் பயன்படுத்தி விளக்கிடுவோம்.