வேதிப் பிணைப்புகள் - ஒத்த இரு அணுக்கள் கொண்ட ஈரணு மூலக்கூறுகளின் பிணைப்பு | 11th Chemistry : UNIT 10 : Chemical bonding
11 வது வேதியியல் : அலகு 10 : வேதிப் பிணைப்புகள்
ஒத்த இரு அணுக்கள் கொண்ட ஈரணு மூலக்கூறுகளின் பிணைப்பு
ஒத்த இரு அணுக்கள் கொண்ட ஈரணு மூலக்கூறுகளின் பிணைப்பு
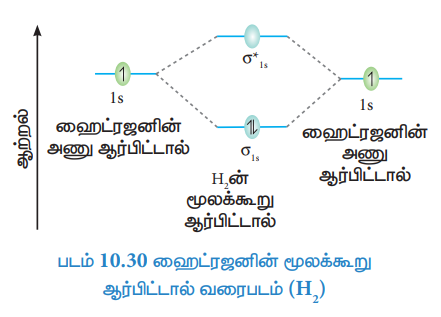
ஹைட்ரஜனின் மூலக்கூறு ஆர்பிட்டால் வரைபடம் (H2)
ஹைட்ரஜன் அணுவின் எலக்ட்ரான் அமைப்பு ls1
ஹைட்ரஜனின் மூலக்கூறின் எலக்ட்ரான் அமைப்பு σ2ls
பிணைப்பு தரம் = Nb – Na / 2 = 2 – 0 / 2 = 1
மூலக்கூறில் தனித்த எலக்ட்ரான்கள் இல்லை எனவே இது டையாகாந்தப் பண்புடையது.
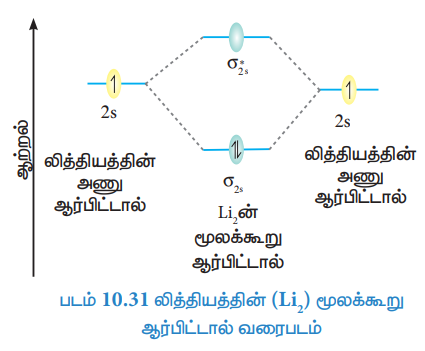
லித்தியத்தின் (Li2) மூலக்கூறு ஆர்பிட்டால் வரைபடம்
லித்தியம் அணுவின் எலக்ட்ரான் அமைப்பு = 1s2, 2s1
லித்தியம் மூலக்கூறின் எலக்ட்ரான் அமைப்பு = σ1s2, σ*1s2, σ2s2
பிணைப்பு தரம் = Nb – Na / 2 = 4 – 2 / 2 = 1
மூலக்கூறில் தனித்த எலக்ட்ரான்கள் இல்லை எனவே இது டையாகாந்தப் பண்புடையது.
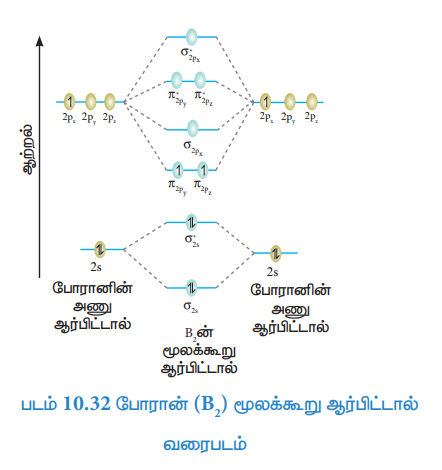
போரான் (B2) மூலக்கூறு ஆர்பிட்டால் வரைபடம்.
போரான் அணுவின் எலக்ட்ரான் அமைப்பு = ls2 2s2 2p1
போரான் மூலக்கூறின் எலக்ட்ரான் அமைப்பு
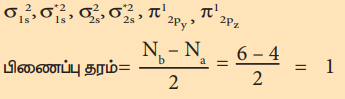
மூலக்கூறில் இரு தனித்த எலக்ட்ரான்கள் உள்ளது எனவே இது பாரா காந்தப் பண்புடையது.
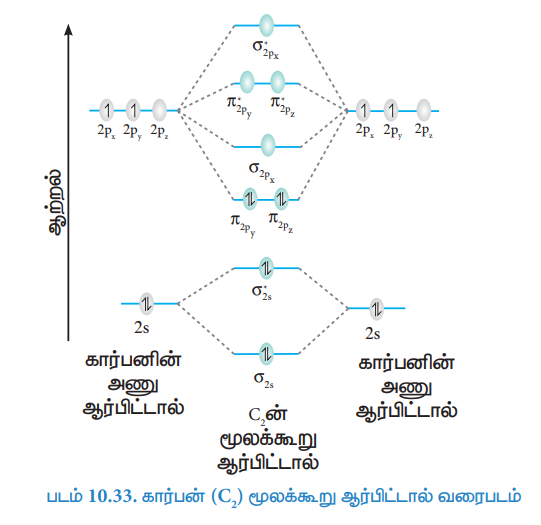
கார்பன் (C2) மூலக்கூறு ஆர்பிட்டால் வரைபடம்
கார்பன் அணுவின் எலக்ட்ரான் அமைப்பு 1s2 2s2 2p2
கார்பன் மூலக்கூறின் எலக்ட்ரான் அமைப்பு
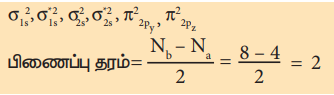
மூலக்கூறில் தனித்த எலக்ட்ரான்கள் இல்லை எனவே இது டையா காந்தப் பண்புடையது.
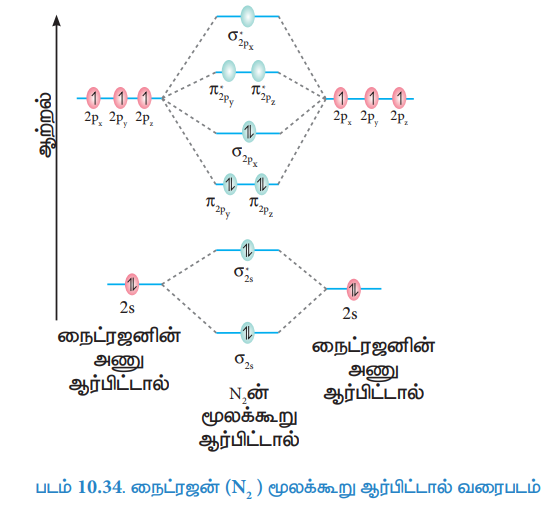
நைட்ரஜன் (N2) மூலக்கூறு ஆர்பிட்டால் வரைபடம்
நைட்ரஜன் அணுவின் எலக்ட்ரான் அமைப்பு 1s2 2s2 2p3
நைட்ரஜன் மூலக்கூறின் எலக்ட்ரான் அமைப்பு
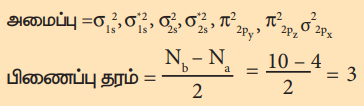
மூலக்கூறில் தனித்த எலக்ட்ரான்கள் இல்லை எனவே இது டையா காந்தப் பண்புடையது.
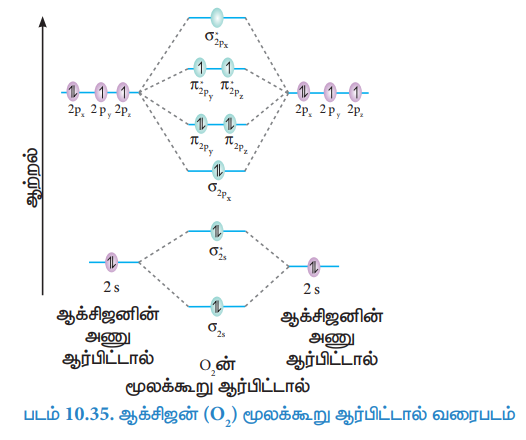
ஆக்சிஜன் (O2) மூலக்கூறு ஆர்பிட்டால் வரைபடம்
ஆக்சிஜன் அணுவின் எலக்ட்ரான் அமைப்பு 1s2 2s2 2p4
ஆக்சிஜன் மூலக்கூறின் எலக்ட்ரான் அமைப்பு (O2)
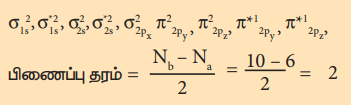
பிணைப்பு தரம் = Nb – Na / 2 = 10 – 6 / 2 = 2
மூலக்கூறில் இரு தனித்த எலக்ட்ரான்கள் உள்ளது எனவே இது பாரா காந்தப் பண்புடையது.