வேதிப் பிணைப்புகள் | வேதியியல் - ஈதல் சகப்பிணைப்பு | 11th Chemistry : UNIT 10 : Chemical bonding
11 வது வேதியியல் : அலகு 10 : வேதிப் பிணைப்புகள்
ஈதல் சகப்பிணைப்பு
ஈதல் சகப்பிணைப்பு
சகப்பிணைப்பு உருவாதலின்போது இணையும் இரண்டு அணுக்கள் தலா ஒவ்வொரு எலக்ட்ரானை வழங்கி, அந்த எலக்ட்ரான்களை தங்களுக்குள் சமமாகப் பங்கிட்டுக் கொள்கின்றன. சில பிணைப்பு உருவாக்கத்தின் போது, சகப்பிணைப்பு உருவாவதற்குத் தேவையான இரு எலக்ட்ரான்களையும் இணையும் இரு அணுக்களில் ஒரு அணுவே வழங்குகிறது. மேலும் அவ்வணு வழங்கும் இரு எலக்ட்ரான்கள் இணையும் மற்றொரு அணுவுடன் சமமாகப் பங்கிடப்படுகிறது. இத்தகைய பிணைப்புகள் ஈதல் சகப்பிணைப்பு என அழைக்கப்படுகின்றன. எலக்ட்ரான் இரட்டையை பிணைப்பிற்கு வழங்கும் அணு வழங்கி (donar) அணு எனவும் ஏற்கும் மற்றொரு அணு ஏற்பி அணு எனவும் அழைக்கப்படுகின்றன. வழங்கி அணுவிலிருந்து ஏற்பி அணுவை நோக்கிய ஒரு அம்புக் குறியால் இப்பிணைப்பு குறித்துக்காட்டப்படுகின்றது. (அணைவுச் சேர்மங்கள் பற்றி நாம் பின்னர் கற்கும்போது வழங்கி அணுவை ஈனி எனவும், ஏற்பி அணுவை மைய உலோக அணு/அயனி எனவும் அழைப்போம்).
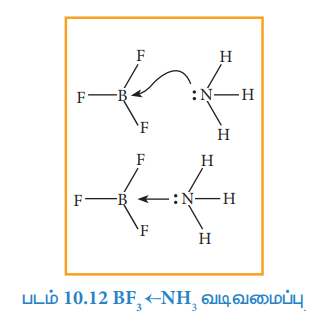
எடுத்துக்காட்டாக, பெர்ரோசயனைடு [Fe(CN)6]4- அயனியில் ஒவ்வொரு சயனைடு அயனியும் (CN-) ஒரு எலக்ட்ரான் இரட்டையினை இரும்பு (II) ற்கு வழங்கி (Fe2+) உடன் ஈதல் சகப்பிணைப்பினை ஏற்படுத்துகின்றன. மேலும் இந்த எலக்ட்ரான்கள் Fe2+ மற்றும் CN- அயனிகளுக்கிடையே சமமாக பங்கிடப் படுகின்றன.
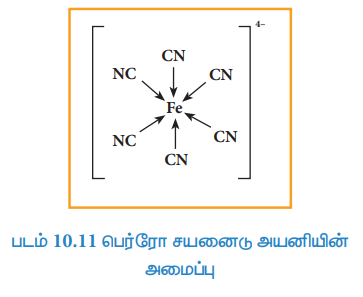
சில நேர்வுகளில், அம்மோனியா போன்ற தனித்த இரட்டை எலக்ட்ரான்களைப் பெற்றுள்ள மூலக்கூறுகள் தங்களிடம் உள்ள எலக்ட்ரான் இரட்டையினை எலக்ட்ரான் பற்றாக்குறை உள்ள BF3 போன்ற மூலக்கூறுகளுக்கு வழங்கி ஈதல் சகப்பிணைப்பினை உருவாக்குகின்றன.