11 வது வேதியியல் : அலகு 10 : வேதிப் பிணைப்புகள்
எட்டு எலக்ட்ரான் விதிக்கு விதிவிலக்காக அமையும் லூயிஸ் அமைப்புகள்
எட்டு எலக்ட்ரான் விதிக்கு விதிவிலக்காக அமையும் லூயிஸ் அமைப்புகள்
எட்டு எலக்ட்ரான் விதியானது, இரண்டாம் வரிசைத் தனிமங்களை மைய அணுவாகக் கொண்டுள்ள மூலக் கூறுகளுக்கான லூயிஸ் அமைப்புகளை எழுதுவதற்கு பயன்படுகிறது. சில சேர்மங்களில், மைய அணுவானது எட்டு எலக்ட்ரான்களை விட கூடுதலாகவோ அல்லது குறைவான எண்ணிக்கையிலோ எலக்ட்ரான்களைப் பெற்றுள்ளன. எட்டு எலக்ட்ரான் விதிக்கு விதிவிலக்காக அமைந்துள்ள நேர்வுகளை பின்வருமாறு மூன்று வகைகளாக வகைப்படுத்தலாம்.
1. எலக்ட்ரான் பற்றாக்குறைவாக உள்ள மைய அணுவைக் கொண்டுள்ள மூலக்கூறுகள்.
2. ஒற்றை எலக்ட்ரான்களைக் கொண்டுள்ள மூலக்கூறுகள்,
3. இணைதிற கூட்டினை விரிவாக்கும் தன்மையுடைய மூலக்கூறுகள்.
எலக்ட்ரான் குறை மைய அணுவைப் பெற்றுள்ள மூலக்கூறுகள்
போரான் ட்ரை புளூரைடை நாம் எடுத்துக்காட்டாகக் கருதுவோம். மைய போரான் அணுவானது மூன்று இணைதிற எலக்ட்ரான்களைக் கொண்டுள்ளது. மேலும் ஒவ்வொரு புளூரின் அணுவும் ஏழு இணைதிற எலக்ட்ரான்களைப் பெற்றுள்ளன. லூயிஸ் வடிவமைப்பானது,
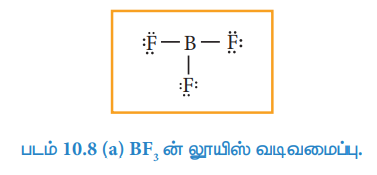
படம் 10.8 (a) BF3ன் லூயிஸ் வடிவமைப்பு.
மேற்கண்டுள்ள வடிவமைப்பில், போரான் அணுவினைச் சுற்றி ஆறு எலக்ட்ரான்கள் மட்டுமே உள்ளன. புளூரினில் உள்ள ஒரு தனித்த இரட்டை மூலம் போரானிற்கும், புளூரினிற்கும் இடையே கூடுதலாக ஒரு பிணைப்பை பின்வருமாறு ஏற்படுத்துக.
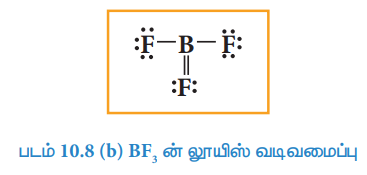
படம் 10.8 (b) BF3 ன் லூயிஸ் வடிவமைப்பு
எனினும், மேற்கண்டுள்ள அமைப்பில் அதிக எலக்ட்ரான்கவர் தன்மையுடைய புளூரினின் முறைசார் மின்சுமையானது நேர்மின்சுமையாக இருப்பதால் இவ்வடிமைப்பு ஏற்கத்தக்கதல்ல. எனவே மைய போரான் எட்டு எலக்ட்ரான்களை நிறைவாக பெறாமல் உள்ள லூயிஸ் வடிவமைப்பே (படம் 10.8.(a)) சாத்தியமான ஒன்றாகும். BCl3, BeCl2, போன்ற மூலக்கூறுகளிலும் நிறைவடையா எட்டு எலக்ட்ரான் அமைப்பு காணப்படுகிறது.
ஒற்றை எண்ணிக்கையில் எலக்ட்ரான்களைக் கொண்டுள்ள மூலக்கூறுகள்
சில மூலக்கூறுகளில், மைய அணுவானது, ஒற்றைப்படை எண்ணிக்கையில் இணைதிற எலக்ட்ரான்களைப் பெற்றுள்ளன. எடுத்துக் காட்டாக, நைட்ரஜன் டை ஆக்ஸைடு மற்றும் நைட்ரிக் ஆக்ஸைடுகளில் அனைத்து அணுக்களும் முழுமையான எட்டு எலக்ட்ரான் அமைப்பை பெற்றிருப்பதில்லை. அம் மூலக்கூறுகளின் லூயிஸ் வடிவமைப்புகள் பின்வருமாறு.

படம் 10.9 நைட்ரிக் ஆக்ஸைடு மற்றும் நைட்ரஜன் டை ஆக்ஸைடின் லூயிஸ் வடிவமைப்புகள் (முறைசார் மின் சுமையுடன்)
இணைதிறன் கூட்டினை விரிவாக்கும் தன்மை பெற்றுள்ள மூலக்கூறுகள்
கந்தக ஹெக்ஸா புளுரைடு (SF6), பாஸ்பரஸ் பென்டா குளோரைடு (PCl5) போன்ற மூலக்கூறுகளில், மைய அணுவானது, அவற்றைச் சுற்றி எட்டு எலக்ட்ரான்களை விட அதிக எண்ணிக்கையில் எலக்ட்ரான்களைப் பெற்றுள்ளன. இம்மூலக்கூறில் கூடுதல் எலக்ட்ரான் இரட்டைகள் இடம் பெறுவதற்கு மைய அணுவின் காலியான வெளி d ஆர்பிட்டால்கள் பயன்படுகின்றன.
SF6ல் மையத்தில் உள்ள கந்தக அணுவினைச் சுற்றி ஆறு எலக்ட்ரான் இரட்டைகள் (12 எலக்ட்ரான்கள்) அமைந்துள்ளன.
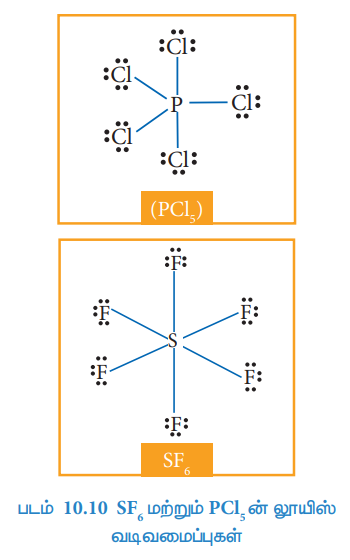
படம் 10.10 SF6 மற்றும் PCl5 ன் லூயிஸ் வடிவமைப்புகள்