வேதிப் பிணைப்புகள் - பிணைப்புகளின் முனைவுத் தன்மை சகப்பிணைப்பின் பகுதி அயனித் தன்மை | 11th Chemistry : UNIT 10 : Chemical bonding
11 வது வேதியியல் : அலகு 10 : வேதிப் பிணைப்புகள்
பிணைப்புகளின் முனைவுத் தன்மை சகப்பிணைப்பின் பகுதி அயனித் தன்மை
பிணைப்புகளின் முனைவுத் தன்மை சகப்பிணைப்பின் பகுதி அயனித் தன்மை:
இரு ஒத்த அணுக்களுக்கிடையே (H2, O2, Cl2 போன்றவற்றில் உள்ளவாறு) சகப்பிணைப்பு உருவாகும் போது இணைந்துள்ள இரண்டு அணுக்களும் பிணைப்பு எலக்ட்ரான் இரட்டையை தங்களை நோக்கி சமஅளவில் ஈர்க்கின்றன. எனவே பங்கிடப்பட்ட பிணைப்பு எலக்ட்ரான் மிகச்சரியாக பிணைக்கப்பட்டுள்ள இரு அணுக்களுக்கு மையத்தில் அமையும். எனினும், மாறுபட்ட எலக்ட்ரான் கவர்தன்மை மதிப்புகளைக் கொண்டுள்ள அணுக்களுக்கு இடையே சகப்பிணைப்பு உருவாகும். நேர்வுகளில், பிணைக்கப்பட்டுள்ள அணுக்களில் அதிக எலக்ட்ரான் கவர்தன்மை கொண்ட அணுவானது மற்றொரு அணுவைக்காட்டிலும் சகப்பிணைப்பு எலக்ட்ரான்களை தனக்கு அருகில் ஈர்க்கும் தன்மையினை அதிகமாகப் பெற்றுள்ளது. இதன் விளைவாக பங்கிடப்பட்ட எலக்ட்ரான் இரட்டையின் திரள் முகில் (cloud of shared electron pair) உருக்குலைகிறது.
ஹைட்ரஜன் புளூரைடில் உள்ள ஹைட்ரஜனுக்கும் புளூரினுக்கும் இடையேயான சகப்பிணைப்பைக் கருதுக. பாலிங் அளவீட்டு முறையில் ஹைட்ரஜன் மற்றும் புளூரினின் எலக்ட்ரான் கவர் தன்மை மதிப்புகள் முறையே 2.1 மற்றும் 4. இதிலிருந்து புளூரினானது, ஹைட்ரஜனைக் காட்டிலும் ஏறத்தாழ இரு மடங்கு கவர்ச்சி விசையுடன் சகப்பிணைப்பு எலக்ட்ரான்களை தன்னை நோக்கி கவரும் தன்மையினைப் பெற்றுள்ளது என அறிய முடிகிறது. இதன் விளைவாக HFல் உள்ள புளூரின் ஆனது பகுதி எதிர்மின் சுமையையும், ஹைட்ரஜன் ஆனது பகுதி நேர்மின் சுமையையும் பெறுகின்றன. எனவே HF பிணைப்பானது முனைவுற்ற சகப்பிணைப்பு என அழைக்கப்படுகிறது. இங்கு, மிகச் சிறிய சமமான எதிர் எதிர் மின்சுமையுடைய மின்சுமைகள் மிகச்சிறு தொலைவில் (91pm) பிரித்து வைக்கப்பட்டுள்ளன. இத்தகைய அமைப்பு இருமுனை (dipole) என அழைக்கப்படுகிறது.
இருமுனை திருப்புத் திறன்:
ஒரு சகப்பிணைப்பின் முனைவுத் தன்மையை இருமுனை திருப்புத் திறனின் அடிப்படையில் அளவிட இயலும். இது,
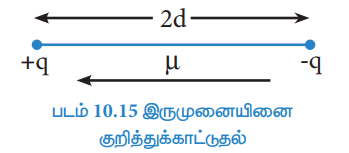
µ = q × 2d
என்று வரையறுக்கப்படுகிறது.
இங்கு µ என்பது இருமுனை திருப்புத் திறனையும், q என்பது மின்சுமை மற்றும் 2d என்பது இரு மின்சுமைகளுக்கு இடையேயானத் தொலைவினையும் குறிப்பிடுகின்றன. இருமுனை திருப்புத் திறனானது ஒரு வெக்டர் அளவீடாகும். இவ்வெக்டரின் திசையானது எதிர்மின் சுமையிலிருந்து நேர்மின்சுமையினை நோக்கி அமையும்
இருமுனை திருப்புத் திறனின் அலகு கூலூம் மீட்டர் (Cm), இது பொதுவாக டிபை அலகில் (D) குறிப்பிடப்படுகிறது. 1டிபை = 3.336 × 10-30 Cm என்ற சமன்பாட்டினைப் பயன்படுத்தி டிபை அலகினை கூலூம் –மீட்டர் அலகிற்கு மாற்றலாம்.
H2,O2, F2, போன்ற ஈரணு மூலக்கூறுகள் பூஜ்ய இருமுனைதிருப்புத் திறனைப் பெற்றுள்ளன. மேலும் இவைகள் முனைவற்ற மூலக்கூறுகள் (non polar molecules) எனப்படுகின்றன. HF, HCl, CO, NO போன்ற மூலக்கூறுகள் பூஜ்யமற்ற இருமுனை திருப்புத்திறன் மதிப்புகளைப் பெற்றுள்ளன. இத்தகைய மூலக்கூறுகள் முனைவுற்ற மூலக்கூறுகள் (Polar Molecules) என அழைக்கப்படுகின்றன.
முனைவுற்ற பிணைப்புகளைப் பெற்றுள்ள மூலக்கூறுகள் அனைத்தும் இருமுனை திருப்புத் திறன்களைப் பெற்றிருப்பதற்கான அவசியமில்லை எடுத்துக்காட்டாக நேர்கோட்டு வடிவமைப்பைப் பெற்றுள்ள கார்பன்-டை-ஆக்ஸைடானது இரண்டு முனைவுற்ற (Cδ+ Oδ-) பிணைப்புகளைப் பெற்றிருந்த போதிலும், அதன் இருமுனை திருப்புத் திறன் பூஜ்ஜியமாகும். நேர்கோட்டு CO2ல் இரு முனைவுற்ற (CO) பிணைப்பு சம மதிப்புடைய எதிரெதிர் திசையிலான இருமுனை திருப்புத்திறன்களைப் பெற்றுள்ளன. எனவே CO2 ன் இருமுனை திருப்புத் திறனின் நிகர மதிப்பு பூஜ்யமாகும்
µ = µ1 + µ2 = µ1 + (-µ1) = 0
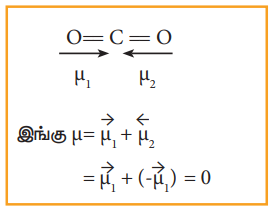
நீர் மூலக்கூறை பொறுத்த வரையில், நிகர இருமுனை திருப்புத்திறன் என்பது µ1, µ2 ஆகியவற்றின் வெக்டர் கூடுதலாகும். இவை கீழே காட்டப்பட்டுள்ளது,
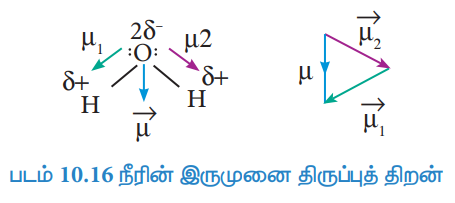
நீரின் இருமுனை திருப்புத் திறனின் மதிப்பு 1.85D
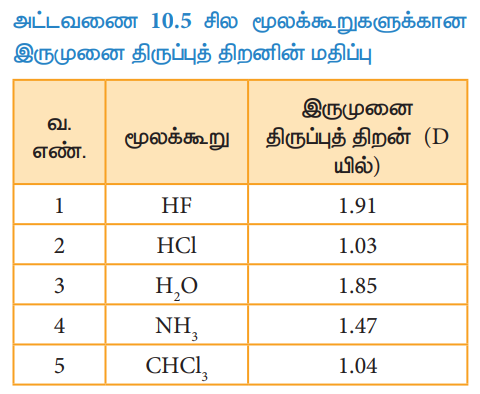
அட்டவணை 10.5 சில மூலக்கூறுகளுக்கான இருமுனை திருப்புத் திறனின் மதிப்பு
ஒரு சகப்பிணைப்பில் எந்த அளவிற்கு அயனித்தன்மை காணப்படுகிறது. என்பதனை இணைக்கப்பட்டுள்ள இரு அணுக்களுக்கிடையேயான எலக்ட்ரான் கவர் தன்மை வேறுபாடோடு தொடர்புபடுத்த இயலும்.
Aδ-Bδ+ என்ற முனைவுற்ற மூலக்கூறினைக் கருதுவோம். இம்மூலக்கூறிலுள்ள அணுக்களின் எலக்ட்ரான் கவர் தன்மை வேறுபாடு (XA – XB ) ஆனது
i) 1.7க்குச் சமம் எனில் பிணைப்பு A-Bயானது 50% அயனித் தன்மையைப் பெற்றுள்ளது.
ii) 1.7ஐ விட அதிகமாக இருந்தால், பிணைப்பு A-Bயானது 50%க்கும் அதிகமான அயனித் தன்மையைப் பெற்றிருக்கும்,
iii) 1.7ஐ விடக் குறைவு எனில், பிணைப்பு A - B. யானது 50% க்கும் குறைவாக அயனித் தன்மையைப் பெற்றிருக்கும்.