வேதிப் பிணைப்புகள் - H2 மூலக்கூறு உருவாதல் | 11th Chemistry : UNIT 10 : Chemical bonding
11 வது வேதியியல் : அலகு 10 : வேதிப் பிணைப்புகள்
H2 மூலக்கூறு உருவாதல்
H2 மூலக்கூறு உருவாதல்
ஹைட்ரஜன் அணுவின் எலக்ட்ரான் அமைப்பு ls1
ஹைட்ரஜன் மூலக்கூறு உருவாகும் போது, ஒற்றை எலக்ட்ரானைக் கொண்டுள்ள இரு ஹைட்ரஜன் அணுக்களின், ls ஆர்பிட்டால்களும் அவ்விரு அணுக்களுக்கிடையேயான அச்சின் வழியே மேற்பொருந்துகின்றன. இந்த மேற்பொருந்துதல் s-s மேற்பொருந்துதல் எனப்படும். இத்தகைய அச்சுவழி ஆர்பிட்டால் மேற்பொருந்துதுல் காரணமாக சிக்மா (σ) பிணைப்பு உருவாகிறது.
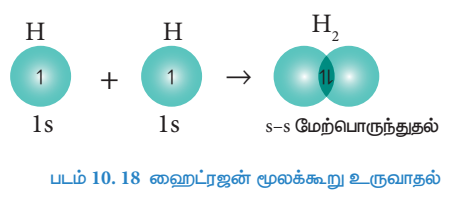
படம் 10.18 ஹைட்ரஜன் மூலக்கூறு உருவாதல்
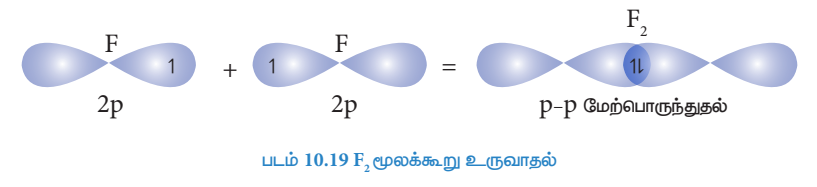
F2 மூலக்கூறு உருவாதல்:
புளூரின் அணுவின் இணைதிற கூட்டின் எலக்ட்ரான் அமைப்பு : 2S2 2px2, 2py2, 2pz1
இரு புளூரின் அணுக்களின், சரிபாதி நிரப்பப்பட்ட Pz , ஆர்பிட்டால்கள் z-அச்சின் வழியே ஒன்றோடொன்று மேற்பொருந்தும் போது, அவைகளுக்கிடையே ‘σ’ சகப்பிணைப்பு உருவாகிறது.
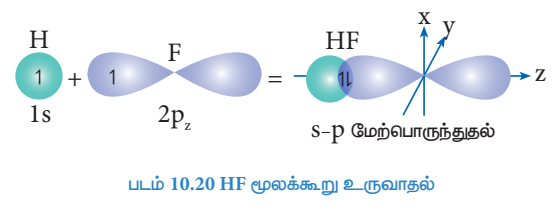
HF மூலக்கூறு உருவாதல்:
ஹைட்ரஜன் அணுவின் எலக்ட்ரான் அமைப்பு ls1
புளூரின் அணுவின் இணைதிற கூட்டின் எலக்டரான் அமைப்பு : 2S2 2px2, 2py2, 2pz1
ஹைட்ரஜனின் சரிபாதி நிரப்பப்பட்ட 1s ஆர்பிட்டாலானது, புளூரினின் பாதி நிரப்பப்பட்ட 2Pz ஆர்பிட்டாலுடன் நேர்கோட்டில் மேற்பொருந்தும் போது ஹைட்ரஜனுக்கும் புளூரினுக்கும் இடையே ஒரு σ-சகப்பிணைப்பு உருவாகிறது.
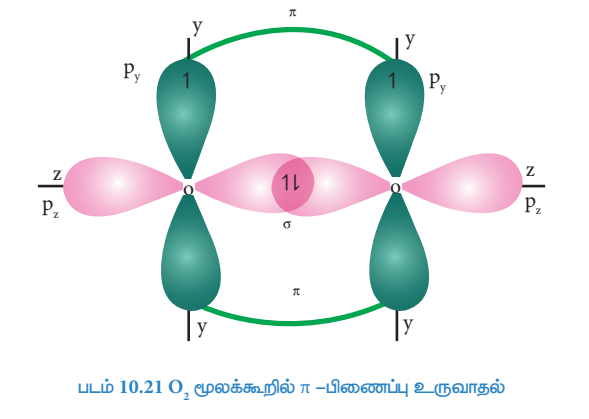
O2 மூலக்கூறு உருவாதல் (O2):
ஆக்சிஜன் அணுவின் இணைதிற கூட்டின் எலக்ட்ரான் அமைப்பு : 2S2 2px2, 2py1, 2pz1
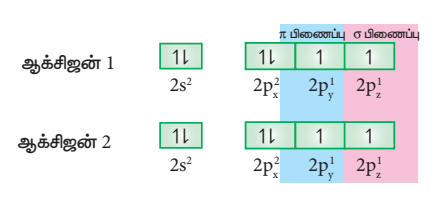
இரு ஆக்சிஜன் அணுக்களின் சரிபாதியளவு நிரப்பட்பட்ட Pz ஆர்பிட்டால்களும் z-அச்சின் வழியாக நேர்கோட்டில் மேற்பொருந்தும் போது (இந்நேர்வில் z-அச்சினை மூலக்கூறு அச்சாகக் கருதுக) அவைகளுக்கிடையே σ-சகப்பிணைப்பு உருவாகிறது. மற்ற இரு ஆக்சிஜன்களின் சரிபாதியளவு நிரப்பப்பட்ட இரண்டு Py-ஆர்பிட்டால்களும் பக்கவாட்டில் மேற்பொருந்துவதால் அவைகளுக்கிடையே π-சகப்பிணைப்பு உருவாகிறது. எனவே ஆக்சிஜன் மூலக்கூறில், இரு ஆக்சிஜன் அணுக்களும் இரட்டை சகப்பிணைப்பால் பிணைக்கப்பட்டுள்ளன. 2s மற்றும் 2px, ஆர்பிட்டால்களில் காணப்படும் மற்ற இரு தனித்த எலக்ட்ரான் இரட்டைகளும் பிணைப்பில் ஈடுபடுவதில்லை. மேலும், அவைகள் தொடர்புடைய ஆக்சிஜன் அணுக்களிலேயே தனித்த எலக்ட்ரான் இரட்டைகளாக உள்ளன.