11 வது வேதியியல் : அலகு 10 : வேதிப் பிணைப்புகள்
வேதிப்பிணைப்பு பற்றிய கோசல் - லூயிசின் அணுகுமுறை
வேதிப்பிணைப்பு பற்றிய கோசல் - லூயிசின் அணுகுமுறை
1916ல் வேதிப்பிணைப்பு பற்றிய தர்க்க ரீதியான அணுகு முறையானது கோசல் மற்றும் லூயிஸ் ஆகிய அறிவியல் அறிஞர்களால் முன்மொழியப்பட்டது. மந்த வாயுக்கள் பிற அணுக்களுடன் வினைபுரியாத அல்லது அரிதாக வினைபுரியும் தன்மையைப் பெற்று மந்தத் தன்மையுடன் இருப்பதன் அடிப்படையில் வேதிப்பிணைப்பு உருவாதலை இவ்வறிவியல் அறிஞர்கள் அணுகினார்கள்.
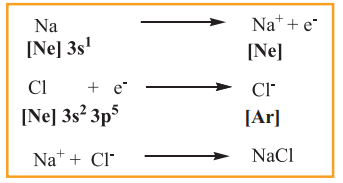
முழுவதுமாக நிரப்பப்பட்ட வெளிக்கூட்டு எலக்ட்ரான் அமைப்பினை மந்த வாயுக்கள் பெற்றிருப்பதால் அவைகள் அதிக நிலைப்புத் தன்மையினைப் பெற்றுள்ளன என இவர்கள் முன்மொழிந்தனர். மந்த வாயுக்களைத் தவிர்த்த பிற தனிமங்கள் தங்கள் வெளிக்கூட்டில் உள்ள ஒன்று அல்லது அதற்கு மேற்பட்ட எலக்ட்ரான்களை இழத்தல், ஏற்றுக்கொள்ளுதல் அல்லது பங்கிடுதல் ஆகியவற்றின் மூலம் நிலைப்புத் தன்மையை பெற முயல்கின்றன. எடுத்துக்காட்டாக, NaCl உருவாதலில் சோடியம் ஒரு எலக்ட்ரானை இழப்பதன் மூலம் Na+ அயனி உருவாகிறது. அது இழக்கும் எலக்ட்ரானை குளோரின் ஏற்றுக் கொண்டு Cl- அயனி உருவாகிறது. இதன் விளைவாக இரண்டு அணுக்களும் தங்களுக்கு அருகே உள்ள மந்த வாயுக்களின் நிலையான எலக்ட்ரான் அமைப்பினைப் பெறுகின்றன.
இவ்வாறு உருவான Na+ மற்றும் Cl- அயனிகளுக்கிடையேயான மின் நிலையியல் கவர்ச்சிவிசையின் காரணமாக இவ்வயனிகள் பிணைக்கப்பட்டுள்ளன மேலும் இந்த கவர்ச்சி விசையானது வேதிப்பிணைப்பு என அழைக்கப்படுகிறது குறிப்பாக அயனிப்பிணைப்பு எனப்படுகிறது.
நைட்ரஜன், ஆக்சிஜன் போன்ற ஈரணு மூலக்கூறுகளில், அவற்றின் அணுக்களுக்கிடையே எலக்ட்ரான்களைப் பங்கிட்டுக்கொள்வதன் மூலமாக நிலையான எலக்ட்ரான் அமைப்பு உருவாகிறது என்ற கருத்தினை G. N. லூயிஸ் முன்மொழிந்தார், அணுக்களுக்கிடையேயான வேதிப்பிணைப்பு மற்றும் இணைந்துள்ள அணுக்களின் வெளிக்கூட்டில் காணப்படும் எலக்ட்ரான்களை குறிப்பிட்டுக்காட்ட ஒரு எளிய முறையினை அவர் அறிமுகப்படுத்தினார். அம்முறை லூயிஸ் புள்ளி வடிவமைப்பு என அழைக்கப்படுகிறது. இம் முறையில் ஒரு அணுவின் எழுத்து வடிவ குறியீட்டினைச் சுற்றி அவற்றின் இணைதிறன் எலக்ட்ரான்கள் சிறிய புள்ளிகள் மூலம் குறித்துக்காட்டப்படுகிறது. முதல் நான்கு எலக்ட்ரான்கள் அணு குறியீட்டின் நான்கு புறமும் நான்கு புள்ளிகளாகக் குறிக்கப்படுகின்றது. ஐந்தாவது எலக்ட்ரானிலிருந்து, எலக்ட்ரான்கள் இரட்டைகளாக குறிப்பிடப்படுகின்றன. எடுத்துக்காட்டாக நைட்ரஜனின் எலக்ட்ரான் அமைப்பு 1s2, 2s2, 2p3. இது ஐந்து இணைதிற எலக்ட்ரான்களை வெளிக்கூட்டில் பெற்றுள்ளது. இதன் லூயிஸ் வடிவமைப்பு பின்வருமாறு

படம் 10.1. நைட்ரஜனின் லூயிஸ் வடிவமைப்பு
இதைப்போலவே, கார்பன் மற்றும் ஆக்சிஜனின் லூயிஸ் வடிவமைப்பினை பின்வருமாறு எழுத முடியும்.

படம் 10.2. C மற்றும் Oன் லூயிஸ் வடிவமைப்புகள்
விதிவிலக்காக, இரண்டே லைக்ட்ரான்களை இணைதிற கூட்டில் பெற்றுள்ள ஹீலியத்தில் உள்ள இரு எலக்ட்ரான்கள், ஒரு இரட்டையாகக் குறிப்பிடப்படுகின்றது.

படம் 10.3. He அணுவின் லூயிஸ் வடிவமைப்பு
எண்ம விதி:
வேதிப்பிணைப்பு பற்றிய கோசல் - லூயிஸ் அணுகுமுறையானது எண்மவிதி உருவாக காரணமாக அமைந்தது. ஒரு வேதிப் பிணைப்பில் ஈடுபடும் அனைத்து அணுக்களும் தங்களது இணைதிற வெளிக்கூட்டில் 8 எலக்ட்ரான்களைப் பெறும் வகையில் தங்களுக்குள் எலக்ட்ரான்களை பரிமாற்றம் அல்லது பங்கீடு செய்து கொள்கின்றன.