11 வது வேதியியல் : அலகு 10 : வேதிப் பிணைப்புகள்
வேதிப் பிணைப்புகள்: அறிமுகம்
அலகு 10
வேதிப் பிணைப்புகள்


லீனஸ் கார்ல் பௌலிங்
லீனஸ் கார்ல் பௌலிங் ஒரு அமெரிக்க வேதியியலாளர், உயிர் வேதியியல் அறிஞர், அமைதிக்கான செயற்பாட்டாளர், எழுத்தாளர், கல்வியாளர் என பன்முகத்தன்மை கொண்டவர். வேதியியல் பாடத்தோடு மட்டும் அல்லாமல் பல்வேறு உயிரியல் அறிஞர்களுடனும் பணியாற்றியுள்ளார். வேதிப் பிணைப்புகளின் இயல்பு மற்றும் சிக்கலான சேர்மங்களுக்கான வடிவமைப்பினை வருவித்தலில் அவற்றின் பயன்பாடு பற்றிய ஆய்விற்காக 1954 ஆம் ஆண்டிற்கான வேதியியலுக்கான நோபல் பரிசு இவருக்கு வழங்கப்பட்டது.
கற்றலின் நோக்கங்கள்
இப்பாடப் பகுதியைக் கற்றறிந்த பின்னர் மாணவர்கள்,
● வேதிப் பிணைப்பினைப் பற்றிய கோசல் மற்றும் லூயிஸின் அணுகுமுறையினை விவரித்தல்.
● எண்ம விதியினை விளக்குதல்.
● எளியமூலக்கூறுகளுக்கான லூயிஸ் வடிவமைப்புகளை வரைதல்
● பல்வேறு வகை பிணைப்பு உருவாதல் மற்றும் பிணைப்பு அளவீட்டுக் காரணிகளை விவரித்தல்.
● எளிய மூலக்கூறுகளுக்கான உடனிசைவு அமைப்புகளை வரைதல்,
● எலக்ட்ரான் கவர்தன்மை பற்றிய கோட்பாட்டினைப் பயன்படுத்தி சகப் பிணைப்பின் முனைவுத்தன்மையை விளக்குதல்,
● VSEPR கொள்கையை விவரித்தல் மற்றும் எளிய மூலக்கூறுகளின் வடிவமைப்புகளைத் தீர்மானித்தல்.
● சகப்பிணைப்பு உருவாதலுக்கான இணைதிறன் பிணைப்புக் கொள்கையை விளக்குதல்.
● s,p மற்றும் d ஆர்பிட்டால்களின் பல்வேறு இனக்கலப்பாதலை விளக்குதல் மற்றும் எளிய சகப்பிணைப்பு மூலக்கூறுகளின் வடிவங்களை வரைதல்.
● மூலக்கூறு ஆர்பிட்டால் கொள்கையினை விளக்குதல் பிணைப்புத்தரத்தை கணக்கிடுதல் மற்றும் H2, O2, N2, CO மற்றும் NO ஆகிய மூலக்கூறுகளின் காந்தப் பண்புகளை விளக்குதல்.
● உலோகப் பிணைப்பினைச் சுருக்கமாக விளக்குதல்.
ஆகிய திறன்களைப் பெறலாம்.
பாட அறிமுகம்
வைரம் கடினத்தன்மை உடையது அதே நேரத்தில் அதன் மற்றொரு புறவேற்றுமை வடிவமான கிராபைட் மிக மென்மையானது. ஹைட்ரஜன், மற்றும் ஆக்சிஜன் ஆகியன ஈரணு மூலக்கூறுகளாகும் ஆனால் மந்த வாயுக்கள் ஓரணு வாயுக்களாக உள்ளன. கார்பன், குளோரினுடன் இணைந்து திரவ நிலையில் உள்ள நீருடன் கலக்காத கார்பன் டெட்ராகுளோரைடை தருகிறது. சோடியம், குளோரினுடன் இணைந்து கடினமானதும், படிக நிலையில் உள்ளதும், நீரில் எளிதில் கரையும் தன்மையுடையதுமான சோடியம் குளோரைடைத் தருகிறது.
மேற்கண்டுள்ள பண்புகளுக்கு அம்மூலக்கூறுகளில் காணப்படும் அணுக்களுக்கு இடையேயான இடையீட்டின் தன்மையே அடிப்படையாக அமைகின்றன. மேலும் இந்த இடையீடுகளே மூலக்கூறுகளில் உள்ள அணுக்கள் / அயனிகளை பிணைத்து வைத்திருக்க காரணமாகவும் அமைகின்றன. ஒரு மூலக்கூறில் உள்ள அணுக்கள் / அயனிகளை பிணைத்து வைத்திருக்க காரணமான அணுக்களுக்கிடையேயான கவர்ச்சி விசையே வேதிப்பிணைப்பு எனப்படுகிறது.
அணுக்கள் ஒரு குறிப்பிட்ட விகிதத்தில் மட்டுமே இணைந்து மூலக்கூறுகளை உருவாக்குகின்றன ஏன்? எடுத்துக்காட்டாக ஆக்சிஜன், ஹைட்ரஜனுடன் இணைந்து நீரைத் தருகிறது (H2O) மேலும் கார்பனுடன் இணையும் போது கார்பன்டை ஆக்ஸைடைத் (CO2) தருகிறது. நீர் மூலக்கூறு ‘V’ வடிவத்தைப் பெற்றுள்ளது. ஆனால் CO2 நேர்கோட்டு வடிவமைப்பை பெற்றுள்ளது. மேற்கண்டுள்ளவை போன்ற வினாக்களுக்கு விடையளிக்க வேதிப் பிணைப்பினைப் பற்றிய கொள்கைகள் பயன்படுகின்றன. பல ஆண்டுகளாக மேம்படுத்தப்பட்டு, வேதிப் பிணைப்பினை விளக்குவதற்காக பயன்படுத்தப்பட்டு வரும் பல்வேறுகொள்கைகள் மற்றும் கோட்பாடுகளைப் பற்றி இப்பாடப்பகுதியில் கற்போம்.
1. வேதிப்பிணைப்பு பற்றிய கோசல் - லூயிசின் அணுகுமுறை
1916ல் வேதிப்பிணைப்பு பற்றிய தர்க்க ரீதியான அணுகு முறையானது கோசல் மற்றும் லூயிஸ் ஆகிய அறிவியல் அறிஞர்களால் முன்மொழியப்பட்டது. மந்த வாயுக்கள் பிற அணுக்களுடன் வினைபுரியாத அல்லது அரிதாக வினைபுரியும் தன்மையைப் பெற்று மந்தத் தன்மையுடன் இருப்பதன் அடிப்படையில் வேதிப்பிணைப்பு உருவாதலை இவ்வறிவியல் அறிஞர்கள் அணுகினார்கள்.
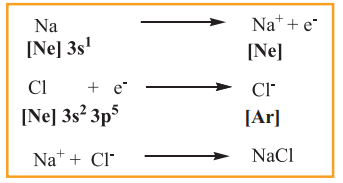
முழுவதுமாக நிரப்பப்பட்ட வெளிக்கூட்டு எலக்ட்ரான் அமைப்பினை மந்த வாயுக்கள் பெற்றிருப்பதால் அவைகள் அதிக நிலைப்புத் தன்மையினைப் பெற்றுள்ளன என இவர்கள் முன்மொழிந்தனர். மந்த வாயுக்களைத் தவிர்த்த பிற தனிமங்கள் தங்கள் வெளிக்கூட்டில் உள்ள ஒன்று அல்லது அதற்கு மேற்பட்ட எலக்ட்ரான்களை இழத்தல், ஏற்றுக்கொள்ளுதல் அல்லது பங்கிடுதல் ஆகியவற்றின் மூலம் நிலைப்புத் தன்மையை பெற முயல்கின்றன. எடுத்துக்காட்டாக, NaCl உருவாதலில் சோடியம் ஒரு எலக்ட்ரானை இழப்பதன் மூலம் Na+ அயனி உருவாகிறது. அது இழக்கும் எலக்ட்ரானை குளோரின் ஏற்றுக் கொண்டு Cl- அயனி உருவாகிறது. இதன் விளைவாக இரண்டு அணுக்களும் தங்களுக்கு அருகே உள்ள மந்த வாயுக்களின் நிலையான எலக்ட்ரான் அமைப்பினைப் பெறுகின்றன.
இவ்வாறு உருவான Na+ மற்றும் Cl- அயனிகளுக்கிடையேயான மின் நிலையியல் கவர்ச்சிவிசையின் காரணமாக இவ்வயனிகள் பிணைக்கப்பட்டுள்ளன மேலும் இந்த கவர்ச்சி விசையானது வேதிப்பிணைப்பு என அழைக்கப்படுகிறது குறிப்பாக அயனிப்பிணைப்பு எனப்படுகிறது.
நைட்ரஜன், ஆக்சிஜன் போன்ற ஈரணு மூலக்கூறுகளில், அவற்றின் அணுக்களுக்கிடையே எலக்ட்ரான்களைப் பங்கிட்டுக்கொள்வதன் மூலமாக நிலையான எலக்ட்ரான் அமைப்பு உருவாகிறது என்ற கருத்தினை G. N. லூயிஸ் முன்மொழிந்தார், அணுக்களுக்கிடையேயான வேதிப்பிணைப்பு மற்றும் இணைந்துள்ள அணுக்களின் வெளிக்கூட்டில் காணப்படும் எலக்ட்ரான்களை குறிப்பிட்டுக்காட்ட ஒரு எளிய முறையினை அவர் அறிமுகப்படுத்தினார். அம்முறை லூயிஸ் புள்ளி வடிவமைப்பு என அழைக்கப்படுகிறது. இம் முறையில் ஒரு அணுவின் எழுத்து வடிவ குறியீட்டினைச் சுற்றி அவற்றின் இணைதிறன் எலக்ட்ரான்கள் சிறிய புள்ளிகள் மூலம் குறித்துக்காட்டப்படுகிறது. முதல் நான்கு எலக்ட்ரான்கள் அணு குறியீட்டின் நான்கு புறமும் நான்கு புள்ளிகளாகக் குறிக்கப்படுகின்றது. ஐந்தாவது எலக்ட்ரானிலிருந்து, எலக்ட்ரான்கள் இரட்டைகளாக குறிப்பிடப்படுகின்றன. எடுத்துக்காட்டாக நைட்ரஜனின் எலக்ட்ரான் அமைப்பு 1s2, 2s2, 2p3. இது ஐந்து இணைதிற எலக்ட்ரான்களை வெளிக்கூட்டில் பெற்றுள்ளது. இதன் லூயிஸ் வடிவமைப்பு பின்வருமாறு

படம் 10.1. நைட்ரஜனின் லூயிஸ் வடிவமைப்பு
இதைப்போலவே, கார்பன் மற்றும் ஆக்சிஜனின் லூயிஸ் வடிவமைப்பினை பின்வருமாறு எழுத முடியும்.

படம் 10.2. C மற்றும் Oன் லூயிஸ் வடிவமைப்புகள்
விதிவிலக்காக, இரண்டே லைக்ட்ரான்களை இணைதிற கூட்டில் பெற்றுள்ள ஹீலியத்தில் உள்ள இரு எலக்ட்ரான்கள், ஒரு இரட்டையாகக் குறிப்பிடப்படுகின்றது.

படம் 10.3. He அணுவின் லூயிஸ் வடிவமைப்பு
எண்ம விதி:
வேதிப்பிணைப்பு பற்றிய கோசல் - லூயிஸ் அணுகுமுறையானது எண்மவிதி உருவாக காரணமாக அமைந்தது. ஒரு வேதிப் பிணைப்பில் ஈடுபடும் அனைத்து அணுக்களும் தங்களது இணைதிற வெளிக்கூட்டில் 8 எலக்ட்ரான்களைப் பெறும் வகையில் தங்களுக்குள் எலக்ட்ரான்களை பரிமாற்றம் அல்லது பங்கீடு செய்து கொள்கின்றன.