வேதிப் பிணைப்புகள் | வேதியியல் - கார்பன்-டை-ஆக்ஸைடிற்கான லூயிஸ் வடிவமைப்பு | 11th Chemistry : UNIT 10 : Chemical bonding
11 வது வேதியியல் : அலகு 10 : வேதிப் பிணைப்புகள்
கார்பன்-டை-ஆக்ஸைடிற்கான லூயிஸ் வடிவமைப்பு
முறைசார் மின்சுமை (Formal charge):
கார்பன்-டை-ஆக்ஸைடிற்கான லூயிஸ் வடிவமைப்பினை நாம் வரைவோம்.
1. அணு அமைவு அமைப்பு
O C O
2. CO2ல் உள்ள மொத்த இணைதிறன் எலக்ட்ரான்களின் எண்ணிக்கை
= (1 (கார்பன்) × 4) +[2(ஆக்சிஜன்) × 6] = 4 + 12 = 16
3. அணுக்களுக்கிடையே ஒற்றை பிணைப்பை வரைக.
CO2 மூலக்கூறுக்கு பின்வரும் படத்தில் காட்டியுள்ளவாறு இரு ஒற்றை பிணைப்புகளை வரைய முடியும். இப்பிணைப்பு உருவாக (இரண்டு பிணைப்பு இரட்டைகள்) நான்கு எலக்ட்ரான்கள் காரணமாக அமைகின்றன.
O ---- C ---- O
4. மீதமுள்ள பன்னிரெண்டு (16-4=12) எலக்ட்ரான்களை ஆறு தனித்த இரட்டை எலக்ட்ரான்களாக, அதிக எலக்ட்ரான் கவர் தன்மை உடைய ஆக்சிஜனில் துவங்கி பங்கீடு செய்க. முனை இறுதியில் உள்ள இரண்டு ஆக்சிஜன்கள் மீது அவைகள் எட்டு எலக்ட்ரான்களைப் பெறும் வகையில் (ஒவ்வொரு ஆக்சிஜனுக்கும் தலா மூன்று எலக்ட்ரான் இரட்டைகளை) பங்கீடு செய்க.
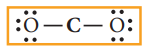
5. அனைத்து அணுக்களும் எட்டு எலக்ட்ரான் அமைப்பினை பெற்றுள்ளனவா என சரிபார்க்க. மேற்கண்டுள்ள பங்கீட்டில், மையத்தில் உள்ள கார்பன் அணு எட்டு எலக்ட்ரான்களைப் பெறுவதற்கு இரண்டு எலக்ட்ரான் இரட்டைகளைக் குறைவாகப் பெற்றுள்ளது. எனவே, எட்டு எலக்ட்ரான் விதியினை நிறைவு செய்யும் பொருட்டு ஒவ்வொரு ஆக்சிஜன் அணுவிலிருந்தும் ஒரு தனித்த இரட்டை எலக்ட்ரானைப் பயன்படுத்தியோ அல்லது ஒரு ஆக்சிஜன் அணுவிலிருந்து இரண்டு எலக்ட்ரான் இரட்டைகளைப் பயன்படுத்தியோ கார்பனுடன் ஒன்றிற்கும் மேற்பட்ட பிணைப்புகளை உருவாக்குவதன் மூலம் பின்வரும் இரு வடிவங்கள் சாத்தியமாகின்றன.

படம் 10.7. (அ) கார்பன்டை ஆக்ஸைடிற்கான சாத்தியமான இரு வடிவங்கள்
இதைப்போலவே, மேற்கண்டுள்ள வழிமுறையினைப் பயன்படுத்தி லூயிஸ் வடிவங்களை வரையும் போது பல மூலக்கூறுகளுக்கு ஒன்றிற்கும் மேற்பட்ட ஏற்கத்தக்க வடிவங்களை வரைய வாய்ப்புள்ளது.
CO2 ன் மேற்கண்டுள்ள இரு வடிவங்களில், எந்த ஒரு வடிவத்தில் எலக்ட்ரான்களின் பங்கீடு சீராக அமைந்துள்ளது? இவ்வினாவிற்கான விடையினை நாம் தெரிந்து கொள்ள லூயிஸ் அமைப்பில் உள்ள ஒவ்வொரு அணுவின் மீதமுள்ள முறைசார் மின்சுமை மதிப்பை நாம் அறிந்திருக்க வேண்டும்.
ஒரு மூலக்கூறில் உள்ள தனித்த அணு ஒன்றின் இணைதிறன் எலக்ட்ரான்களின் எண்ணிக்கைக்கும், லூயிஸ் அமைப்பில் அந்த அணுவிற்கு ஒதுக்கீடு செய்யப்பட்ட எலக்ட்ரான்களின் எண்ணிக்கைக்கும் இடையேயான மின்சுமை வேறுபாடே அம்மூலக்கூறில் அந்த அணுவின் முறைசார் மின்சுமை எனப்படுகிறது.
ஒரு அணுவின் முறைசார் மின்சுமை = Nv – (Nl + Nb/2)
இங்கு
Nv - தனித்த நிலையில் உள்ள அணு ஒன்றின் இணைதிற எலக்ட்ரான்கள்
Nl - லூயி அமைப்பில் அணுவினைச் சுற்றி தனித்த இரட்டைகளாகக் காணப்படும் எலக்ட்ரான்களின் எண்ணிக்கை.
Nb – லூயி அமைப்பில் அணுவினைச் சுற்றியுள்ள பிணைப்பு இரட்டை எலக்ட்ரான்களின் எண்ணிக்கை
இப்போது இரு அமைப்புகளிலும் காணப்படும் அணுக்களின் முறைசார் மின்சுமை மதிப்பினைக் கணக்கிடுவோம்.
வடிவமைப்பு 1ற்கு,

வடிவமைப்பு 2ற்கு
கார்பன் அணுவின் மேல் உள்ள முறைசார் மின்சுமை


படம் 10.7 கார்பன்-டை-ஆக்ஸைடிற்கான சாத்தியமான இரு அமைப்புகள் (முறைசார் மின்சுமையுடன்)
முறைசார் மின்சுமை மதிப்புகளிலிருந்து பின்வரும் வழிமுறைகளைப் பின்பற்றி மிக பொருத்தமான லூயிஸ் வடிவமைப்பை தெரிவு செய்யலாம்.
1. அனைத்து அணுக்களின் முறைசார் மின்சுமை மதிப்புகளும் பூஜ்ஜியமாக உள்ள வடிவமைப்பானது, பிற முறைசார் மின்சுமை காணப்படும் வடிவமைப்புகளைக் காட்டிலும் முன்னுரிமை பெறுகிறது.
2. முறைசார் மின்சுமை மதிப்பு குறைவாக உள்ள வடிவமைப்பானது, அதிகமான முறைசார் மின்சுமை கொண்டுள்ள வடிவமைப்பை விட முன்னுரிமை பெறுகிறது.
3. ஒரு வடிவமைப்பில், அதிக எலக்ட்ரான் கவர்தன்மை உடைய அணு, எதிர் முறைசார் மின்சுமையைப் பெற்றிருப்பின் அவ்வமைப்பு முன்னுரிமையுடையது.
கார்பன் டையாக்ஸைடின் (CO2) வடிவமைப்புகளில், வடிவமைப்பு 1ல் அனைத்து முறைசார் மின்சுமை மதிப்புகளும் பூஜ்யம் என்பதால் இவ்வமைப்பு வடிவமைப்பு 2 ஐக் காட்டிலும் அதிக முன்னுரிமை பெறுகிறது.