11 வது வேதியியல் : அலகு 10 : வேதிப் பிணைப்புகள்
மூலக்கூறு ஆர்பிட்டால் கொள்கை
மூலக்கூறு ஆர்பிட்டால் கொள்கை:
லூயிஸ் கொள்கை மற்றும் இணைதிற பிணைப்புக் கொள்கை (VB கொள்கை) ஆகியன வேதிப்பிணைப்பு உருவாதல் மற்றும் மூலக்கூறு அமைப்புகளை பண்பு ரீதியாக விளக்கின. எனினும், மூலக்கூறுகளின் கண்டறியப்பட்ட சில பண்புகளை விளக்குவதற்கு மேற்கண்டுள்ள இரு கொள்கைகளும் போதுமானதாக இல்லை. எடுத்துக்காட்டாக இவ்விரு கொள்கைகளின்படி ஆக்சிஜன் மூலக்கூறு டையாகாந்தப் பண்பினைப் பெற்றிருக்க வேண்டும் எனினும், வலுவான காந்தப் புலத்தில் திரவ நிலையில் உள்ள ஆக்சிஜன் காந்த துருவங்களுக்கிடையே கவரப்படுகின்றது. இதிலிருந்து ஆக்சிஜன் பாரா காந்தத் தன்மையுடையது என அறிகின்றோம். மேற்கண்டுள்ள இரு கொள்கைகளும் பிணைப்பு உருவாதலை எலக்ட்ரான் இரட்டையின் அடிப்படையில் விளக்கின. எனவே இக்கொள்கைகள் பாரா காந்தத் தன்மையுடைய மூலக்கூறுகளின் பிணைப்பு இயல்பினை விளக்க இயலவில்லை. F. ஹீண்ட் மற்றும் ராபர்ட் S. முல்லிகன் ஆகிய அறிஞர்கள் மூலக்கூறு ஆர்பிட்டால் கொள்கை என்றழைக்கப்படும் பிணைப்புக் கொள்கையை உருவாக்கினார்கள். இக்கொள்கையானது மூலக்கூறுகளின் காந்தப் பண்பினை விளக்கியது.
இக்கொள்கையின் முக்கிய அம்சங்கள் பின்வருமாறு:
1. அணுக்கள் இணைந்து மூலக்கூறினை உருவாக்கும் போது, அவைகளின் அணு ஆர்பிட்டால்கள் தங்களது தனித்தன்மையை இழக்கின்றன. மேலும் மூலக்கூறு ஆர்பிட்டால்கள் என்றழைக்கப்படும் புதிய ஆர்பிட்டால்கள் உருவாகின்றன.
2. இணையும் அணு ஆர்பிட்டால்களின் வடிவத்தனைப் பொறுத்து, உருவாகும் மூலக்கூறு ஆர்பிட்டால்களின் வடிவங்கள் அமைகின்றன.
3. இணைகின்ற அணு ஆர்பிட்டால்களின் எண்ணிக்கையும் உருவான மூலக்கூறு ஆர்பிட்டால்களின் எண்ணிக்கையும் சமம். இணையும் தொடர்புடைய அணு ஆர்பிட்டால்களின் ஆற்றலுடன் ஒப்பிடும்போது, உருவான மூலக்கூறு ஆர்பிட்டால்களில் சரி பாதியளவு எண்ணிக்கையுடைய ஆர்பிட்டால்கள் அவற்றைவிட குறைவான ஆற்றலையும் மற்ற சரி பாதியளவு எண்ணிகையுடைய மூலக்கூறு ஆர்பிட்டால்கள் அதிக ஆற்றலையும் பெற்றுள்ளன. குறைவான ஆற்றலைப் பெற்றிருக்கும் மூலக்கூறு ஆர்பிட்டால்கள் பிணைப்பு மூலக்கூறு ஆர்பிட்டால்கள் எனவும், அதிக ஆற்றலைப் பெற்றிருக்கும் மூலக்கூறு ஆர்பிட்டால்கள் எதிர்பிணைப்பு மூலக்கூறு ஆர்பிட்டால்கள் எனவும் அழைக்கப்படுகின்றன. பிணைப்பு மூலக்கூறு ஆர்பிட்டால்கள் சிக்மா (σ). பை (π) டெல்டா (δ) எனவும், எதிர் பிணைப்பு மூலக்கூறு ஆர்பிட்டால்கள் σ*, π* மற்றும் δ* எனவும் அழைக்கப்படுகின்றன.
4. மூலக்கூறில், எலக்ட்ரான்கள் புதிதாக உருவான மூலக்கூறு ஆர்பிட்டால்களில் நிரப்பப்படுகின்றன. இந்த ஆர்பிட்டால்களில் எலக்ட்ரான்கள் நிரப்பப்படுதல், அணு ஆர்பிட்டால்களில் எலக்ட்ரான்கள் நிரப்பப்படுவது போன்றே ஆஃபா தத்துவம், பெளலி தவிர்க்கைத் தத்துவம் மற்றும் ஹீண்ட் விதி ஆகியவற்றின் அடிப்டையிலேயே அமையும்.
5. இணையும் இரு அணுக்களுக்கிடையே காணப்படும் பிணைப்புகளின் எண்ணிக்கை பிணைப்புத்தரம் எனப்படுகிறது. ஒரு மூலக்கூறின் பிணைப்புத் தரத்தினை பின்வரும் சமன்பாட்டால் கண்டறியலாம்/
பிணைப்புத்தரம் = Nb – Na / 2
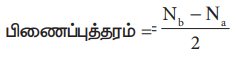
இங்கு,
Nb என்பது பிணைப்பு மூலக்கூறு ஆர்பிட்டால்களில் காணப்படும் மொத்த எலக்ட்ரான்களின் எண்ணிக்கை.
Na என்பது எதிர்பிணைப்பு மூலக்கூறு ஆர்பிட்டால்களில் காணப்படும் மொத்த எலக்ட்ரான்களின் எண்ணிக்கை.
மேலும் ஒரு மூலக்கூறின் பிணைப்புத் தரம் பூஜ்ஜியம் எனில் அத்தகைய மூலக்கூறு உருவாவதில்லை என அறியலாம்.
1. அணு ஆர்பிட்டால்களின் நேர்கோட்டு இணைவு (LCAO) Linear combination of atomic orbitals
ஒரு மூலக்கூறிற்கான ஷ்ரோடிங்கர் அலைச் சமன்பாட்டிற்கு தீர்வு கண்டறிவதன் மூலம் அதன் மூலக்கூறு ஆர்பிட்டால்களுக்கான அலைச் சார்பினைக் கண்டறிய இயலும். மூலக்கூறுகளின் ஷ்ரோடிங்கர் அலைச் சமன்பாட்டினை தீர்த்தல் என்பது மிகவும் சிக்கலானது என்பதால், மூலக்கூறு ஆர்பிட்டால்களுக்கான அலைச்சார்பினைக் கண்டறியதோராய முறைகள் பயன்படுகின்றன. அத்தகைய முறைகளில் பொதுவானதொரு முறை அணு ஆர்பிட்டால்களின் நேரிய இணைவு (LCAO) ஆகும்.
அணு ஆர்பிட்டால்களின் அலைச்சார்பு ψ என குறிக்கப்படுவதை நாம் அறிவோம். ஒப்பிடத்தக்க ஆற்றலுடைய ψA மற்றும் ψB ஆகிய இரு அலைச்சார்புகளால் குறிப்பிடப்படும் இரு அணு ஆர்பிட்டால்கள் இணைந்து இரு மூலக்கூறு ஆர்பிட்டால்களைத் தரும் ஒரு நேர்வினை நாம் கருதுவோம்.
அவைகளுள் ஒன்று பிணைப்பு மூலக்கூறு ஆர்பிட்டால் (ψ பிணைப்பு) மற்றொன்று எதிர்பிணைப்பு மூலக்கூறு ஆர்பிட்டால் (ψ எதிர் பிணைப்பு) ஆகும். இவ்விரு மூலக்கூறு ஆர்பிட்டால்களுக்கான அலைச்சார்பினை அணு ஆர்பிட்டால்களான ψA மற்றும் ψB ஆகியவைகளின் நேரிய இணைவின் மூலம் பெறலாம்
ψபிணைப்பு = ψA + ψB
ψஎதிர் பிணைப்பு = ψA - ψB
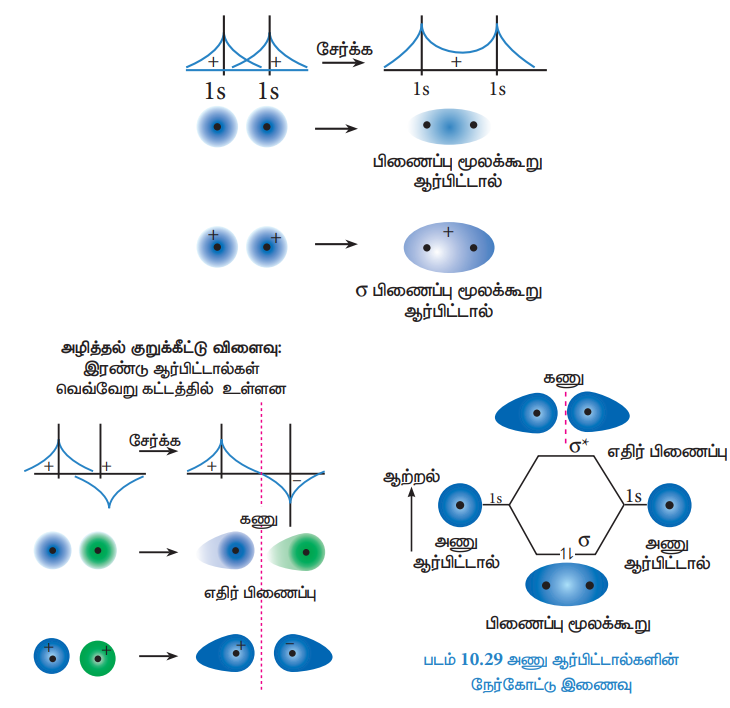
அணு ஆர்பிட்டால்களின் ஆக்கக் குறுக்கீட்டு விளைவால், பிணைப்பு மூலக்கூறு ஆர்பிட்டால்கள் உருவாவதாகவும், அணு ஆர்பிட்டால்களின் அழித்தல் குறுக்கீட்டு விளைவின் காரணமாக எதிர் பிணைப்பு மூலக்கூறு ஆர்பிட்டால்கள் உருவாவதாகவும் கருதலாம். இரு 1s ஆர்பிட்டால்களில் இருந்து இரு மூலக்கூறு ஆர்பிட்டால்கள் உருவாவது பின்வரும் படத்தில் காட்டப்பட்டுள்ளது.
ஆக்கக் குறுக்கீட்டு விளைவு: இரண்டு 1s ஆர்பிட்டால்கள் ஒரே கட்டத்தில் உள்ளன. மற்றும் ஒரே குறிகளை பெற்றுள்ளன.
2. ஒத்த இரு அணுக்கள் கொண்ட ஈரணு மூலக்கூறுகளின் பிணைப்பு
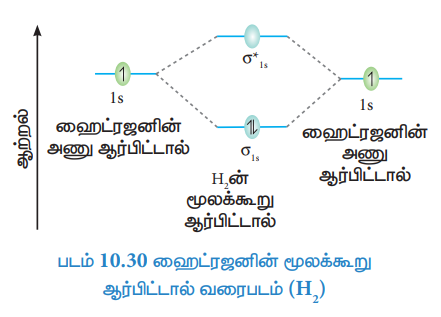
ஹைட்ரஜனின் மூலக்கூறு ஆர்பிட்டால் வரைபடம் (H2)
ஹைட்ரஜன் அணுவின் எலக்ட்ரான் அமைப்பு ls1
ஹைட்ரஜனின் மூலக்கூறின் எலக்ட்ரான் அமைப்பு σ2ls
பிணைப்பு தரம் = Nb – Na / 2 = 2 – 0 / 2 = 1
மூலக்கூறில் தனித்த எலக்ட்ரான்கள் இல்லை எனவே இது டையாகாந்தப் பண்புடையது.
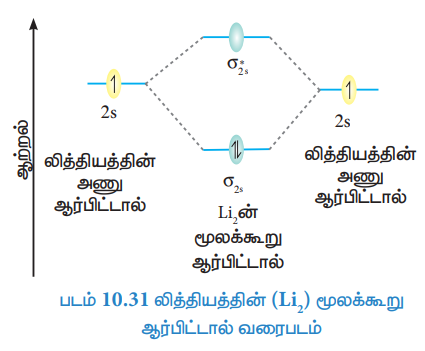
லித்தியத்தின் (Li2) மூலக்கூறு ஆர்பிட்டால் வரைபடம்
லித்தியம் அணுவின் எலக்ட்ரான் அமைப்பு = 1s2, 2s1
லித்தியம் மூலக்கூறின் எலக்ட்ரான் அமைப்பு = σ1s2, σ*1s2, σ2s2
பிணைப்பு தரம் = Nb – Na / 2 = 4 – 2 / 2 = 1
மூலக்கூறில் தனித்த எலக்ட்ரான்கள் இல்லை எனவே இது டையாகாந்தப் பண்புடையது.
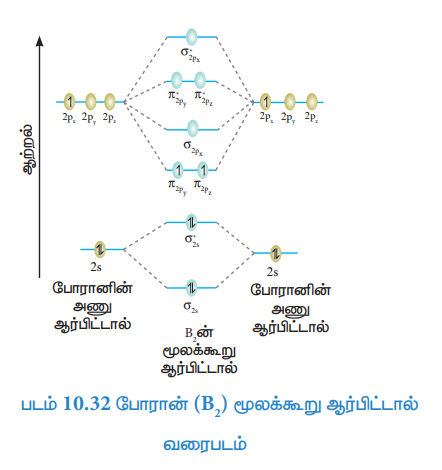
போரான் (B2) மூலக்கூறு ஆர்பிட்டால் வரைபடம்.
போரான் அணுவின் எலக்ட்ரான் அமைப்பு = ls2 2s2 2p1
போரான் மூலக்கூறின் எலக்ட்ரான் அமைப்பு
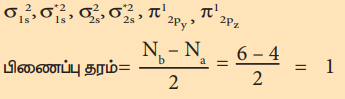
மூலக்கூறில் இரு தனித்த எலக்ட்ரான்கள் உள்ளது எனவே இது பாரா காந்தப் பண்புடையது.
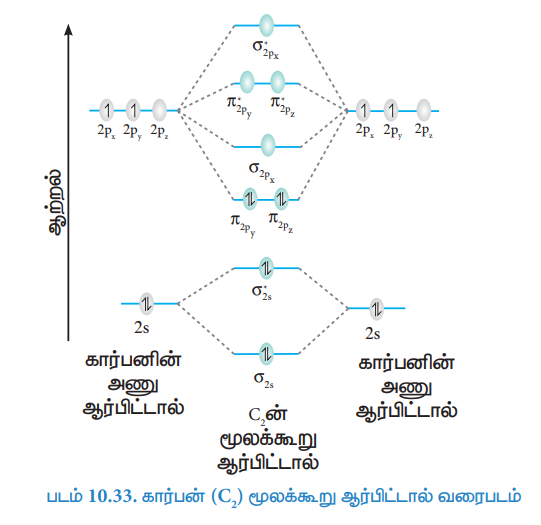
கார்பன் (C2) மூலக்கூறு ஆர்பிட்டால் வரைபடம்
கார்பன் அணுவின் எலக்ட்ரான் அமைப்பு 1s2 2s2 2p2
கார்பன் மூலக்கூறின் எலக்ட்ரான் அமைப்பு
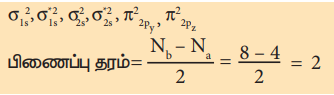
மூலக்கூறில் தனித்த எலக்ட்ரான்கள் இல்லை எனவே இது டையா காந்தப் பண்புடையது.
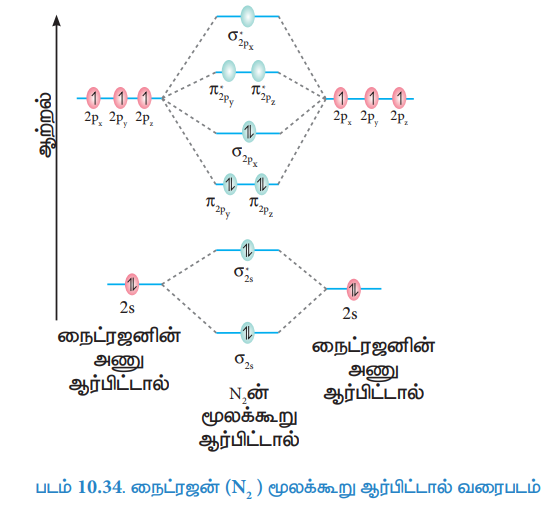
நைட்ரஜன் (N2) மூலக்கூறு ஆர்பிட்டால் வரைபடம்
நைட்ரஜன் அணுவின் எலக்ட்ரான் அமைப்பு 1s2 2s2 2p3
நைட்ரஜன் மூலக்கூறின் எலக்ட்ரான் அமைப்பு
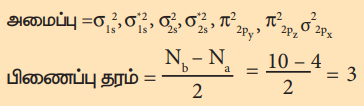
மூலக்கூறில் தனித்த எலக்ட்ரான்கள் இல்லை எனவே இது டையா காந்தப் பண்புடையது.
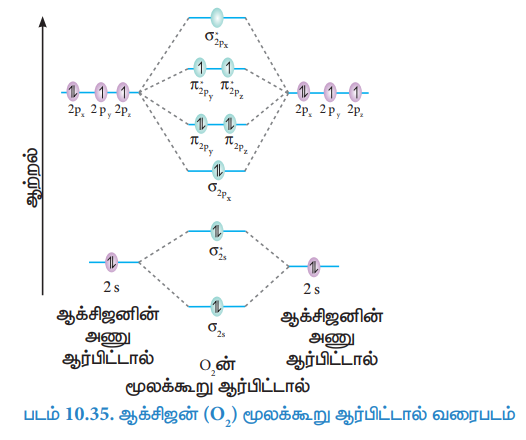
ஆக்சிஜன் (O2) மூலக்கூறு ஆர்பிட்டால் வரைபடம்
ஆக்சிஜன் அணுவின் எலக்ட்ரான் அமைப்பு 1s2 2s2 2p4
ஆக்சிஜன் மூலக்கூறின் எலக்ட்ரான் அமைப்பு (O2)
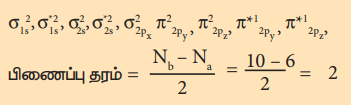
பிணைப்பு தரம் = Nb – Na / 2 = 10 – 6 / 2 = 2
மூலக்கூறில் இரு தனித்த எலக்ட்ரான்கள் உள்ளது எனவே இது பாரா காந்தப் பண்புடையது.
3. வெவ்வேறு அணுக்களைக் கொண்ட இரு அணு மூலக்கூறுகளில் காணும் பிணைப்புகள்
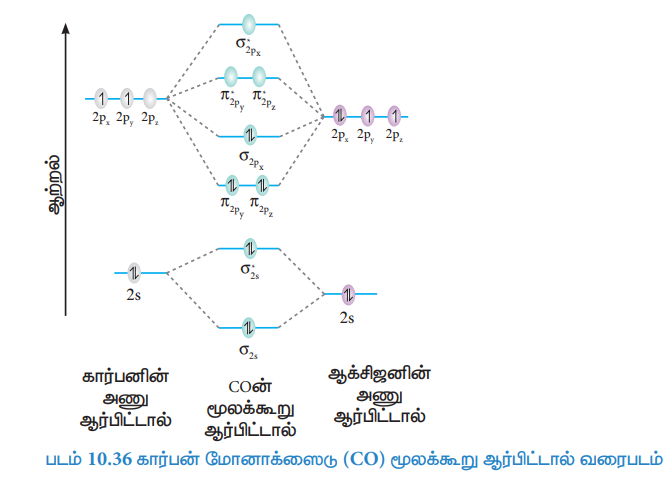
கார்பன் மோனாக்ஸைடு (CO) மூலக்கூறின் மூலக்கூறு ஆர்பிட்டால் வரைபடம்
கார்பன் அணுவின் எலக்ட்ரான் அமைப்பு = 1s2 2s2 2p2
ஆக்சிஜன் அணுவின் எலக்ட்ரான் அமைப்பு 1s2 2s2 2p4
கார்பன் மோனாக்ஸைடு மூலக்கூறின் எலக்ட்ரான் அமைப்பு
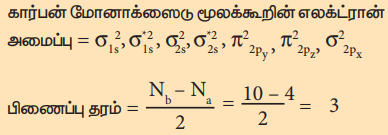
மூலக்கூறில் தனித்த எலக்ட்ரான்கள் இல்லை எனவே இது டையா காந்தப் பண்புடையது.
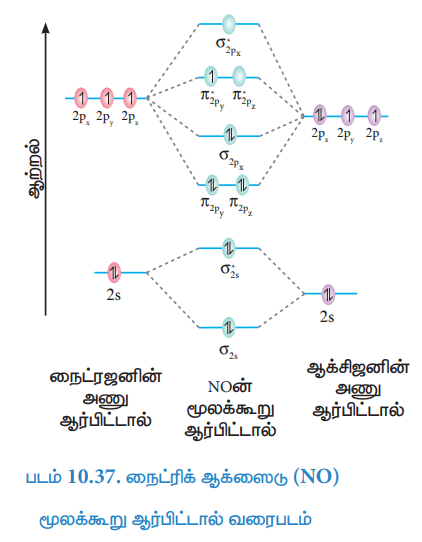
நைட்ரிக் ஆக்ஸைடு (NO) மூலக்கூறு ஆர்பிட்டால் வரைபடம்
நைட்ரஜன் அணுவின் எலக்ட்ரான் அமைப்பு = 1s2 2s2 2p3
ஆக்சிஜன் அணுவின் எலக்ட்ரான் அமைப்பு = 1s2 2s2 2p4
நைட்ரிக் ஆக்ஸைடு (NO) மூலக்கூறின் எலக்ட்ரான் அமைப்பு =
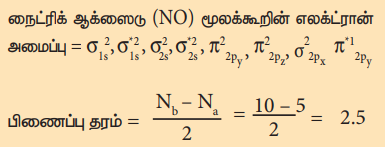
மூலக்கூறில் ஒரு தனித்த எலக்ட்ரான் உள்ளது எனவே இது பாரா காந்தப் பண்புடையது.
தன்மதிப்பீடு
10. அசிட்டிலைடு அயனியின் C2-2 மூலக்கூறு ஆர்பிட்டால் படம் வரைந்து அதன் பிணைப்பு தரத்தினை கணக்கிடுக.
தீர்வு:
● C2-2 அயனி மூலக்கூறு உருவாதல்:
● கார்பன் அணுவின் எலக்ட்ரான் அமைப்பு (z = 6) : 1s2 2s2 2p2
● C22- மூலக்கூறின் எலக்ட்ரான் அமைப்பு:
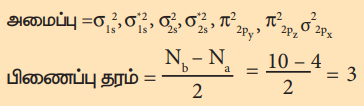

உலோக பிணைப்பு
உலோகங்கள் பளபளப்புத் தன்மை, அதிக அடர்த்தி, மின் மற்றும் வெப்பங்கடத்தும் தன்மை, தட்டையாக்குதல் மற்றும் கம்பியாக நீட்டுதல் ஆகியவற்றிற்கே உரிய பண்புகளைப் பெற்றுள்ளன. மேலும், இவற்றின் கொதிநிலை மற்றும் உருகுநிலை மதிப்புகள் அதிகம். உலோகப் படிகத்தில், உலோக அணுக்கள் மிக அருகில் நெருங்கி அமைந்திருக்க காரணமாக அமையும் விசை உலோகப்பிணைப்பு என அறியபடுகிறது. உலோகப்பிணைப்பானது ஒரு அயனிப்பிணைப்பல்ல ஏனெனில், அயனிப்பிணைப்பானது வெவ்வேறு எலக்ட்ரான் கவர்தன்மை உடைய அணுக்களுக்கிடையே ஏற்படுகிறது. அதைப் போலவே இது ஒரு சகப்பிணைப்பும் அல்ல ஏனெனில் உலோக அணுக்களில் அதனை சூழ்ந்துள்ள 8 அல்லது 12 அணுக்களுடன் இணைதிற எலக்ட்ரான்களை சமமாகப் பங்கிடும் வகையில் அவைகளில் போதுமான எலக்ட்ரான்களும் இல்லை. எனவே உலோகப் பிணைப்பினை விளக்க ஒரு புதியக் கொள்கை தேவைப்பட்டது.
ட்ரூட் மற்றும் லாரன்ஸ் ஆகியோர்களால் முதன்முதலில் உலோக பிணைப்பிற்கானக் கொள்கை முன்மொழியப்பட்டது. இக் கொள்கையின்படி உலோகப்படிகமானது, கட்டுறா எலக்ட்ரான்களின் வாயுவில், நேர்மின் சுமை கொண்ட அயனிகள் அமிழ்ந்துள்ள ஒரு தொகுப்பாக கருதப்படுகிறது. உலோகங்களின் இணைதிற எலக்ட்ரான்கள் அயனியாதலால் இந்த கட்டுறா எலக்ட்ரான்கள் உருவாகின்றன. அணுக்களின் இணைதிற எலக்ட்ரான்கள் உலோக படிகத்தில் உள்ள அனைத்து அணுக்களாலும் கட்டுப்பாடின்றி பங்கிடப்படுவதால் உலோக பிணைப்பானது எலக்ட்ரானிய பிணைப்பு (elctronic bonding) எனவும் அழைக்கப்படுகிறது. கட்டுறா எலக்ட்ரான்கள் ஒன்றையொன்று விலக்குவதால் அவைகள் உலோக அயனிகளைச் சுற்றி சீராக விரவியுள்ளன. உலோகங்களின் பெரும்பாலான இயற்பண்புகளை இக்கொள்கை விளக்கினாலும் சில வரம்புகளும் உள்ளன.
உலோக அயனிகளுக்கும், கட்டுறா எலக்ட்ரான்களுக்கும் இடையே நிலைமின்னியல் கவர்ச்சி விசை காணப்படுவதால், உலோகமானது நெருங்கிப் பொதிந்த கணக்கற்ற உலோக அயனிகளைக் கொண்டுள்ள ஒரு முப்பரிமான வடிவமைப்பினைப் பெறுகிறது. எனவே உலோகங்கள் அதிக அடர்த்தியை பெற்றுள்ளன. உலோகத்தின் மீது வெளிப்புற இயந்திர தடை செயல்படும் போது, அதன் நெருங்கி பொதிந்த அமைப்பானது பல நழுவு தளங்களைக் கொண்டிருப்பதால், அதன் வழியே நகர்தல் நடைபெற இயலும். அதாவது உலோகமானது கம்பியாக நீளும் தன்மையைப் பெறுகிறது. வெளிப்புற இயந்திர தடை செயல்படும் போது தூய்மையான உலோகங்கள் உடையும் முன்னர் 40% முதல் 60% வரை நீட்சியடைகின்றன. ஒவ்வொரு உலோக அயனியும் அதனைச்சுற்றி அனைத்து திசைகளிலும் எலக்ட்ரான் திரள் முகிலால் சூழப்பட்டுள்ளதால், உலோகப் பிணைப்பிற்கு திசைப்பண்பு இல்லை.
நேர்மின்சுமை அயனிகளின் வழியே எலக்ட்ரான்கள் கட்டுப்பாடின்றி நகர்வதால், உலோகங்கள் அதிக வெப்ப மற்றும் மின்கடத்தும் திறனைப் பெற்றுள்ளன. எலக்ட்ரான் திரள் முகிலால் ஒளியானது எதிரொளிக்கப்படுவதால் உலோகங்கள் பளபளப்புத் தன்மையினைப் பெற்றுள்ளன. உலோகப் பிணைப்புகள் அதிக வலிமையுடையவை என்பதால், உலோக அயனிகள் தனித்தனியே பிரிகையுற்று திரவமாகவோ அல்லது வாயுவாகவோ நிலைமை மாற்றம் அடைதல் எளிதானது அல்ல. எனவே உலோகங்கள் அதிக உருகுநிலை மற்றும் கொதிநிலையைப் பெற்றுள்ளன.
உலோகங்களில் காணப்படும் பிணைப்பினை, மூலக்கூறு ஆர்பிட்டால் கொள்கைப்படி நன்கு விளக்க இயலும். இக்கொள்கையின்படி, உலோக படிகத்தில் உள்ள அதிக எண்ணிக்கையிலான அணுக்களின் அணு ஆர்பிட்டால்கள் மேற்பொருந்தி எண்ணற்ற பிணைப்பு மற்றும் எதிர்பிணைப்பு மூலக்கூறு ஆர்பிட்டால்களை, ஆற்றல் இடைவெளியின்றி உருவாக்குகின்றன.
பிணைப்பு மூலக்கூறு ஆர்பிட்டால் ஒவ்வொன்றும், ஒரு ஜோடி எலக்ட்ரான்களுடன் முழுமையாக நிரப்பப்பட்டுள்ளன. எதிர்பிணைப்பு மூலக்கூறு ஆர்பிட்டால்கள் காலியாக உள்ளன. ஆற்றல் இடைவெளி இன்மை உலோகங்களின் மின்கடத்தும் திறனுக்கு காரணமாக அமைகின்றன. இணைதிற பட்டையிலிருந்து, கடத்துப்பட்டைக்கு பல எலக்ட்ரான்கள் வெப்பக் கிளர்வுறுவதன் காரணமாக, உலோகங்கள் வெப்பம் கடத்தும் தன்மையைப் பெற்றுள்ளன. வெப்பநிலை அதிகரிக்கும்போது மின்கடத்துத் திறன் குறைகிறது. ஏனெனில் உலோக அயனிகளின் வெப்ப இயக்கத்தால், உலோக படிகத்திலுள்ள, கட்டுறா எலக்ட்ரான்களின் தடையற்ற இயக்கத்திற்கு தேவையான சீரான படிக அமைப்பானது குலைகிறது. தாமிரம், வெள்ளி மற்றும் தங்கத்தினை தவிர்த்த பெரும்பாலான உலோகங்கள் கருமை நிறத்தினை பெற்றுள்ளன. அனைத்து அலைநீளமுடைய ஒளியினை உட்கவர்தலே இதற்குக் காரணமாக அமைகிறது.