11 வது வேதியியல் : அலகு 10 : வேதிப் பிணைப்புகள்
இக்கொள்கையின் முக்கிய அம்சங்கள் பின்வருமாறு
இக்கொள்கையின் முக்கிய அம்சங்கள் பின்வருமாறு:
1. அணுக்கள் இணைந்து மூலக்கூறினை உருவாக்கும் போது, அவைகளின் அணு ஆர்பிட்டால்கள் தங்களது தனித்தன்மையை இழக்கின்றன. மேலும் மூலக்கூறு ஆர்பிட்டால்கள் என்றழைக்கப்படும் புதிய ஆர்பிட்டால்கள் உருவாகின்றன.
2. இணையும் அணு ஆர்பிட்டால்களின் வடிவத்தனைப் பொறுத்து, உருவாகும் மூலக்கூறு ஆர்பிட்டால்களின் வடிவங்கள் அமைகின்றன.
3. இணைகின்ற அணு ஆர்பிட்டால்களின் எண்ணிக்கையும் உருவான மூலக்கூறு ஆர்பிட்டால்களின் எண்ணிக்கையும் சமம். இணையும் தொடர்புடைய அணு ஆர்பிட்டால்களின் ஆற்றலுடன் ஒப்பிடும்போது, உருவான மூலக்கூறு ஆர்பிட்டால்களில் சரி பாதியளவு எண்ணிக்கையுடைய ஆர்பிட்டால்கள் அவற்றைவிட குறைவான ஆற்றலையும் மற்ற சரி பாதியளவு எண்ணிகையுடைய மூலக்கூறு ஆர்பிட்டால்கள் அதிக ஆற்றலையும் பெற்றுள்ளன. குறைவான ஆற்றலைப் பெற்றிருக்கும் மூலக்கூறு ஆர்பிட்டால்கள் பிணைப்பு மூலக்கூறு ஆர்பிட்டால்கள் எனவும், அதிக ஆற்றலைப் பெற்றிருக்கும் மூலக்கூறு ஆர்பிட்டால்கள் எதிர்பிணைப்பு மூலக்கூறு ஆர்பிட்டால்கள் எனவும் அழைக்கப்படுகின்றன. பிணைப்பு மூலக்கூறு ஆர்பிட்டால்கள் சிக்மா (σ). பை (π) டெல்டா (δ) எனவும், எதிர் பிணைப்பு மூலக்கூறு ஆர்பிட்டால்கள் σ*, π* மற்றும் δ* எனவும் அழைக்கப்படுகின்றன.
4. மூலக்கூறில், எலக்ட்ரான்கள் புதிதாக உருவான மூலக்கூறு ஆர்பிட்டால்களில் நிரப்பப்படுகின்றன. இந்த ஆர்பிட்டால்களில் எலக்ட்ரான்கள் நிரப்பப்படுதல், அணு ஆர்பிட்டால்களில் எலக்ட்ரான்கள் நிரப்பப்படுவது போன்றே ஆஃபா தத்துவம், பெளலி தவிர்க்கைத் தத்துவம் மற்றும் ஹீண்ட் விதி ஆகியவற்றின் அடிப்டையிலேயே அமையும்.
5. இணையும் இரு அணுக்களுக்கிடையே காணப்படும் பிணைப்புகளின் எண்ணிக்கை பிணைப்புத்தரம் எனப்படுகிறது. ஒரு மூலக்கூறின் பிணைப்புத் தரத்தினை பின்வரும் சமன்பாட்டால் கண்டறியலாம்/
பிணைப்புத்தரம் = Nb – Na / 2
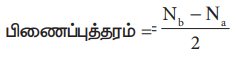
இங்கு,
Nb என்பது பிணைப்பு மூலக்கூறு ஆர்பிட்டால்களில் காணப்படும் மொத்த எலக்ட்ரான்களின் எண்ணிக்கை.
Na என்பது எதிர்பிணைப்பு மூலக்கூறு ஆர்பிட்டால்களில் காணப்படும் மொத்த எலக்ட்ரான்களின் எண்ணிக்கை.
மேலும் ஒரு மூலக்கூறின் பிணைப்புத் தரம் பூஜ்ஜியம் எனில் அத்தகைய மூலக்கூறு உருவாவதில்லை என அறியலாம்.