வேதிப் பிணைப்புகள் - இனக்கலப்பாதலின் வகைள் மற்றும் மூலக்கூறுகளின் வடிவங்கள் | 11th Chemistry : UNIT 10 : Chemical bonding
11 வது வேதியியல் : அலகு 10 : வேதிப் பிணைப்புகள்
இனக்கலப்பாதலின் வகைள் மற்றும் மூலக்கூறுகளின் வடிவங்கள்
இனக்கலப்பாதல்
ஹைட்ரஜன், புளூரின் போன்ற எளிய மூலக்கூறுகளில் காணப்படும் பிணைப்புகளை, தொடர்புடைய பிணைந்துள்ள அணுக்களின் அணு ஆர்பிட்டால்கள் மேற்பொருந்துதல் மூலம் எளிதாக விளக்க இயலும். ஆனால் மீத்தேன், அம்மோனியா, பெரிலியம் குளோரைடு முதலிய பல்லணு மூலக்கூறுகளின் கண்டறியப்பட்ட பண்புகளை, அணு ஆர்பிட்டால்களின் எளிய மேற்பொருந்துதல் மூலம் விளக்க இயலவில்லை. எடுத்துக்காட்டாக, சோதனை முடிவுகளின் அடிப்படையில், மீத்தேன் மூலக்கூறானது நான்முகி வடிவத்தினை பெற்றுள்ளது எனவும் அதில் காணப்படும், நான்கு C-H பிணைப்புகளும் சமமானவை எனவும் நிரூபணம் செய்யப்பட்டுள்ளது. இப்பண்புகளை நான்கு ஹைட்ரஜன் அணுக்களின் (1s) ஆர்பிட்டால்கள், கார்பனின் வெவ்வேறு ஆற்றலுடைய (2s2 2px2 2py 2pz) அணு ஆர்பிட்டால்களுடன் மேற்பொருந்துதல் மூலம் விளக்க இயலாது.
சோதனை முடிவுகளின் அடிப்படையில் கண்டறியப்பட்ட இத்தகைய பண்புகளை விளக்கும் பொருட்டு லினஸ் பாலிங் என்பவர் மூலக்கூறுகளில் காணப்படும் இணைதிற அணு ஆர்பிட்டால்கள் என்பன தனித்த அணுவின் ஆர்பிட்டாலிலிருந்து மாறுபட்டிருக்கின்றன என்ற கருத்தினை முன்மொழிந்தார். மேலும் அவர் இனக்கலப்பாதல் என்ற கோட்பாட்டினை அறிமுகப்படுத்தினார்.
ஒரே அணுவின், ஒப்பிடத்தக்க அளவு ஆற்றலுடைய அணு ஆர்பிட்டால்கள் ஒன்றோடொன்று கலந்து, சம எண்ணிக்கையில் சம ஆற்றலை பெற்றுள்ள புதிய சமமான ஆர்பிட்டால்களை தரும் செயல்முறை இனக்கலப்பாதல் என வரையறுக்கப்படுகிறது. இச்செயல்முறையில் உருவான புதிய ஆர்பிட்டால்கள் இனக்கலப்படைந்த ஆர்பிட்டால்கள் என அழைக்கப்படுகின்றன.
இனக்கலப்பு ஆர்பிட்டால்கள் அதிகபட்ச சமச்சீர் தன்மையை பெற்றிருப்பதுடன், அவைகளில் காணப்படும் எலக்ட்ரான்களின் விலக்கு விசையினை சிறுமமாக்கும் வகையில் புறவெளியில் குறித்த திசையினை நோக்கியும் அமைகின்றன.
1. இனக்கலப்பாதலின் வகைள் மற்றும் மூலக்கூறுகளின் வடிவங்கள்
sp இனக்கலப்பாதல்;
பெரிலியம் குளோரைடில் பிணைப்பு உருவாதலை நாம் கருதுவோம். இயல்பு ஆற்றல் நிலையில் உள்ள பெரிலியம் அணுவின் இணைதிற கூட்டு எலக்ட்ரான் அமைப்பு [He] 2s2 2p0x 2p0y 2p0z.
பெரிலியம் குளோரைடில் உள்ள இரு Be-Cl பிணைப்புகளும் சமமானவை. மேலும், அம்மூலக்கூறு நேர்கோட்டு வடிவத்தினைப் பெற்றுள்ளது என கண்டறியப்பட்டுள்ளது. இப்பண்பினை sp இனக்கலப்பாதல் மூலம் VB கொள்கையினைப் பயன்படுத்தி விளக்கலாம்.
பெரிலியத்தின் 2s ஆர்பிட்டாலில் உள்ள இரு எலக்ட்ரான்களில் ஒரு எலக்ட்ரானானது கிளர்வுற்று 2p ஆர்பிட்டலுக்குச் செல்கிறது. கிளர்வுற்ற நிலையில் எலக்ட்ரான் அமைப்பு [He] 2s1 2p1x 2p0y 2p0z
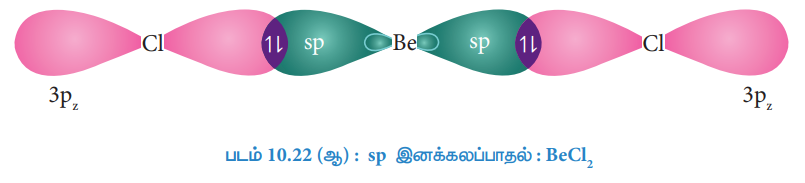
இந்நிலையில் பெரிலியத்தின் 2s மற்றும் 2p ஆர்பிட்டால்கள் இனக்கலப்பாதலுக்கு உட்பட்டு, இரு சமமான sp இனக்கலப்படைந்த ஆர்பிட்டால்களைத் தருகின்றன. இந்த புதிய ஆர்பிட்டால்கள் 50% s-பண்பினையும், 50% p-பண்பினையும் பெற்றுள்ளன. sp இனக்கலப்படைந்த ஆர்பிட்டால்கள் படத்தில் (படம் 10.22 ஆ) காட்டியுள்ளவாறு நேரெதிர் திசைகளில் (180° )அமைகின்றன

குளோரினின் ஆர்பிட்டாலுடன் மேற்பொருந்துதல்
ஒவ்வொரு sp இனக்கலப்படைந்த ஆர்பிட்டால்களும், குளோரினின் pz ஆர்பிட்டாலுடன் நேர்கோட்டில் மேற்பொருந்துவதால் படத்தில் காட்டியுள்ளவாறு Be மற்றும் Clக்கு இடையே சகப்பிணைப்புகள் உருவாகின்றன.
sp2 இனக்கலப்பு:
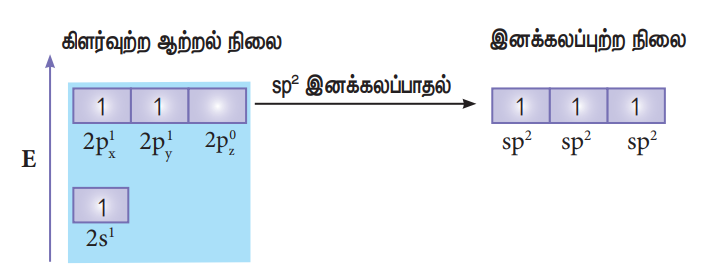
போரான் ட்ரை புளூரைடு(BF3) மூலக்கூறில் பிணைப்பு உருவாதலை கருதுக. போரான் அணுவின் இணைதிற கூட்டு எலக்ட்ரான் அமைப்பு [He] 2s2 2p1

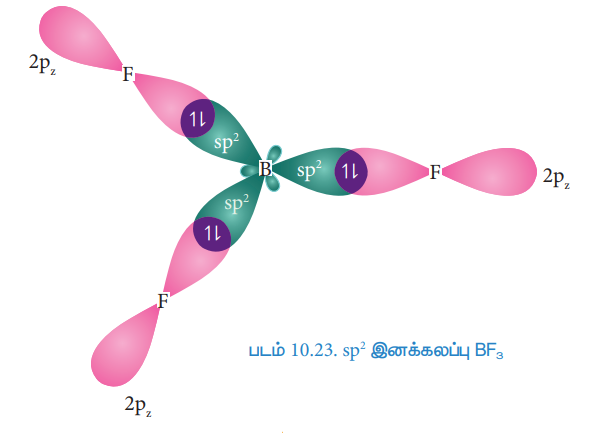
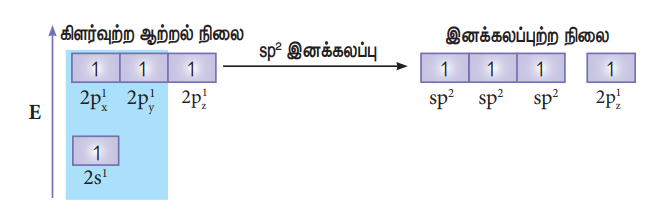
இயல்பு ஆற்றல் நிலையில் போரான் அணுவின் இணைதிறன் கூட்டில் இணையாகாத எலக்ட்ரான் ஒன்று மட்டுமே உள்ளது. ஆனால், புளூரினுடன் மூன்று சகப்பிணைப்பை ஏற்படுத்த மூன்று இணையாகாத எலக்ட்ரான்கள் தேவை. இதனை பெறும் பொருட்டு, போரானின் 2s ஆர்பிட்டாலில் உள்ள இரு எலக்ட்ரான்களில் ஒரு எலக்ட்ரானானது 2py ஆர்பிட்டாலுக்கு கிளர்வுற்று இனக்கலப்பாதலுக்கு உட்பட்டு, படத்தில் காட்டியுள்ளவாறு மூன்று சமமான sp2 இனக்கலப்படைந்த ஆர்பிட்டால்களைத் தருகின்றன. இம்மூன்று ஆர்பிட்டால்களும் xy என்ற சம தளத்தில் அமைகின்றன. மேலும் இரு ஆர்பிட்டால்களுக்கு இடையேயான பிணைப்புக் கோணம் 120° ஆகும்.
புளூரினின் 2pz ஆர்பிட்டால்கள் மேற்பொருந்துதல்:
போரானின் மூன்று sp2 இனக்கலப்படைந்த ஆர்பிட்டால்களுடன் மூன்று புளூரின் அணுக்களின் 2pz ஆர்பிட்டால்கள் நேர்கோட்டில் மேற்பொருந்துவதால் படத்தில் காட்டியுள்ளவாறு B மற்றும் Fக்கு இடையே சகப்பிணைப்புகள் உருவாகின்றன.
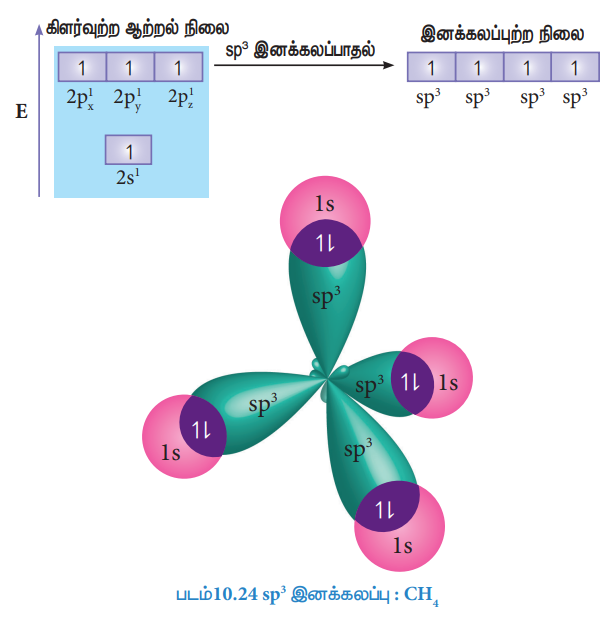
sp3 இனக்கலப்பு:
மீத்தேன் மூலக்கூறை எடுத்துக்காட்டாகக் கொண்டு sp3 இனக்கலப்பினை விளக்கலாம். மீத்தேன் மூலக்கூறில் மைய கார்பன் அணு நான்கு ஹைட்ரஜன் அணுக்களுடன் பிணைக்கப்பட்டுள்ளது. கார்பன் அணுவின் இணைதிற கூட்டு எலக்ட்ரான் அமைப்பு இயல்பு ஆற்றல் நிலையில் [He] 2s2 2p1x 2p1y 2p0z
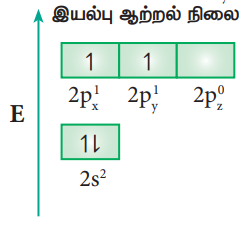
நான்கு ஹைட்ரஜன் அணுக்களுடன் நான்கு சகப்பிணைப்புகளை ஏற்படுத்த கார்பனின் 2s ஆர்பிட்டாலில் உள்ள இரு எலக்ட்ரான்களில் ஒரு எலக்ட்ரானானது 2pz ஆர்பிட்டாலுக்கு கிளர்வுறுகிறது. கார்பனின் ஒரு 2s ஆர்பிட்டாலும், மூன்று 2p ஆர்பிட்டால்களும் இனக்கலப்பு அடைந்து நான்கு சமமான sp3 இனக்கலப்பு ஆர்பிட்டால்களைத் தருகின்றன. மேலும், இரு sp3 ஆர்பிட்டால்களுக்கு இடையேயுள்ள பிணைப்புக் கோணம் 1090 28’ ஆகும்,
ஹைட்ரஜனின் ls ஆர்பிட்டால்கள் மேற்பொருந்துதல்:
நான்கு ஹைட்ரஜன் அணுக்களின் ls ஆர்பிட்டால்கள், கார்பன் அணுவின் நான்கு sp3 இனக்கலப்பு ஆர்பிட்டால்களுடன் நேர்கோட்டில் மேற்பொருந்தி மீத்தேன் மூலக்கூறினில் 4C-Hσ-பிணைப்பினை படத்தில் காட்டியுள்ளவாறு ஏற்படுத்துகின்றன.
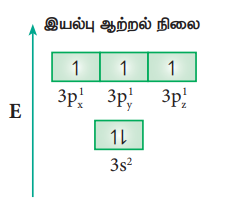
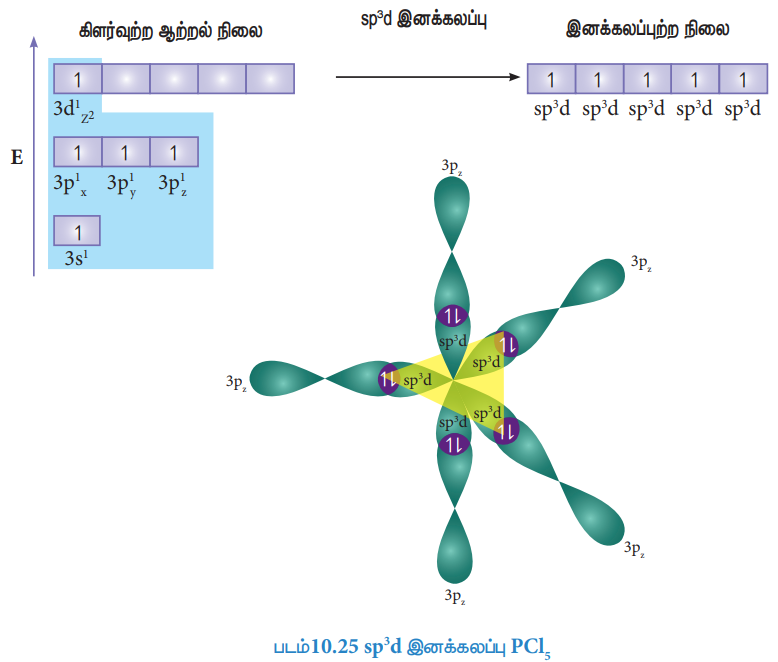
Sp3d இனக்கலப்பு:
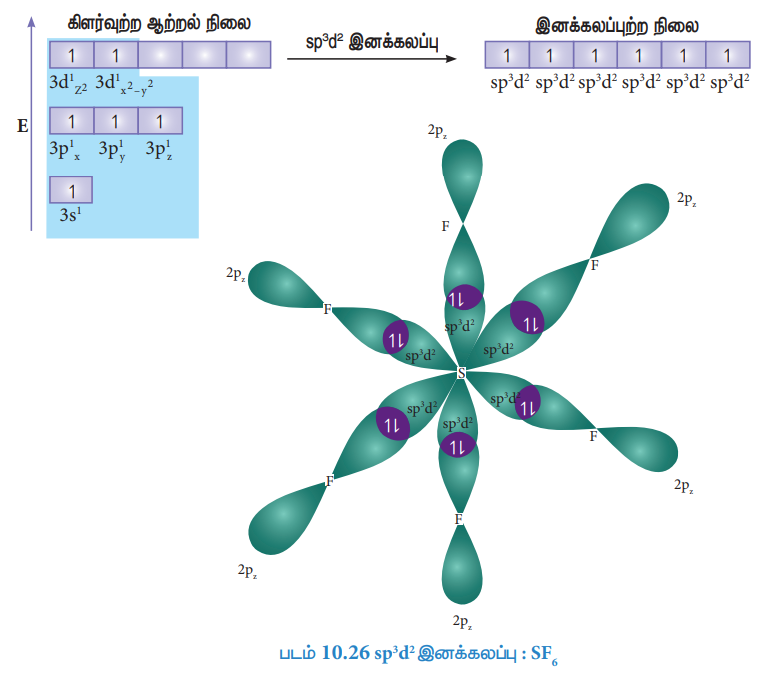
PCl5 போன்ற மூலக்கூறுகளில் மைய பாஸ்பரஸ் அணு ஐந்து குளோரின் அணுக்களுடன் சகப்பிணைப்பில் பிணைக்கப்பட்டுள்ளது. இங்கு பாஸ்பரஸின் அணு ஆர்பிட்டால்கள், அதாவது ஒரு 3s ஆர்பிட்டால் மூன்று 3p ஆர்பிட்டால்கள் மற்றும் ஒரு நிரப்பப்படாத 3d ஆர்பிட்டால் (dz2) ஆகியவைகள் sp3d இனக்கலப்பில் ஈடுபடுகின்றன. பாஸ்பரஸ் அணுவின் இயல்பு ஆற்றல் நிலையில் எலக்ட்ரான் அமைப்பு [Ne] 3s2 3p1x 3p1y 3p1z , (படம் 10.25) வில் காட்டப்பட்டுள்ளது. பாஸ்பரஸின் இரட்டை நிலையில் உள்ள 3s எலக்ட்ரானில் ஒன்று ஒரு காலியாக உள்ள 3d ஆர்பிட்டாலுக்கு (3dz2) கிளர்வுறுகின்றது. பாஸ்பரஸ் அணுவின் ஒரு 3s ஆர்பிட்டால், மூன்று 3p ஆர்பிட்டால்கள் மற்றும் ஒரு 3dz2 ஆர்பிட்டால் ஆகியன கலந்து ஐந்து சமமான sp3d ஆர்பிட்டால்களைத் தருகின்றன. Sp3d இனக்கலப்பு ஆர்பிட்டால்கள் முக்கோண இரு பிரமிடு வடிவமைப்பில் படத்தில் உள்ளவாறு அமைந்துள்ளன (படம் 10.25)
குளோரினின் 3Pz ஆர்பிட்டால்கள் மேற்பொருந்துதல்:
பாஸ்பரஸின் ஐந்து sp3d ஆர்பிட்டால்கள், ஐந்து குளோரின் அணுக்களின் 3pz ஆர்பிட்டால்களுடன் நேர்கோட்டில் மேற்பொருந்துவதால் ஐந்து P-Cl (σ) சகப்பிணைப்புகள் படத்தில் காட்டப்பட்டுள்ளவாறு உருவாகின்றன.
Sp3d2 இனக்கலப்பு:
சல்பர் ஹெக்சா ஃபுளுரைடு (SF6) மூலக்கூறில் மைய சல்பர் அணுவானது அதன் இணைதிறன் கூட்டினை விரிவாக்கி sp3d2 இனக்கலப்பிற்கு உட்பட்டு ஆறு சம ஆற்றலுடைய sp3d2 இனக்கலப்பு ஆர்பிட்டால்களை உருவாக்குகின்றன. இவைகள் ஆறு சமமான S-F (σ) சகப்பிணைப்புகள் உருவாக காரணமாகின்றன. சல்பர் அணுவின் இயல்பு ஆற்றல் நிலை எலக்ட்ரான் அமைப்பு [Ne]3s2 3p2x 3p1y 3p1z
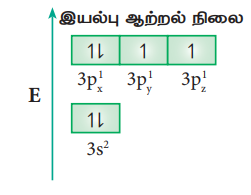
3s ஆர்பிட்டால் மற்றும் 3p ஆர்பிட்டால் ஆகிய ஒவ்வொன்றிலிரும் இருந்தும் ஒரு எலக்ட்ரான், காலியாக உள்ள 3d ஆர்பிட்டால்களுக்கு (dz2 மற்றும் dx2-y2)) கிளர்வுறுகின்றன. சல்பரின் இந்த ஆறு இணைதிற ஆர்பிட்டால்களும் (ஒரு 3s ஆர்பிட்டால், மூன்று 3p ஆர்பிட்டால்கள் மற்றும் இரண்டு 3d ஆர்பிட்டால்கள்) கலந்து ஆறு சமமான sp3d2 இனக் கலப்பு ஆர்பிட்டால்களைத் தருகின்றன. இந்த ஆர்பிட்டால்கள் படத்தில் காட்டப்பட்டுள்ளவாறு எண்முகி வடிவமைப்பினைக் பெற்றுள்ளன.
புளுரினின் 2pz ஆர்பிட்டால்கள் மேற்பொருந்துதல்:
சல்பரின் ஆறு sp3d2 இனக்கலப்பு ஆர்பிட்டால்கள் ஆறு புளூரினின் 2pz ஆர்பிட்டால்களுடன் நேர்கோட்டில் மேற்பொருந்தி சல்பர் ஹெக்சா புளுரைடில் ஆறு S-F பிணைப்புகளை உருவாக்குகின்றன.
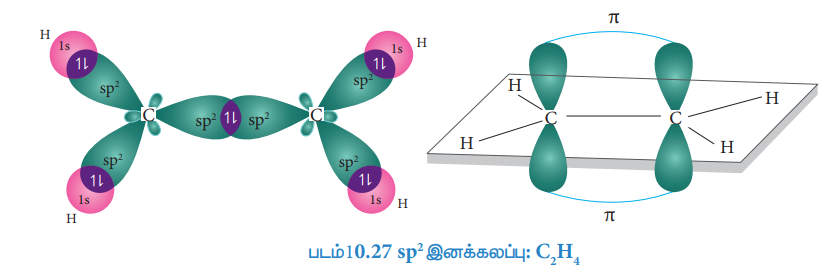
எத்திலீனில் காணப்படும் பிணைப்புகள்:
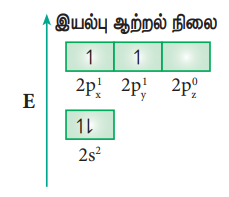
எத்திலீனில் பிணைப்பு உருவாதலை இனக்கலப்பாதல் கோட்பாட்டினைப் பயன்படுத்தி விளக்கலாம். எத்திலீனின் மூலக்கூறு வாய்பாடு C2H4 கார்பனின் இணைதிறன் நான்கு. அதன் இணைதிற கூட்டு எலக்ட்ரான் அமைப்பு இயல்பு ஆற்றல் நிலையில் [He] 2s2 2p1x 2p1y 2p0z. கார்பனின் நான்கு இணை திறனை நிறைவு செய்யும் பொருட்டு, 2s ஆர்பிட்டாலிலிருந்து ஒரு எலகட்ரானை 2pz ஆர்பிட்டாலுக்கு கிளர்வுறச் செய்க.
எத்திலீனில் உள்ள இரண்டு கார்பன் அணுக்களும் sp2 இனக்கலப்பாதலுக்கு உட்பட்டுள்ளன. கார்பனின் 2s, 2px மற்றும் 2py ஆகிய ஆர்பிட்டால்கள் ஒன்றோடொன்று கலந்து மூன்று சமமான sp2 இனக்கலப்படைந்த ஆர்பிட்டால்களை உருவாகின்றன. இந்த ஆர்பிட்டால்கள் ஒன்றுக்கொன்று 120° கோண இடைவெளியில் xy தளத்தில் அமைகின்றன. கார்பனின் இனக்கலப்படையாத 2Pz ஆர்பிட்டாலானது இந்த xy தளத்திற்கு செங்குத்தான திசையில் அமைகின்றது.
சிக்மா பிணைப்பு உருவாதல்:
மூலக்கூறு அச்சில் (x-அச்சு) அமைந்த ஒவ்வொரு கார்பன் அணுவின் ஒரு sp2 இனக்கலப்பு அடைந்த ஆர்பிட்டால்கள் ஒன்றோடொன்று நேர்கோட்டில் மேற்பொருந்தி C-C சிக்மா பிணைப்பினை உருவாக்குகிறது. இரண்டு கார்பன் அணுக்களின் மற்ற இரு sp2 இனக்கலப்படைந்த ஆர்பிட்டால்களும், நான்கு ஹைட்ரஜன் அணுக்களின் நான்கு 1s ஆர்பிட்டால்களுடன் நேர்கோட்டில் மேற்பொருந்துவதால், ஒவ்வொரு கார்பனும், ஹைட்ரஜனுடன் இரு C-H சிக்மா பிணைப்புகளை உருவாக்குகின்றன.
π- பிணைப்பு உருவாதல்
இரு கார்பன் அணுக்களில் காணப்படும் இனக்கலப்பாதலுக்கு உட்படாத இரு 2pz ஆர்பிட்டால்களும் மூலக்கூறு அச்சில் அமையாததால் பக்கவாட்டின் வழியாக மட்டுமே மேற்பொருந்த இயலும். இத்தகைய பக்கவாட்டு மேற்பொருந்துதலால் இரு கார்பன் அணுக்களுக்கும் இடையே படத்தில் காட்டியுள்ளவாறு ஒரு π பிணைப்பு உருவாகின்றது.
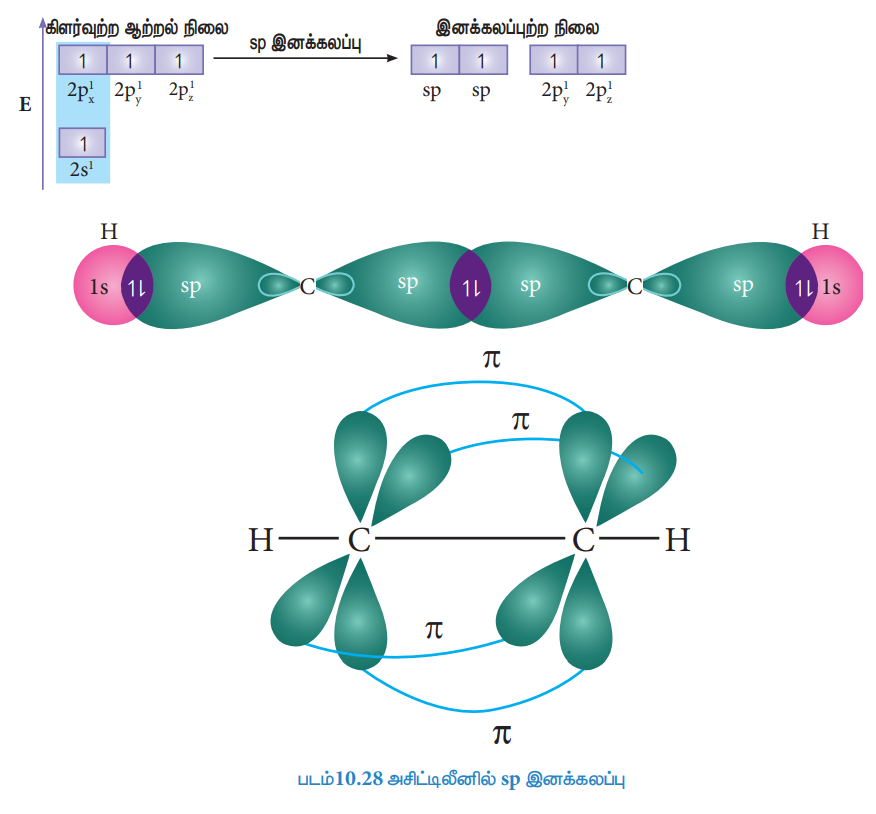
அசிட்டிலீனில் காணப்படும் பிணைப்புகள்:
எத்திலீனைப் போலவே, இனக்கலப்பாதல் கொள்கையினைப் பயன்படுத்தி அசிட்டிலீனில் பிணைப்பு உருவாதலை விளக்கலாம். அசிட்டிலீனின் மூலக்கூறு வாய்ப்பாடு C2H2. இயல்பு ஆற்றல் நிலையில் உள்ள கார்பனின் இணைதிற கூட்டின் எலக்ட்ரான் அமைப்பு [He] 2s2 2px1 2py1 2pz0. கார்பனின் நான்கு இணைதிறனை நிறைவு செய்யும் பொருட்டு 2s ஆர்பிட்டாலில் உள்ள ஒரு எலக்ட்ரானை 2pz ஆர்பிட்டாலுக்கு கிளர்வுறச் செய்க.
அசிட்டிலீன் மூலக்கூறில், இரு கார்பன் அணுக்ளும் Sp இனக்கலப்பு நிலையில் காணப்படுகிறது. அவற்றின் 2s மற்றும் 2px ஆர்பிட்டால்கள் ஒன்றோடோன்று கலந்து இரு சமமான sp இனக்கலப்படைந்த ஆர்பிட்டால்களை உருவாக்குகின்றன. இவைகள் மூலக்கூறு அச்சின் (x-அச்சு) வழியே நேர்கோட்டில் அமைகின்றன. இனக்கலப்பு அடையாத 2py மற்றும் 2pz ஆர்பிட்டால்கள் மூலக்கூறு அச்சிற்கு செங்குத்தாக அமைந்துள்ளன.
சிக்மா பிணைப்பு உருவாதல்:
ஒவ்வொரு கார்பனிலும் உள்ள ஒரு sp இனக்கலப்படைந்த ஆர்பிட்டால் ஒன்றோடொன்று நேர்கோட்டில் மேற்பொருந்தி ஒரு C-C சிக்மா பிணைப்பினை ஏற்படுத்துகின்றது. இரு கார்பன்களின் மற்றுமொரு sp இனக்கலப்பு ஆர்பிட்டால்களுடன் இரு ஹைட்ரஜன் அணுக்களின் இரு 1s ஆர்பிட்டால்கள் நேர்கோட்டில் மேற்பொருந்துவதால், ஒவ்வொரு கார்பன் அணுவும் ஒரு ஹைட்ரஜனுடன் ஒரு C-H சிக்மா பிணைப்பினை ஏற்படுத்துகின்றன.
பை பிணைப்பு உருவாதல்:
ஒவ்வொரு கார்பன் அணுவிலும் காணப்படும் இனக்கலப்டையாத 2py மற்றும் 2pz ஆர்பிட்டால்கள் பக்கவாட்டில் மேற்பொருந்துகின்றன. இதன் விளைவாக இரு கார்பன் அணுக்களுக்கிடையே இரு பை பிணைப்புகள்(py -py மற்றும் pz –pz) படத்தில் காட்டியுள்ளவாறு உருவாகின்றன.
தன் மதிப்பீடு
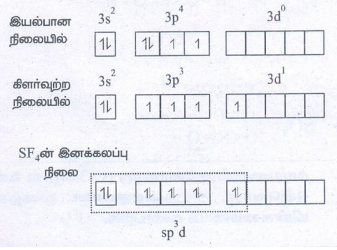
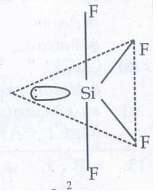
8. SF4 மற்றும் CCl4 ல் பிணைப்பு உருவாதலை இனக்கலப்பாதல் கொள்கையைப் பயன்படுத்தி விளக்குக.
தீர்வு:
● SF4 : S ன் எலக்ட்ரான் அமைப்பு
[Ne] 3S2, 3p4
வடிவம் : முக்கோண இரு பிரமிடு (ஒரு தனித்த இணை e- உட்பட)
வடிவம் : சீசா (ஊசலாட்ட அமைப்பு)
● CCl4 : C ன் எலக்ட்ரான்
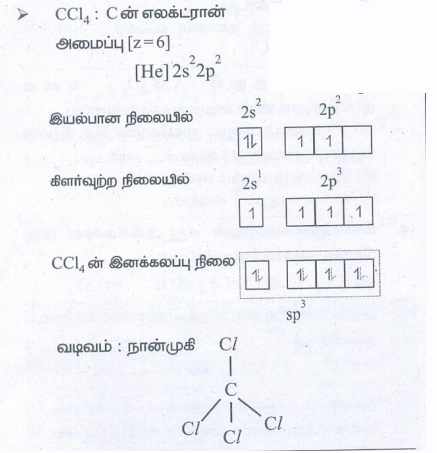
தன் மதிப்பீடு
9. N+2 ன் பிணைப்பு நீளமானது N2 ன் பிணைப்பு நீளத்தைக் காட்டிலும் அதிகமாக உள்ளது. அதே நேரத்தில் NO+ ன் பிணைப்பு நீளமானது NO வைக் காட்டிலும் குறைவு ஏன்?
தீர்வு:
a) N2 ன் (N ≡ N) பிணைப்பு தரம் = 10 – 4 / 2 = 3
N+2 ன் பிணைப்பு தரம் = 9 – 4 / 2 = 2.5
பிணைப்பு நீளம் α (1/ பிணைப்புத்தரம்)
● எனவே, N+2 ன் பிணைப்பு நீளம் N2 வை விட அதிகம்.
b) NO ன் பிணைப்புத்தரம் = 10 – 5 / 2 = 2.5
NO+ ன் பிணைப்புத்தரம் = 10 – 4 / 2 = 3
பிணைப்பு நீளம் α (1/ பிணைப்புத்தரம்)
● எனவே, NO+ ன் பிணைப்பு நீளம் NO வை விட குறைவு.