வேதிப் பிணைப்புகள் - VSEPR கொள்கை (இணைதிறன் எலக்ட்ரான் இரட்டை விலக்கல் கொள்கை) | 11th Chemistry : UNIT 10 : Chemical bonding
11 வது வேதியியல் : அலகு 10 : வேதிப் பிணைப்புகள்
VSEPR கொள்கை (இணைதிறன் எலக்ட்ரான் இரட்டை விலக்கல் கொள்கை)
VSEPR கொள்கை (இணைதிறன் எலக்ட்ரான் இரட்டை விலக்கல் கொள்கை)
மூலக்கூறுகளின் வடிவமைப்பு பற்றிய லூயிஸின் கொள்கையானது மூலக்கூறுகளில் அணுக்களின் இடம், மற்றும் அவைகளுக்கிடையே பங்கிடட்பட்ட எலக்ட்ரான்களின் எண்ணிக்கை ஆகியனவற்றைப் பற்றி விளக்குகிறது. எனினும் லூயிஸின் கொள்கையினைப் பயன்படுத்தி நம்மால் மூலக்கூறுகளின் வடிவமைப்பினை கணிக்க இயலாது. லூயிஸ் கொள்கையை VSEPR கொள்கையுடன் இணைத்துப் பயன்படுத்துவதன் மூலம் மூலக்கூறுகளின் வடிவத்தினை தீர்மானிக்க இயலும்,
VSEPR கொள்கையின் முக்கிய கோட்பாடுகள் பின்வருமாறு:
1. ஒரு மூலக்கூறின் வடிவமானது அதிலுள்ள மைய அணுவைச் சுற்றி காணப்படும் இணைதிற கூடு எலக்ட்ரான் இரட்டைகளின் எண்ணிக்கையினைப் பொருத்து அமைகிறது.
2. எலக்ட்ரான் இரட்டைகள் இருவகைப்படும். அவையாவன (i) பிணைப்பு எலக்ட்ரான் இரட்டைகள் (ii) தனித்த எலக்ட்ரான் இரட்டைகள். இரு அணுக்களுக்கிடையே பகிர்ந்து கொள்ளப்படும் எலக்ட்ரான் இரட்டைகள் ஆனவை பிணைப்பு எலக்ட்ரான் இரட்டைகள் எனப்படுகின்றன. அதே நேரத்தில் பிணைப்பில் ஈடுபடாத, இணைதிற எலக்ட்ரான் இரட்டைகள் ஆனவை தனித்த இரட்டைகள் எனப்படுகின்றன.
3. மைய அணுவினை சூழ்ந்துள்ள எலக்ட்ரான் இரட்டைகள் ஒவ்வொன்றும் தங்களுக்குள் ஒன்றையொன்று விலக்குகின்றன. எனவே, இந்த விலக்குவிசையினை எந்த அளவிற்கு சிறுமமாக்க இயலுமோ, அதற்கேற்றவாறு முப்பரிமாண வெளியில் அவைகள் விலகி அமைகின்றன.
4. வெவ்வேறு வகை எலக்ட்ரான் இரட்டைகளுக்கு இடையேயான விலக்குவிசை பின்வரும் வரிசையில் அமைகிறது.
lp - lp > lp – bp > bp - bp
lp- தனித்த இரட்டை (lone pair); bp பிணைப்பு இரட்டை (bond pair)

தனித்த இரட்டை எலக்ட்ரான்கள் என்பன மைய அணுவினை மட்டுமே சார்ந்து அமைந்திருக்கும். மேலும் அவைகள் ஒரே ஒரு அணுக்கருவோடு மட்டுமே இடையீடு செய்கின்றன. ஆனால் பிணைப்பு இரட்டை எலக்ட்ரான்கள் இரு அணுக்களுக்கு இடையே பங்கிடப்படுதலால் அவைகள் இரு அணுக்கருக்களோடும் இடையீடு புரிகின்றன. இதன் விளைவாக மூலக்கூறுகளில் உள்ள தனித்த இரட்டையானது பிணைப்பு இரட்டையைவிட அதிக இடத்தை ஆக்கிரமிக்கிறது. மேலும், அதிக விலக்கும் திறனையும் பெற்றுள்ளது.
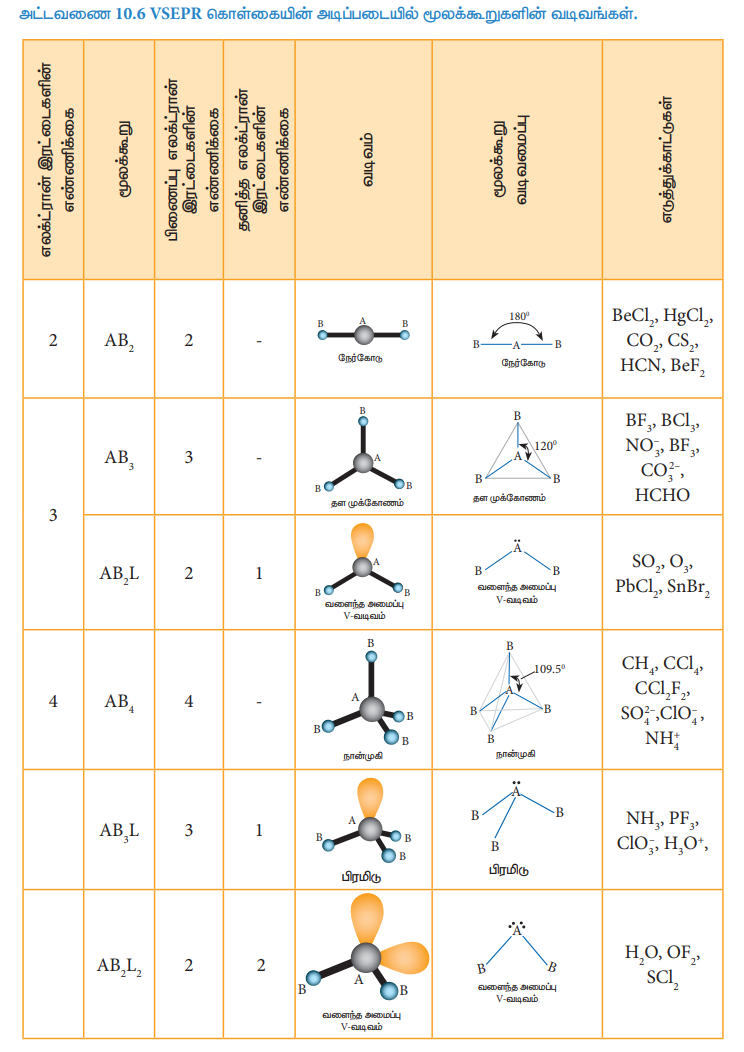
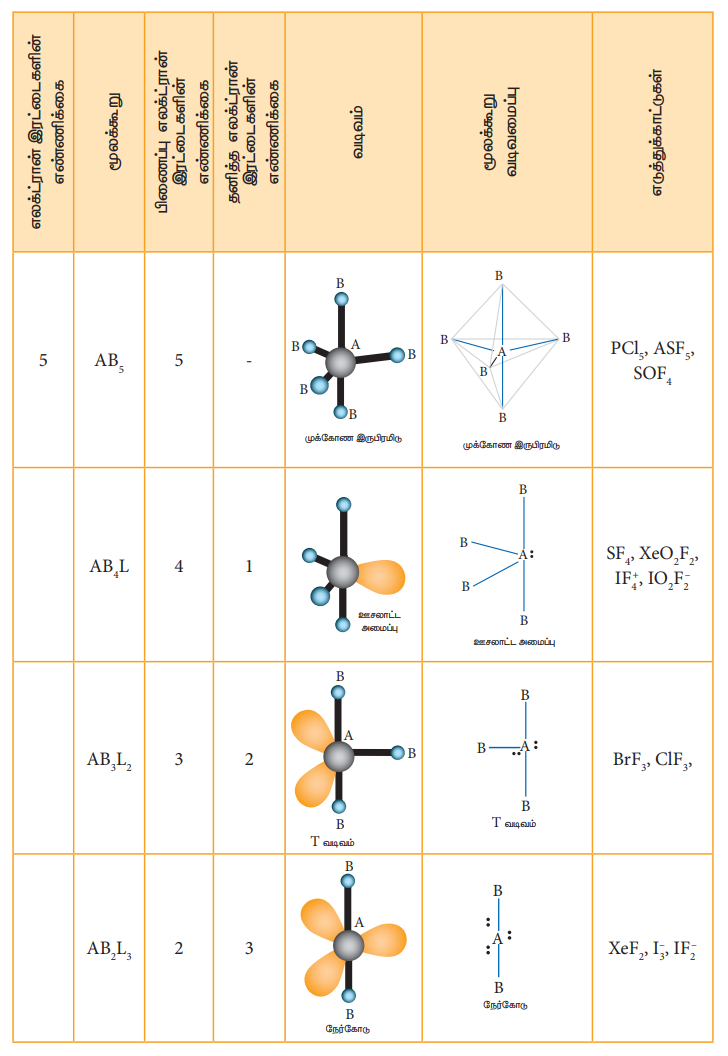
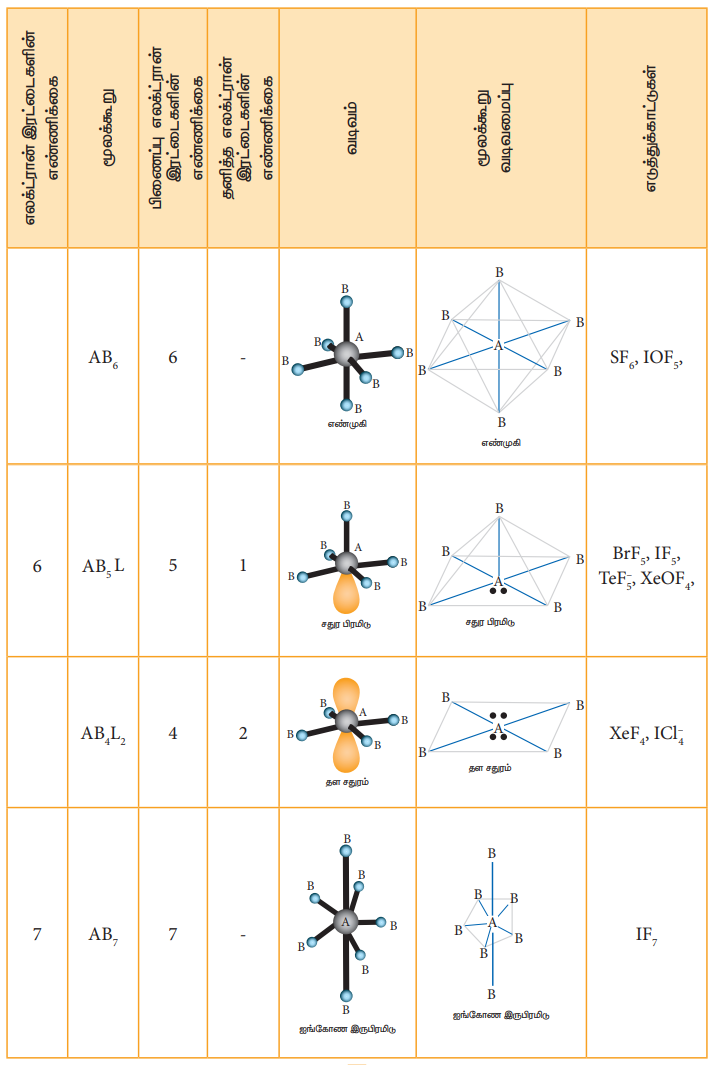
VSEPR கொள்கையின்படி மூலக்கூறுகளின் வடிவங்கள் தீர்மானிக்கப்படுதலைக் கீழ்கண்டுள்ள அட்டவணை விளக்குகிறது. ABx L என்ற மூலக்கூறினைக் கருதுவோம். இதில் A என்பது மைய அணுவையும், x என்பது A உடன் சகப்பிணைப்பால் பிணைக்கப்பட்டுள்ள B அணுக்களின் எண்ணிக்கையையும். L என்பது தனித்த எலக்ட்ரான் இரட்டையையும் குறிப்பிடுகின்றது.
அட்டவணை 10.6 VSEPR கொள்கையின் அடிப்படையில் மூலக்கூறுகளின் வடிவங்கள்.
தன்மதிப்பீடு:
6. பின்வரும் மூலக்கூறுகளை அவற்றின் பிணைப்புக் கோணங்களின் இறங்கு வரிசையில் வரிசைப்படுத்துக.
i) CH4, H2O, NH3
ii) C2H2, BF3, CCl4
தீர்வு:
● CH4 > NH3 > H2O
(109.5°) (107°) (104.5°)
● C2H2 > BF3 > CCl4
(180°) (120°) (109.5°)