அயனிச் சமநிலை | வேதியியல் - பின்வரும் வினாக்களுக்கு விடையளிக்க | 12th Chemistry : UNIT 8 : Ionic Equilibrium
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 8 : அயனிச் சமநிலை
பின்வரும் வினாக்களுக்கு விடையளிக்க
வேதியியல் : அயனிச் சமநிலை
II. பின்வரும் வினாக்களுக்கு விடையளிக்க
1. லூயி அமிலங்கள் மற்றும் காரங்கள் என்றால் என்ன? ஒவ்வொன்றிற்கும் இரண்டு எடுத்துக்காட்டுகள் தருக.
லூயி அமிலங்கள்
1. எலக்ட்ரான் இரட்டையை ஏற்றுக்கொள்ளும் சேர்மங்கள்
2. எ.கா : BF3, AICI3
லூயி காரங்கள்
1. எலக்ட்ரான் இரட்டையை வழங்கும் சேர்மங்கள்
எ.கா : NH3, H2O
2. அமிலங்கள் மற்றும் காரங்கள் பற்றிய லௌரிப்ரான்ஸ்டட் கொள்கையை விளக்குக.
• லௌரி-ப்ரான்ஸ்டட் அமிலங்கள் - புரோட்டான் வழங்கிகள்
• லௌரி-ப்ரான்ஸ்டட் காரங்கள் - புரோட்டான் ஏற்பிகள்
• அமிலம், ஒரு புரோட்டானை வழங்கிய பின் எஞ்சியுள்ள பகுதி காரம், (இணைகாரம்) ஆகும்
• காரம்2 ஒரு புரோட்டானை ஏற்ற பின் எஞ்சியுள்ள பகுதி அமிலம் 2 (இணை அமிலம்) ஆகும்.
• பொதுவாக, லௌரி-பிரான்ஸ்டட் அமில-கார வினையை பின்வருமாறு எழுதலாம்.
அமிலம்1 + காரம்2 ⇌ அமிலம்2 + காரம்1
(எ.கா) HCl = H2O ⇌ H3O + Cl-
(அமிலம்,) (காரம்,) (அமிலம்) (காரம்)

• ஒரு புரோட்டானால் மட்டும் வேறுபடும் வேதிக் கூறுகள் இணை அமில-கார இரட்டைகள் எனப் படுகின்றன.
வரம்புகள் : புரோட்டான்களை வழங்க இயலாத BF3, A1CI3 போன்ற சேர்மங்கள் அமிலங்கள் போல செயல்படுவதை இக்கொள்கை விளக்கவில்லை .
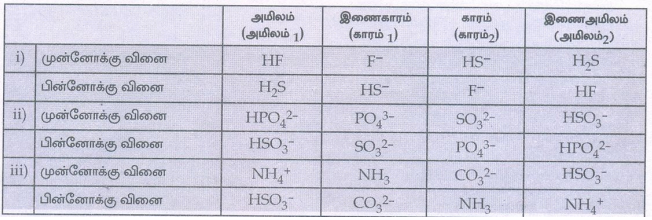
3. பின்வரும் நீரிய கரைசல்களில் நிகழும் வினைகளில் இணைஅமில-கார இரட்டைகளை கண்டறிக.
i) HS− (aq) + HF ⇌ F−(aq) + H2S(aq)
ii) HPO42− + SO32− ⇌ PO43− + HSO3−
iii) NH4+ + CO32− ⇌ NH3 + HCO3−
4. HCIO4 மூலக்கூறின் அமிலத்தன்மைக்கான காரணம் கூறு. ப்ரான்ஸ்டட்-லௌரி கொள்கையின் அடிப்படையில், அதன் இணை காரத்தை கண்டறிக.
• மிகவும் வலிமையான அமிலங்களுள் ஒன்று HCIO4 (பெர்குளோரிக் அமிலம்) ஆகும்.
• ஆக்சி அமிலங்களில் அதிக எண்ணிக்கையில் ஆக்சிஜன் காணப்பட்டால், O-H பிணைப்பு எலக்ட்ரான்கள் ஆக்சிஜனை நோக்கி அதிகமாக ஈர்க்கப்படுகின்றன.
• எனவே O-H பிணைப்பு எலக்டரான்கள் வலிமை குறைகிறது.
• ஆதலால் O-H பிணைப்பை உடைத்து H+ அயனியை வெளியேற்ற குறைவான ஆற்றலே போதுமானது.
• இதனால் HCIO4 ஒரு வலிமை மிகுந்த அமிலமாகும்.
• அத்தனிமத்தின் ஆக்சிஜனேற்ற எண் அதிகரிக்கும்போது அமிலத்தின் வலிமையும் அதிகரிக்கிறது.
• HCIO4-ல் குளோரின் அதன் அதிகபட்ச ஆக்சிஜனேற்ற நிலையான +7 ஐ பெற்றுள்ளது.
• எனவே HCIO4 ஒரு வலிமை மிகுந்த அமிலமாகும்.
• HCIO4ன் இணைகாரம் ClO4- ஆகும். ClO4- ஒரு வலிமை குறைந்த காரம் ஆகும்.
5. CusO4 கரைசலுடன் நீர்த்த அம்மோனியாவை சேர்க்கும் போது, டெட்ராஅம்மைன்காப்பர் (II) அணைவு உருவாவதால் கரைசல் அடர் நீல நிறமாக மாறுகிறது.
[Cu(H2 O)4 ]2+(aq) + 4NH3 (aq) ↔ [Cu(NH3)4 ] 2+ (aq) + H2O மற்றும் NH3 ஆகியவற்றில் எது வலிமைமிகு லூயி காரம்?
• [Cu(H2 O)4 ]2+(aq) + 4NH3 (aq) ↔ [Cu(NH3)4 ] 2+ (aq) + 4H2O
• ஆக்சிஜனை விட குறைந்த எலக்ட்ரான் கவர் தன்மை கொண்ட நைட்ரஜன் தனது தனித்த எலக்ட்ரான் இரட்டையை எளிதில் வழங்குவதால் NH3 ஒரு வலிமைமிகு லூயி காரம் ஆகும்.
• ஒரு வலிமையான லூயிகாரம் (ஈனி) முன்னிலையில் ஒரு லூயி அமிலம் (மைய உலோக அயனி) வலிமைகுறைந்த லூயிகாரத்தை (ஈனி) ஈனி பரிமாற்ற வினை மூலம் வெளியேற்றுகிறது.
• மேற்கண்ட வினையில் H2O லூயிகாரமானது, NH3 லூயிகாரத்தால் வெளியேற்றப்பட்டு ஈனி பரிமாற்ற வினை நிகழ்கிறது.
• லூயி அமிலம் Cu2+ வலிமை மிகு லூயிகாரம் NH3 உடன் வலிமை குறைந்த லூயிகாரம் H2O ஐ பரிமாற்றம் செய்து (Cu(NH3)4)2+ அயனியை உருவாக்குகிறது.
• எனவே NH3 ஒரு வலிமைமிகு லூயிகாரம். ஆகும். H2O ஒரு வலிமைகுறைந்த லூயிகாரம் ஆகும்.
6. ஒரு நீர்மாதிரியில் உள்ள ஹைட்ராக்சைடு அயனிச் செறிவு 2.5 × 10-6M என கண்டறியப்பட்டுள்ளது. கரைசலின் தன்மையை கண்டறிக.
[OH-] = 2.5 × 10-6M
pOH = -log10[OH-]
= -log 2.5 × 10-6
= -log 2.5 - log 10-6
= -log 2.5 + 6 log 10 = 6 - log.2.5
= 6 - 0.3979
pOH = 5.602
pOH7ஐ விட குறைவாக உள்ளதால் கரைசல் காரத்தன்மை உடையது ஆகும்.
7. ஒரு ஆய்வக உதவியாளர் 25°C வெப்பநிலையில், கணக்கிடப்பட்ட அளவுள்ள HCI வாயுவை சேர்த்து [H3O+] = 4 × 10-5 M செறிவு கொண்ட கரைசலை தயாரித்தார். அந்தக் கரைசல் நடுநிலைத் தன்மை கொண்டதா (அல்லது) அமிலத்தன்மை கொண்டதா (அல்லது) காரத்தன்மை கொண்டதா?
[H3+O+] = 4 × 10-5M
pH = -log10[H3O+]
=- log 4 × 10-5
= -log 4 - log 10-5
= - log 4 + 5 log 10
= 5 - log4
= 5 - 0.6021
pH = 4.3979
pH மதிப்பு 7ஐவிடக் குறைவு, எனவேகரைசல் அமிலத் தன்மையுடையது ஆகும்.
8. 0.04 M HNO3 கரைசலின் pH மதிப்பை கண்டுபிடி HNO3 ன் செறிவு = 0.04 M
[H3O+] = நார்மாலிட்டி
= மோலாரிட்டி × காரத்துவம்
= 0.04 × 1 = 0.04 = 4 × 10-2
pH = -log10[H30+]
= -log 4 × 10-2
= -log 4 - log 10-2
= -log 4 + 2 log 10
= 2 - log 4
= 2 - 0.6021
= 1.3979
pH ≈ 1.40
9. கரைதிறன் பெருக்கம் வரையறு.
சமன்படுத்தப்பட்ட சமநிலை சமன்பாட்டிலுள்ள வேதிவினைக்கூறு குணகங்களை அடுக்குகளாக கொண்ட, பகுதிக்கூறு அயனிகளின், மோலார் செறிவுகளின் பெருக்குத் தொகை கரைதிறன் பெருக்கம் என வரையறுக்கப்படுகிறது.
10. நீரின் அயனிப் பெருக்கம் வரையறு அறை வெப்ப நிலையில் அதன் மதிப்பை தருக.
• தூய நீரின் ஹைட்ரஜன் அயனிச் செறிவு மற்றும் ஹைட்ராக்சில் அயனிச் செறிவு ஆகியவற்றின் பெருக்கற்பலன் நீரின் அயனிப் பெருக்கம் எனப்படும்.
• KW = [H3O+] [OH-]
• மாறா வெப்பநிலையில் KW மதிப்பு ஒரு மாறிலி வெப்பநிலை உயரும்போது K.. மதிப்பும் உயர்கிறது.
• 25°Cv KW ன் மதிப்பு 1 x 10-14 mol2 dm-6
11. பொது அயனி விளைவை ஒரு எடுத்துக்காட்டுடன் விளக்குக.
• ஒரு வலிமை குறைந்த அமிலம் அல்லது காரத்தில், ஒரு பொது அயனியைக் கொண்ட அதன் உப்பை சேர்க்கும்போது அந்த அமிலம் அல்லது காரத்தின் பிரிகை வீதம் குறைவது பொது அயனி விளைவு எனப்படும்.
• வலிமை குறைந்த அமிலமான அசிட்டிக் அமிலம் பின்வருமாறு பகுதியளவு பிரிகையடைகிறது.
CH3COOH(aq) ⇌ H+(aq) + CH3COO-(aq)
• இதனுடன் சேர்க்கப்படும் சோடியம் அசிட்டேட் உப்பானது முழுமையாக பிரிகையடைந்து Na+ மற்றும் CH3COO- அயனிகளைத் தருகிறது. CH3COONa(aq) - CH3COO (aq)+ Na+(aq) இது ஒட்டுமொத்த CH,COO- அயனிச் செறிவை அதிகரிக்கச் செய்கிறது.
• இதனால் அசிட்டிக் அமில பிரிகையடைதல் சம நிலை பாதிக்கப்படுகிறது.
• லீசாட்லியர் கொள்கைப்படி இவ்விளைவை சரி செய்ய CH3COO- அயனிகள் H+ அயனி களுடன் இணைந்து அயனியுறாத CH3COOH ஐ உருவாக்குகிறது.
• எனவே சமநிலை இடது புறமாக நகருகிறது CH3COOH பிரிகையடைதல் குறைகிறது. இதுவே பொது அயனி விளைவாகும்.
12. ஆஸ்வால்ட் நீர்த்தல் விதிக்கான சமன்பாட்டைத் தருவி
• ஆஸ்வால்ட் நீர்த்தல் விதி என்பது, ஒரு வலிமை குறைந்த அமிலத்தின் பிரிகை மாறிலியை (Ka) அதன் பிரிகைவீதம் (a) மற்றும் செறிவுடன் (C) தொடர்படுத்தும் சமன்பாடாகும்.
• ஆஸ்வால்ட் நீர்த்தல் விதிப்படி, “நீர்த்தல் அதிகரிக்கும்போது, ஒரு வலிமை குறைந்த மின்பகுளியின் பிரிகை வீதமும் அதிகரிக்கிறது''.
• பிரிகை வீதம் ɑ = பிரிகையடைந்த மோல்களின் எண்ணிக்கை / மொத்த மோல்களின் எண்ணிக்கை
• வலிமை குறைந்த அமிலம் CH3COOHன் பிரிகையடைதலை கருதுவோம்.
CH3COOH ⇌ H+ + CH3COO-

13. pH வரையறு.
ஒரு கரைசலின் pH என்பது அக்கரைசலில் உள்ள ஹைட்ரோனியம் அயனிகளின் மோலார் செறிவின், 10ஐ அடிப்படையாக கொண்ட எதிர் குறி மடக்கை மதிப்பு என வரையறுக்கப் படுகிறது.
pH = - log10 [H3O+]
14. 1.5 × 10-3 M Ba(OH)2 கரைசலின் pH மதிப்பை கணக்கிடுக.
Ba(OH)2 ன் அமிலத்துவம் = 2
நார்மாலிட்டி = மோலாரிட்டி × அமிலத்துவம்
= 1.5 × 10-3 × 2
= 3 × 10-3
எனவே [OH-] = நார்மாலிட்டி = 3 × 10-3
pOH = -log [OH-]
= -log 3 × 10-3
= - log 3 - log 10-3
= -log3 + 3 log 10
= 3 - log3
= 3 - 0.4771
pOH = 2.5229
pH + pOH = 14
pH = 14 - pOH
= 14 - 2.5229
= 11.4771
pH ≈ 11.48
15. 50ml கன அளவுடைய 0.025 M KOH கரைசலுடன் 50ml கன அளவுடைய 0.05 M HNO; கரைசல் சேர்க்கப்படுகிறது. இறுதியில் பெறப்பட்ட கரைசலின் pH மதிப்பை கணக்கிடுக.
மில்லிமோல்கள் = Vமிலி × மோலாரிட்டி
HNO3 ன் மில்லி மோல்கள் = 50 × 0.05 = 2.5
KOHன் மில்லிமோல்கள் = 50 × 0.025 = 1.25
இரு கரைசல்களையும் சேர்த்த பின், மீதமுள்ள HNO3 ன் மில்லி மோல்கள் = 2.5 - 1.25 = 1.25 மொத்த கன அளவு = 50 + 50 = 100 மிலி
மோலாரிட்டி = மில்லிமோல்கள் / Vமிலி = 1.25 / 100
மோலாரிட்டி = 1.25 × 10-2
HNO3 ன் காரத்துவம் = 1
ஃ நார்மாலிட்டி = மோலாரிட்டி × காரத்துவம்
= 1.25 × 10-2 × 1
=1.25 × 10-2
ஃ [H3O+] = 1.25 × 10-2
pH = -log[H3O+]
= -log 1.25 × 10-2
= -log 1.25 - log 10-2
= - log 1.25 + 2 log 10
= 2 - log 1.25
= 2 - 0.0969
pH = 1.9031
16. HCN இன் Ka மதிப்பு 10-9 எனில் 0.4 M HCN கரைசலின் pH மதிப்பு என்ன?
Ka = 10-9;C= 0,4 M : pH = ?
HCN ஒரு வலிமை குறைந்த அமிலம்
ஃ [H3O+] = Cɑ = √Ka.C = √10-9 × 0.4
= √4 × 10-9
= 2 ×
10-5
pH = -log10[H3O+] = -log2 × 10-5
= -log2 - log10-5
= -log2 + 5 log 10 = 5 - log 2,
= 5 - 0.3010
pH = 4.6990
17. 0.1 M அம்மோனியம் அசிட்டேட் கரைசலின் நீராற் பகுப்பு வீதம் மற்றும் pH மதிப்பை கணக்கிடுக. Ka = Kb = 1.8 × 10-5 என கொடுக்கப்பட்டுள்ளது.
Ka = Kb = 1.8 × 10-5
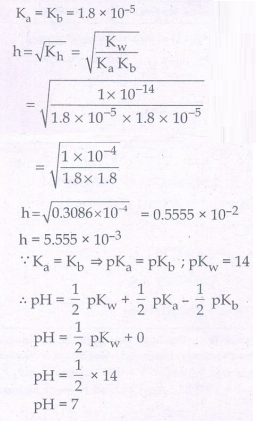
pH = 7
18. வலிமைமிகு அமிலம் மற்றும் வலிமை குறைந்த காரத்திலிருந்து உருவாகும் உப்பின் நீராற்பகுத்தல் மாறிலி மற்றும் நீராற்பகுத்தல் வீதம் ஆகியவற்றிற்கான சமன்பாடுகளை தருவி.
• ஒரு வலிமை மிகு அமிலம் HCI மற்றும் ஒரு வலிமை குறைந்த காரம் NHOH ஆகியவை வினைபுரிந்து உப்பு NH4C1 மற்றும் நீர் உருவாகும் வினையை கருதுவோம்.
HCl(aq) + NH4OH(aq) ⇌ NH4Cl(aq) + H2O(l)
• நீர்க் கரைசலில் NH4Cl முற்றிலும் பிரிகையடைகிறது.
NH4Cl(aq) → NH4 +(aq) + Cl-(aq)
• வலிமை குறைந்த காரம் NH4OH ன் வலிமை மிக்க இணை அமிலம் NH4+ அயனிகளாகும்.
• எனவே NH4+அயனிகள் நீரிலிருந்து உருவாக்கப்பட்ட OH- அயனியுடன் வினை புரிந்து அயனியுறா NH4OH காரத்தை உருவாக்கும் திறனைப் பெற்றுள்ளது.
NH+4(aq) + H2O(l) ⇌ NH4OH(aq) + H+(aq)
• இத்தகைய திறனை CI- அயனி பெறவில்லை .
• மேற்கண்ட வினையில்H+ அயனிகள் உருவாகின்றன.
• எனவே [H+] > [OH-]; கரைசல் அமிலத்தன்மை யுடையது, அதன் pH 7 ஐ விட குறைவு
• மேற்கண்ட சமநிலை வினையின் சமநிலை *மாறிலி (நீராற் பகுத்தல் மாறிலி)
Kh = [NH4OH][H+] / NH4+][H2O]
Kh = [NH4OH][H+] / NH4+] -------(1)
• வலிமை குறைந்த காரம் NH4OH ன் பிரிகை சமநிலை
NH4OH(aq) ⇌ NH4+(aq) + OH-(aq)

இந்த நேர்வில் Kh மற்றும் Kb க்கு இடையேயுள்ள தொடர்பு
Kh Kb = [H+] [OH-]
Kh Kb = Kw
Kh = Kw / Kb
• ஆஸ்வால்ட் நீர்த்தல் விதியில் பெறப்பட்டதைப் போல, நீராற்பகுத்தல் வீதம் h ஐ பெறலாம்.
Kh = Ch2
ஃ h2 = kh/C
h = √ Kh / C

19. Ag2CrO4 ன் கரைதிறன் பெருக்க மதிப்பு 1 × 10-12 ஆகும். 0.01 M AgNO3 கரைசலில் Ag2Cro4 ன் கரைதிறனை கணக்கிடுக.
Ag2CrO4 → 2Ag+ + CrO42-
கரைதிரன்
AgNO3 → Ag+ + NO3-
செறிவு 0.01M 0.01M 0.01M
[Ag+] = 2 S + 0.01
ஃ 0.01>>2S, எனவே2S புறக்கணிக்கத்தக்கது
ஃ [Ag+] = 0.01 = 1 × 10-2 .
[CrO4-] = S; Ksp = 1 × 10-12
ஃ Ksp = [Ag+]2 [Cro42-]
1 × 10-12 = (1 × 10-2)2 × s
ஃS = 1 × 10-12 / 1 × 10-4 ⇒ S = 1 × 10-8M
20. Ca3(PO4)2 இன் கரைதிறன் பெருக்கத்திற்கான சமன்பாட்டை எழுதுக.
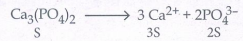
Ksp= [Ca2+]3 [PO43-]2
Ksp= (3s)3 (2s)2
Ksp = 27 S3 4s2
Ksp = 108 S5
21. CaF2(s) ஐ நீரில் கரைத்து ஒரு தெவிட்டிய கரைசல் தயாரிக்கப்படுகிறது. அக்கரைசலில் [Ca2+] = 3.3 × 10-4 M எனில், Caf2 Ksp மதிப்பு என்ன?
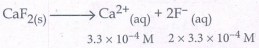
Ksp = [Ca2+] [F-]2
= (3.3 × 10-4) (2 × 3.3 × 10-4)2
= 3.3 × (6.6)2 × 10-4 × 10-8
= 143.748 × 10-12
Ksp = 1.44 × 10-10 M3
22. . AgCl ன் Ksp மதிப்பு 1.8 × 10-10 எனில், 1 M AgNO3 கரைசலில் மோலார் கரைதிறனைக் கணக்கிடுக.
Ksp = 1.8 × 10-10 [AgNO3] =1M
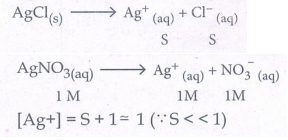
[Ag+] = S+1 = 1 = 1 (S<<1)
[Cl-] = S
Ksp = [Ag+] [Cl-]
1.8 × 10-10 =1 × S
ஃ S = 1.8 × 10-10 M
23. சில்வர் குரோமேட்டின் ஒரு குறிப்பிட்ட தெவிட்டிய கரைசலானது பின்வரும் செறிவுகளை கொண்டு உள்ள து. [Ag+] = 5 × 10-5 மற்றும் [CrO42-] = 4.4 × 10-4 M.. Ag2CrO4ன் Ksp மதிப்பு என்ன?
Ag2CrO4(s) ⇌ 2Ag+(aq) + CrO42−(aq)
[Ag+] = 5 × 10-5M
[CrO42-] = 4.4 × 10-4M
Ksp= ?
Ksp= [Ag+]2 [CrO42-]
= (5 × 10-5)2 (4.4 × 10-4)
Ksp =1.1 × 10-12 M3
24. Hg2Cl2 இன் கரைதிறன் பெருக்கத்திற்கான சமன்பாட்டை எழுதுக.
Hg2Cl2 ⇌ Hg22+ + 2Cl−
s s 2s
Ksp = [Hg22+] [Cl-]2
= S(2S)2
Ksp = 4s3
25. Ag2CrO4 ன் கரைதிறன் பெருக்க மதிப்பு 1.1 × 10-12 ஆகும் 0.1 MK2CrO4 கரைசலில் Ag2CrO4ன் கரைதிறன் என்ன?
Ksp =1.1 × 10-12 [K2CrO4] = 0.1 M
S =?
Ag2CrO4 ⇌ 2Ag+ + CrO42−
x 2x x
K2CrO4 ⇌ 2K+ + CrO42−
0.1 M 0.2 M 0.1 M
[Ag+] = 2S
[CrO42−] = (x + 0.1) ≈ 0.1 ∵ x < < 0.1
Ksp = [Ag+]2 [CrO42−]
1.1 × 10−12 = (2x)2 (0.1)
1.1 × 10−12 = 0.4 x2
x2 = [1.1×10−12] / 0.4 ; x = √[1.1 × 10−12] / [0.4]
x = √(2.75 × 10−12)
x = 1.65 × 10−6 M
26. 0.150L கன அளவுடைய 0.1 M Pb(NO3)2 மற்றும் 0.100 1 கன அளவுடைய 0.2 M NaCl கரைசல் ஆகியவற்றை ஒன்றாக கலக்கும்போது வீழ்படிவு உருவாகுமா? Ksp (PbCl2) = 1.2 × 10-5.
மொத்த கன அளவு = 0.150 + 0.100 = 0.250 L
Pb(NO3)2 ⇌ Pb2+ + 2NO−3
0.1 M 0.1M 0.2 M
Pb2+ன் மோல்கள் = V × M
= 0.150 × 0.1
கரைசல்கள் ஒன்றாக கலந்தபின் [Pb2+]
= Pb2+ ன்மோல்கள் / மொத்த கனஅளவு
= ( 0.150 × 0.1) / (0.250) = 0.06M
Cl-ன்மோல்கள் =V × M
= 0.100 × 0.2
கரைசல்கள் ஒன்றாக கலந்தபின் [Cl-]
= Cl-ன் மோல்கள் / மொத்த கன அளவு
= 0.100 × 0.2 / 0.250 = 0.08M
கரைசல்கள் கலந்த பின் [Pb2+]
= 0.06 M; [Cl-] = 0.08 M
PbCl2 ⇌ Pb2+ + 2Cl-
அயனிப் பெருக்கம் = [Pb2+] [Cl-]2
= (0.06) (0.08)2
= 3.84 × 10-4
Ksp மதிப்பு = 1.2 × 10-5
அயனிப்பெருக்கம் >Ksp
ஃ எனவே PbCl2 வீழ்படிவு உருவாகும்.
27.Al(OH)3 ன் Ksp மதிப்பு 1 × 10-15 M. NH4Cl மற்றும் NH4OH தாங்கல் கரைசலை சேர்க்கும் போது எந்த pH மதிப்பில் 1.0 × 10-3M A13+ வீழ்படிவாகும்?
Al(OH)3 ⇌ Al3+(aq) + 3OH-(aq)
Ksp = [A13+] [OH-]3 அயனிப் பெருக்கம் > Ksp எனில்
Al(OH)3 வீழ்படிவாதல் நிகழ
அதாவது (A13+] [OH-]3 >Ksp
(1 × 10-3) [OH-]3 >1 × 10-15
[OH-]3 > (1 × 10-15) / (1 × 10-3)
[OH-]3 > 1 × 10-12
[OH-] > 1 × 10-4
[OH-] > 1 × 10-4M
ஃpOH = -log[OH-]
= -log 1 × 10-4
pOH = 4
ஃ pH = 14 - pOH = 14 - 4 =10
pH =10 ல் A1(OH)3 வீழ்படிவாகும்.