ஆஸ்வால்ட் நீர்த்தல் விதி | அயனிச் சமநிலை | வேதியியல் - வலிமை குறைந்த அமிலங்களின் அயனியாதல் | 12th Chemistry : UNIT 8 : Ionic Equilibrium
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 8 : அயனிச் சமநிலை
வலிமை குறைந்த அமிலங்களின் அயனியாதல்
வலிமை குறைந்த அமிலங்களின் அயனியாதல்
வலிமை குறைந்த அமிலங்கள் நீரில் பகுளியளவே பிரிகையடைகின்றன. மேலும், பிரிகையடையாத அமிலத்திற்கும், பிரிகையடைந்த அயனிகளுக்கும் இடையே சமநிலை நிலவுகிறது என்பதையும் நாம் முன்னரே கற்றோம்.
நீரில், ஒரு வலிமை குறைந்த ஒற்றைகார அமிலத்தின் (HA) அயனியாதலை கருதுக.
HA + H2O = H3O+ + A-
வேதிச் சமநிலை விதிகளை பயன்படுத்தி, பெறப்பட்ட சமநிலை மாறிலிக்கான Kc சமன்பாடு
Kc = [H3O+] [A- ] / [HA] [H2O] ......(8.9)

வழக்கம்போல சதுர அடைப்புகுறிகளானவை அயனிக்கூறுகளின் செறிவை மோல்/லிட்டர் அலகில் குறிப்பிடுகின்றன.
நீர்க்கப்பட்ட கரைசல்களில், நீர் மிக அதிகளவில் உள்ளதால் அதன் செறிவை மாறிலியாக (K என்க) கருதலாம். மேலும், ஹைட்ரஜன் அயனியானது நீரேற்றம் பெற்றுள்ளது என்பதை [H3O+ ] காட்டுகிறது, இதை எளிமையாக்கி H+ என குறிப்பிடலாம். மேற்காண் சமன்பாட்டை கீழ்காணுமாறு எழுதலாம்,

Kc = [H+] [A-] / [HA] × K ..... (8.10)
மாறிலிகள் Kc மற்றும் K ஆகியவற்றின் பெருக்குத்திறன் மற்றொரு மாறிலியை தருகிறது. அதை Ka என்க,

Ka = [H+] [A-] / [HA] ... (8.11)
Ka என்பது அமிலத்தின் பிரிகை மாறிலி என்றழைக்கப்படுகிறது. மற்ற சமநிலை மாறிலிகளைப் போலவே Ka வும் வெப்பநிலையை மட்டும் சார்ந்து மாறுகிறது. அதேபோல, ஒரு வலிமை குறைந்த காரத்திற்கான பிரிகை மாறிலியை பின்வருமாறு எழுதலாம்.
Ka = [B+][OH-] / [BOH] .....(8.12)
ஆஸ்வால்ட் நீர்த்தல் விதி
ஆஸ்வால்ட் நீர்த்தல் விதியானது, ஒரு வலிமை குறைந்த அமிலத்தின் பிரிகை மாறிலியை (Ka) அதன் பிரிகை வீதம் (α) மற்றும் செறிவுடன் (c) தொடர்புபடுத்துகிறது. ஒரு சேர்மத்தின் மொத்த மோல் எண்ணிக்கையில், சமநிலையில் பிரிகையடைந்த மோல்களின் பின்னம், பிரிகை விதம் (α) என்றழைக்கப்படுகிறது.
ɑ = பிரிகையடைந்த மோல்களின் எண்ணிக்கை / மொத்த மோல்களின் எண்ணிக்கை

ஒரு வலிமை குறைந்த அமிலம், அதாவது அசிட்டிக் அமிலத்தை (CH3 COOH) எடுத்துக்காட்டாக கொண்டு ஆஸ்வால்ட் நீர்த்தல் விதிக்கான சமன்பாட்டை நாம் வருவிப்போம். அசிட்டிக் அமிலத்தின் பிரிகையடைதலை பின்வருமாறு குறிப்பிடலாம்
CH3 COOH ↔ H+ + CH3 COO-
அசிட்டிக் அமிலத்தின் பிரிகை மாறிலி,
Ka = [H+] [CH3 COO-] / [CH3 COOH] ..... (8.13)
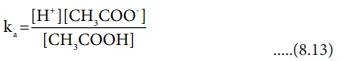
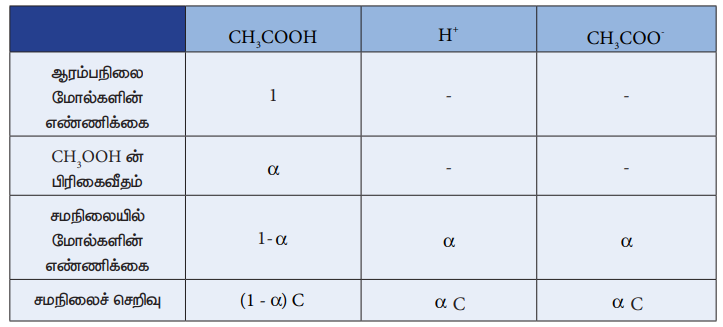
சமன்பாடு (8.13) இல் சமநிலைச் செறிவை பிரதியிட
Ka = (αC)( αC) / (-α)C
Ka = α2C / 1-α ......(8.14)

வலிமை குறைந்த அமிலமானது மிகக் குறைந்தளவே பிரிகையடைகிறது என்பதை நாம் அறிவோம். எண் ஒன்றுடன் ஒப்பிடும்போது α மதிப்பு மிகச்சிறியது.எனவே, சமன்பாட்டின் விகுதியிலுள்ள (1 - α) = 1. இப்போது சமன்பாடு (8.14) பின்வருமாறு எழுதலாம்
Ka = α2C
⇒ α2= Ka / C
α=√ Ka / C .....(8.15)

Ka மதிப்பு 4 × 10-4 எனக் கொண்ட ஒரு அமிலத்தை கருத்திற்கொண்டு, மேற்கண்ட சமன்பாட்டை (8.15) பயன்படுத்தி, 1× 10-2M மற்றும் 1× 10-4M ஆகிய இருவேறு செறிவுகளில் அந்த அமிலத்தின் பிரிகை வீதத்தை கணக்கிடுவோம்.
செறிவு 1 × 102M,
α = √4 × 10-4 / 10-2
= √4 × 10-2
= 2 × 10-1
= 0.2
1 × 10-4 M அமிலச்செறிவிற்கு,
α = √4 × 10-4 / 10-4
= 2
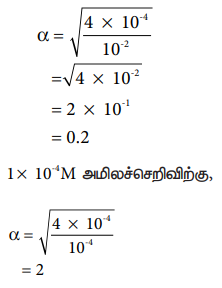
அதாவது, நீர்த்தலை 100 மடங்கு அதிகரிக்கும்போது, (செறிவு 1 × 10-2 Mலிருந்து 1 × 10-4 ஆக குறைகிறது), பிரிகையாதலானது 10 மடங்கு அதிகரிக்கிறது.
அதாவது, "நீர்த்தல் அதிகரிக்கும்போது, ஒரு வலிமை குறைந்த மின்பகுளியின் பிரிகை வீதமும் அதிகரிக்கிறது எனும் முடிவுக்கு நம்மால் வரமுடியும். இந்த கூற்றானது ஆஸ்வால்ட் நீர்த்தல் விதி என அறியப்படுகிறது.
Ka மதிப்பை பயன்படுத்தி H+ (H3O+) அயனிச் செறிவை கீழ்காணுமாறு கணக்கிட முடியும்.
[H+] = αc (அட்டவணையை பார்க்க) ....(8.16)
[H+] அயனியின் சமநிலைச் மோலார் செறிவானது α C க்கு சமம்.
[ஃ சமன்பாடு (8.15)]
ஃ [H+] = (√Ka / C) C
= √Ka C2 / C
[H+] = √KaC ....(8.17)
இதே போல, ஒரு வலிமை குறைந்த காரத்திற்கு
Kb = α2 C மற்றும் α = √Kb / C
[OH-] = αC
அல்லது
[OH-] = √Kb C ......(8.18)

எடுத்துக்காட்டு 8.4
ஒரு வலிமை குறைந்த மின்பகுளியின் 0.10M செறிவுடைய கரைசல் 25°C ல் 1.20% வரை பிரிகையடைகிறது என கண்டறியப்பட்டுள்ளது. அமிலத்தின் பிரிகை மாறிலி மதிப்பை காண்க.
கொடுக்கப்பட்டது α =1.20% = 1.20/100 = 1.2×10-2
Ka = α2C
= (1.2 × 10-2) 2 (0.1) =1.44 × 10 -4 × 10-1
= 1.44 × 10-5
எடுத்துக்காட்டு 8.5
0.1M CH3COOH கரைசலின் pH மதிப்பை கணக்கிடுக. அசிட்டிக் அமிலத்தின் பிரிகை மாறிலி மதிப்பு 1.8 × 10-5
pH = -log [H+ ]
வலிமை குறைந்த அமிலங்களில்
[H+ ] = √Ka × C
= √1.8 × 10-5 × 0.1
= 1.34 × 10-3M pH = - log (1.34×10-3)
= 3 - log 1.34
= 3 - 0.1271
= 2.8729 ≈ 2.87
தன்மதிப்பீடு - 7
NH4OH ன் Kb மதிப்பு 1.8 × 10-5 எனில், 0.06M அம்மோனியம் ஹைட்ராக்சைடு கரைசலின் அயனியாதல் சதவீதத்தை கணக்கிடுக.
விடை :
α = √(Kb / C) = 1.8 ×10-5 / 6 × 10-2
= √ 3×10-4
= 1.732 × 10-2
= 1.732 / 100 = 1.732%