அயனிச் சமநிலை | வேதியியல் - தன்மதிப்பீடு - தீர்வுகள் | 12th Chemistry : UNIT 8 : Ionic Equilibrium
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 8 : அயனிச் சமநிலை
தன்மதிப்பீடு - தீர்வுகள்
III. தன்மதிப்பீடு வினாக்கள்
1. 'அரீனியஸ் கொள்கையை பயன்படுத்தி பின் வருவனவற்றை அமிலம் (அல்லது) காரம் என வகைப்படுத்துக.
i) HNO3
ii) Ba(OH)2
iii) H3PO4
iv) CH3COOH
அமிலம் :
i) HNO3
iii) H3PO4
iv) CH3COOH;
காரம் :
ii) Ba(OH)2
2. பின்வருவனவற்றிற்கு, அவற்றின் நீர்க்கரைசலில் பிரிகையடைதலுக்கான சமன்படுத்தப்பட்ட சமன் பாட்டை எழுதுக. மேலும், இணை அமில - கார இரட்டைகளை கண்டறிக.
i) NH4+
ii) H2SO4
iii) CH3COOH
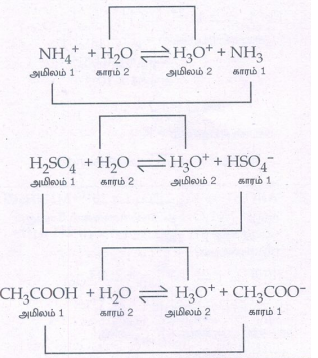
NH4+ + H2O ⇌ H3O+ + NH3
அமிலம் l காரம் 2 அமிலம் 2 காரம் 1
H2SO4 + H2O ⇌ H3O+ + HSO4-
அமிலம் l காரம் 2 அமிலம் 2 காரம் 1
CH3COOH + H2O ⇌ H3O+ + CH3COO-
அமிலம் l காரம் 2 அமிலம் 2 காரம் 1
3. பின்வரும் வினைகளில் லூயி அமிலம் மற்றும் லூயி காரங்களை கண்டறிக.
i) CaO + CO2 → CaCO3
ii) CH3- O- CH3 + AlCl3 →
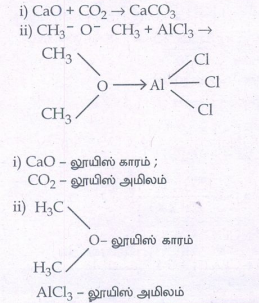
i) CaO - லூயிஸ் காரம் ;
CO2 - லூயிஸ் அமிலம்
AlCl3லூயிஸ் அமிலம்
4. கீழே குறிப்பிடப்பட்டுள்ளவாறு H3BO3 மூலக் கூறானது நீரிடமிருந்து ஹைட்ராக்சைடு அயனியை ஏற்றுக்கொள்கிறது. H3BO3(aq) + H2O(l) ⇌ B(OH)4- + H+ லூயி கொள்கையை பயன்படுத்தி H3BO3 மூலக்கூறின் தன்மையை கண்டறிக.
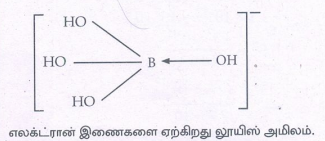
எலக்ட்ரான் இணைகளை ஏற்கிறது லூயிஸ் அமிலம்.
5. ஒரு குறிப்பிட்ட வெப்பநிலையில் ஒரு நடுநிலைக் கரைசலின் Kw மதிப்பு 4 × 10-14 எனில் [H3O+] மற்றும் [OH-] அயனிச் செறிவுகளை கணக்கிடுக [OH]
கொடுக்கப்பட்ட கரைசல் நடுநிலைத் தன்மை யுடையது.
ஃ [H3O]+ '= [OH-] Let [H3O+] = x; எனக் கருதினால் [OH-] = x
Kw = [H3O+] [OH-]
4 × 10-14 =X.X
x2 = 4 × 10-14
X = √4 × 10-14
6. அ) 10-8 M செறிவுடைய H2SO4 அமிலத்தின் pH மதிப்பை கணக்கிடுக.
ஆ) pH = 5.4 எனக் கொண்ட ஒரு கரைசலின் ஹைட்ரஜன் அயனிச் செறிவை மோல்/ லிட்டர் அலகில் கணக்கிடுக.
இ) 50ml 0.2M HCI உடன் 50ml 0.1 M NaOH ஐ கலந்த பின் கிடைக்கும் நீர்கரைசலின் pH மதிப்பை கணக்கிடுக.
அ) விடை :
H2SO4 ன் செறிவு மிகக் குறைவாக உள்ளதால்
[H3O+] ன் செறிவு தள்ளத் தக்கதல்ல.
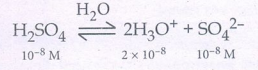
[H3O+] = 2 × 10-8 (H2SO4 லிருந்து) +10-7 (நீரிலிருந்து)
= 10-8 (2 + 10)
= 12 × 10-8 =1.2 × 10-7
pH =- log10(H3O+)
= -log10(1.2 × 10-7)
= 7 -log10 1.2
= 7 - 0.0791 = 6.9209
ஆ) விடை :
கரைசலின் pH = 5.4
[H3O+] = antilog of (-pH)
= antilog of (-5.4)
= antilog of (-6 +0.6)
= 6 -.6 = 3.981 × 10-6
i.e., 3.98 × 10-6 mol dm-3
இ) விடை :
HCl மோல்களின் எண்ணிக்கை
= 0.2 × 50 × 10-3 = 10 × 10-3
NaOHன் மோல்களின் எண்ணிக்கை
= 0.1 × 50 × 10-3 = 5 × 10-3
கலந்த பின் HCl மோல்களின் எண்ணிக்கை
= 10 × 10-3 - 5 × 10-3
= 5 × 10-3
கலந்த பின் மொத்த கனஅளவு = 100 mL
ஃ HCl ன் செறிவு மோல்
= 5 × 10-3 mole / 100 × 10-3 L ; [H3O+] = 5 × 10-2M
pH = - log(5 × 10-2)
= 2 – log 5
= 2 - 0.6990 = 1.30
7. NH4OH ன் Kb மதிப்பு 1.8 × 10-5 எனில் 0.06M அம்மோனியம் ஹைட்ராக்சைடு கரைசலின் அயனியாதல் சதவீதத்தை கணக்கிடுக.
α = √[Kb / C ] = √[1.8 × 10−5 ] / [ 6 × 10−2 ] = √(3 × 10-4)
= 1.732 × 10−2
%ɑ = 1.732 × 10-2 × 100 = 1.732%
8. அ)சமமோலார் அம்மோனியம் ஹைட்ராக்சைடு மற்றும் அம்மோனியம் குளோரைடை கொண்டுள்ள ஒரு காரத் தாங்கல் கரைசலின் தாங்கல் செயல் முறையை விளக்குக.
ஆ) 0.4MCH3COOH மற்றும் 0.4M CH3 COONa ஆகியவற்றைக் கொண்டுள்ள ஒரு தாங்கல் கரைசலின் pH மதிப்பை கணக்கிடுக 500ml மேற்கண்ட கரைசலுடன் 0.01 மோல் HCl ஐ சேர்த்த பின்பு pH ல் மாற்றம் என்ன? (Ka = 1.8 × 10-5) HCI ஐ சேர்ப்பதினால் ஏற்படும் கன அளவு மாற்றத்தை ஒதுக்கத்தக்கதாக கருதுக.
அ) விடை :
தாங்கல் கரைசலின் பிரிகையின் பகுதிகள்
NH4OH(aq) ⇌ NH4+(aq) + OH-(aq)
NH4Cl → NH4 + Cl-
அயனியை சேர்க்கும் போது
H+ அயனிகள் NH4OH ஆல் நடுநிலையாக்கப் படுகிறது. எனவே pH ல் குறிப்பிடத்தக்க மாற்றமில்லை .
NH4OH(aq) + H+ - NH4+(aq) + H2O(1) OH- அயனியை சேர்க்கும் போது
NH4+(aq) + OH-(aq) → NH4OH(aq) OH- அயனிகள் NH4+ உடன் வினைபுரிந்து NH4OH ஐ தருகின்றது.
NH4OH ஒரு வலிமை குறைகாரம் என்பதால் pH ல் குறிப்பிட்டத்தக்க மாற்றம் இல்லை.
ஆ) விடை :
தாங்கல் கரைசலின் pH

9. அ) 0.1M NH4OH கரைசல் மற்றும் அம்மோனியம் குளோரைடு படிகங்கள் உன்னிடம் கொடுக்கப் பட்டால், pH = 9 எனக் கொண்ட தாங்கல் கரைசலை எவ்வாறு தயாரிப்பாய்? (25°C ல் NH4OH PKb மதிப்பு 4.7)
ஆ) 100ml 0.8M ஃபார்மிக் அமிலத்துடன் எவ்வளவு கன அளவு 0.6M சோடியம் ஃபார்மேட் கரைசல் கலந்து pH மதிப்பு 4.0 கொண்ட ஒரு தாங்கல் கரைசலை தயாரிப்பாய் (ஃபார்மிக் அமிலத்தின் pKa மதிப்பு 3.75.)
அ) விடை :
pOH = pKb + log [உப்பு] / [காரம் ]
என நாம் அறிவோம்
pH + pOH = 14
ஃ9 + pOH = 14
⇒ pOH =14 – 9 = 5
5 = 4.7 +
log [NH4Cl] / ]NH4OH]
0.3 log [NH4Cl]
/0.1
[NH4Cl]
/0.1 = antilig of (0.3)
[NH4Cl] = 0.1 M × 1.995
= 0.1995 M = 0.2 M
1லிட்டர் 0.2 M கரைசல் தயாரிக்க தேவையான NH4Clன் நிறை
= NH4CI ன் திறன் × NH4CI ன் மூலக்கூறு எடை = 0.2 × 53.5 = 10.70 g
10.70g அம்மோனியம் குளோரைடை நீரில் கரைத்து ஒரு லிட்டர் கரைசலாக்கப்பட்டு 0.2m கரைசல் தயாரிக்கப்படுகிறது. NH4OH மற்றும் தயார்செய்யப்பட்ட NH4CI கரைசல் இரண்டினையும் சமஅளவில் கலக்கும் போது உருவாகும் தாங்கல் கரைசலின் pH மதிப்பானது தேவையான pH மதிப்பாகும்.
ஆ) விடை :
pH = pKa + log[உப்பு]/[அமிலம்]
4 =
3.75 + log [சோடியம் பார்மேட்/[பார்மிக் அமிலம்]
(சோடியம் பார்மேட்) = HCOONa ன்
மோல்களின் எண்ணிக்கை = 0.6 × V × 10-3
[பார்மிக் அமிலம் ] = HCOOH ன்
மோல்களின் எண்ணிக்கை = 0.8 × 100 × 10-3
= 80 × 10-3
4 =
3.75 + log (0.6V)/(80)
0.25 =
log (0.6V)/(80)
antilog
of 0.25 = 0.6V/80
0.6V =
1.778 × 80
= 1.78
× 80
142.4
V =
142.4mL/0.6 = 237.33mL
10. HCO3- அயனியின் pKa மதிப்பு 10.26 எனில், 0.05M திறனுடைய சோடியம் கார்பனேட் கரைசலின்
i) நீராற்பகுத்தல் மாறிலி
ii) நீராற்பகுத்தல் வீதம் மற்றும்
iii) pH ஆகியவற்றைக் கணக்கிடுக.
சோடியம் கார்பனேட் வலிமை குறைந்த அமிலம் H2CO3 மற்றும் வலிமை மிக்க காரம் NaOH ஆகியவற்றின் உப்பு ஆகும். எனவே நீராற் பகுப்பில் காரக் கரைசலைத் தருகிறது.
Na2CO3(aq) → 2Na+(aq) + CO32-(aq)
CO32-(aq) + H2O(l) ⇌ HCO-3 + OH-
- log Ka = 10.26
log Ka = - 10.26
Ka = Antilog of - 10.26
= Antilog of - 10 - 0.26.
= Antilog of - 10 - 0.26 + 1 -1
= Antilog of - 11 + 0.74
= Antilog of 11.74
Ka = 5.495 × 10 -11
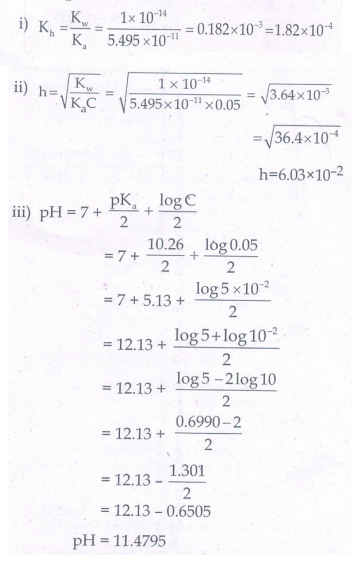
= 12.13 -0.6505
pH = 11.4795