அயனிச் சமநிலை | வேதியியல் - pH அளவீடு | 12th Chemistry : UNIT 8 : Ionic Equilibrium
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 8 : அயனிச் சமநிலை
pH அளவீடு
pH அளவீடு
பொதுவாக 10-1M முதல் 10-7M வரையிலான செறிவுகளைக் கொண்ட அமில, கார கரைசல்களை நாம் பயன்படுத்துகிறோம். இத்தகைய குறைவான செறிவுகளில் வலிமையை குறிப்பிடுவதற்காக, சோரன்சன் என்பவர் pH அளவீடு எனப்படும் மடக்கை அளவீட்டை புகுத்தினார். pH எனும் சொற்கூறானது Purissance de hydrogene' பிரஞ்சு மொழிச் சொல்லிலிருந்து வருவிக்கப்பட்டதாகும். இதன் பொருள்,” The power of hydrogen- ஹைட்ரஜனின் வலிமை”. ஒரு கரைசலின் pH என்பது அக்கரைசலில் உள்ள ஹைட்ரோனியம் அயனிகளின் மோலார் செறிவின், 10ஐ அடிப்படையாக கொண்ட எதிர்குறி மடக்கை மதிப்புகள் என வரையறுக்கப்படுகிறது.
pH = - log10[H3O+] ...... (8.5)
pH மதிப்பு தெரிந்த ஒரு கரைசலிலுள்ள H3O+ அயனிச் செறிவை பின்வரும் சமன்பாடுயை பயன்படுத்தி கணக்கிட முடியும்.
[H3O+] = 10-pH (or) [H3O+] = antilog (-pH) .. (8.6)
இதே போல, pOH ஐயும் பின்வருமாறு வரையறுக்கலாம்
pOH = - log 10 [OH- ] .... (8.7)
முன்னரே விவாதித்தபடி, நடுநிலைக் கரைசல்களில், [H3O+], [OH-) செறிவுகள் 25°C இல் 1×10-7M க்கு சமமாக இருக்கும். இந்த H3O+ செறிவை சமன்பாடு (8.5) இல் பிரதியிடுவதன் மூலம் ஒரு நடுநிலைக் கரைசலின் pH மதிப்பை கணக்கிடலாம்.

pH = - log 10 [H3O+]
= - log 10 10-7
= (-7) (-1) log 10 10 = +7 (1) = 7 [ஃ log 10 10=1]
இதேபோல, சமன்பாடு (8.7) ஐ பயன்படுத்தி ஒரு நடுநிலைக் கரைசலின் pOH மதிப்பை நாம் கணக்கிட முடியும். இதன் மதிப்பும் 7 க்கு சமமாக உள்ளது.
சமன்பாடு (8.5) யிலுள்ள எதிர்குறியானது [H3O+] செறிவு அதிகரிக்கும்போது கரைசலின் pH மதிப்பு குறையும் என்பதை காட்டுகிறது. எடுத்துக்காட்டாக, [H3O+] செறிவு 10-7 லிருந்து 10-5 M ஆக அதிகரிக்கும்போது, கரைசலின் pH மதிப்பு 7 லிருந்து 5 ஆக குறைகிறது. அமிலக் கரைசலில், [H3O+] > [OH-), அதாவது [H3O+] > 10-7 . இதேபோல, காரக் கரைசலில் [H3O+] < 10-7. எனவே, அமிலக்கரைசலானது 7 ஐவிட குறைந்த pH மதிப்பை கொண்டிருக்க வேண்டும், மற்றும் காரக் கரைசலானது 7 ஐவிட அதிகமான pH மதிப்பை கொண்டிருக்க வேண்டும்.
pH மற்றும் pOH ஆகியவற்றிற்கிடையே உள்ள தொடர்பு
பின்வரும் வரையறைகளை பயன்படுத்தி pH மற்றும் pOH க்கு இடையேயான தொடர்பை நிறுவ முடியும்.
pH = - log 10[H3O+] .... (8.5)
pOH = - log 10[OH-] ..... (8.7)
சமன்பாடுகள் (8.5) மற்றும் (8.7) ஆகியவற்றை கூட்ட
pH + pOH = - log 10[H3O+] - log 10[OH-]
= -( log 10[H3O+] - log 10[OH-])
pH+pOH = log 10[H3O+] [OH-] [ஃ log a+ log b = logab]
நாமறிந்தபடி [H3O+] [OH-] = Kw
⇒ pH + pOH = - log 10 Kw
⇒ pH + pOH = pKw [ஃ pKw = - log 10 Kw] ....(8.8)
25°C இல் நீரின் சய அயனி பெருக்கம், Kw =1×10-14
pKw = - log 10 10-14 = 14 log 1010
= 14
ஃ (8.7) ⇒ At 25°C, pH + pOH= 14
எடுத்துக்காட்டு 8.2
0.001M HCl கரைசலின் pH மதிப்பை கணக்கிடுக
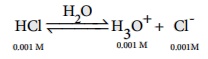
103-M HCIயில் உள்ள [H3O+] செறிவுடன் ஒப்பிடும்போது, நீரின் சுய அயனியாக்கத்திலிருந்து உருவாகும் [H3O+] (10-7 M) செறிவு ஒதுக்கத்தக்கது.
எனவே [H3O+] = 0.001 mol dm-3
pH = - log 10[H3O+]
= - log 10 (0.001)
= - log 10 (10-3) = 3
குறிப்பு: ஒரு அமிலம் அல்லது காரத்தின் செறிவு 10-6 M ஐவிட குறைவாக இருந்தால், நீரின் சுய அயனியாக்கத்திலிருந்து உருவாகும் H3O+ செறிவை நாம் ஒதுக்க இயலாது. இத்தகைய நேர்வுகளில்
[H3O+] + = 10-7(நீரிலிருந்து) + H3O+ ( அமிலத்திலிருந்து).
இதேபோல, [OH-] = 10-7 M (நீரிலிருந்து) + [OH-] (காரத்திலிருந்து)
எடுத்துக்காட்டு 8.3
10-7 M HCl ன் pH மதிப்பை கணக்கிடுக.
H2O அயனியாவதிலிருந்து உருவாகும் [H3O+] + கருத்தில் கொள்ளாத போது
[H3O+] = [HCl] = 10-7 M
i.e.,pH=7, இது நடுநிலைக் கரைசலின் pH மதிப்பாகும். HCl கரைசலின் செறிவு எதுவாயினும் அக்கரைசல் அமிலத்தன்மை கொண்டது என்பதை நாம் அறிவோம். அதாவது pH மதிப்பு 7 ஐ விட குறைவாக இருத்தல் வேண்டும். இந்த நேர்வில் அமிலத்தின் செறிவு மிகக் குறைவு (10-7 M) எனவே, நீரின் சுய அயனியாக்கத்திலிருந்து உருவாகும் [H3O+] (10-7 M) செறிவை நாம் ஒதுக்க முடியாது.
எனவே, இதில் நீரின் சுய அயனியாக்கத்திலிருந்து உருவாகும் [H3O]+ செறிவை கருத்தில் கொள்ள வேண்டும்.
[H3O+] = 10-7 (நீரிலிருந்து) + [H3O+] ( HCl அமிலத்திலிருந்து)
= 10-7 (1+1) = 2×10-7
pH = - log 10 [H3O+]
= - log 10 (2×10-7) = - [log 2 + log 10-7 ]
= -log2-(-7). log 1010
=7 - log2
= 7- 0.3010 = 6.6990
= 6.70
தன்மதிப்பீடு - 6
அ) 10-8 M செறிவுடைய H2SO4 அமிலத்தின் pH மதிப்பை கணக்கிடுக.
ஆ) pH =5.4 எனக்கொண்ட ஒரு கரைசலின் ஹைட்ரஜன் அயனிச் செறிவை மோல்/ லிட்டர் அலகில் கணக்கிடுக.
இ) 50ml 0.2 M HCI உடன் 50 ml 0.1 M NaOH ஐ கலந்த பின் கிடைக்கும் நீர்கரைசலின் pH மதிப்பை கணக்கிடுக.