அயனிச் சமநிலை | வேதியியல் - கரைதிறன் பெருக்கம் | 12th Chemistry : UNIT 8 : Ionic Equilibrium
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 8 : அயனிச் சமநிலை
கரைதிறன் பெருக்கம்
கரைதிறன் பெருக்கம்
கனிம பண்பறி பகுப்பாய்வில், பல்வேறு வீழ்படிவாதல் வினைகளை, நாம் கடந்து வந்துள்ளோம். எடுத்துக்காட்டாக, நீரில் மிகக்குறைந்தளவே கரையும் தன்மையை பெற்றுள்ள, PbCl2 லிருந்து Pb2+ அயனிகளை வீழ்படிவாக்குவதற்கு நீர்த்த HCl பயன்படுத்தப்படுகிறது. நீண்ட காலத்திற்கு Ca2+ (கால்சியம் ஆக்ஸலேட் போன்றவை.) அயனிகள் வீழ்படிவாவதால் சிறுநீரக கற்கள் உருவாகின்றன. வீழ்படிவாதலை புரிந்து கொள்வதற்காக, மிகக் குறைந்தளவு கரையும் உப்பு மற்றும் கரைசலிலுள்ள அதன் அயனிகள் ஆகியவற்றிற்கிடயே நிலவும் கரைதிறன் சமநிலையை கருதுவோம்.
XmYn எனும் ஒரு பொதுவான உப்பிற்கு,
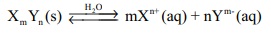
மேற்கண்ட வினைக்கான சமநிலை மாறிலி
K = [Xn+]m [Ym-]n / [XmYm]
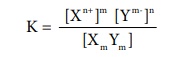
கரைதிறன் சமநிலையில், சமநிலை மாறிலியானது கரைதிறன் பெருக்க மாறிலி (அல்லது) கரைதிறன் பெருக்கம் என குறிப்பிடப்படுகிறது.
இத்தகைய பலபடித்தான சமநிலையில், திண்மப்பொருளின் செறிவு ஒரு மாறிலியாகும். எனவே அது சமன்பாட்டிலிருந்து நீக்கப்படுகிறது.
Ksp = [×n+]m [Ym-]n
சமன்படுத்தப்பட்ட சமநிலை சமன்பாட்டிலுள்ள வேதிவினைக்கூறு குணகங்களை அடுக்குகளாக கொண்ட, பகுதிக்கூறு அயனிகளின், மோலார் செறிவுகளின் பெருக்குத்தொகை கரைதிறன் பெருக்கம் என வரையறுக்கப்படுகிறது.
குறிப்பிட்ட அயனிச்சேர்மத்தின் பகுதிக்கூறு அயனிகளைக் கொண்டுள்ள கரைசல்களை ஒன்றாக கலக்கும்போது அந்த அயனிச்சேர்மம் வீழ்படிவாகுமா? என்பதை தீர்மானிக்க இந்த கரைதிறன் பெருக்க மதிப்புகள் உதவுகின்றன.
பகுதிக்கூறு அயனிகளின் மோலார் செறிவுகளின் பெருக்கற்பலன், அதாவது அயனிப் பெருக்க மதிப்பானது, கரைதிறன் பெருக்க மதிப்பை விட அதிகமாக உள்ள போது சேர்மம் வீழ்படிவாகிறது.
கரைதிறன் பெருக்கம் மற்றும் அயனிப் பெருக்கம் இரண்டிற்கான சமன்பாடுகளும் ஒரே மாதிரியாக உள்ளன, ஆனால், கரைதிறன் பெருக்க சமன்பாட்டில் உள்ள மோலார் செறிவுகளானவை சமநிலை செறிவுகளை குறிப்பிடுகின்றன. மேலும், அயனிப்பெருக்க சமன்பாட்டில் துவக்கச் செறிவுகள் (அல்லது) ஒரு குறிப்பிட்ட நேரம் t' யில் உள்ள செறிவுகள் பயன்படுத்தப்படுகின்றன.
பொதுவாக, இதை கீழ்காணுமாறு சுருக்கமாக கூறலாம்,
அயனிப் பெருக்கம் > Ksp , மீதெவிட்டிய கரைசல், வீழ்படிவாதல் நிகழும்.
அயனிப் பெருக்கம் < Ksp, தெவிட்டாக் கரைசல், வீழ்படிவாதல் நிகழாது. அயனிப் பெருக்கம் = Ksp , தெவிட்டியக் கரைசல், சமநிலை நிலவுகிறது.
எடுத்துக்காட்டு 8.9
1 mL 0.1M லெட் நைட்ரேட் கரைசல் மற்றும் 0.5 mL 0.2 M NaCl கரைசல் ஆகியவற்றை ஒன்றாக கலக்கும்போது லெட் குளோரைடு வீழ்படிவாகுமா? வீழ்படிவாகாதா? என கண்டறிக. PbC12 இன் Ksp மதிப்பு 1.2 × 10-5
அயனிப்பெருக்கம் = [Pb2+] [Cl-]2
மொத்த கனஅளவு = 1.5 mL
Pb(NO3)2 ↔ Pb2+ + 2NO3-
0.1M 0.1M
Pb2+ ன் மோல் எண்ணிக்கை = மோலாரிட்டி × கரைசலின் கனஅளவு லிட்டரில்
= 0.1×1×10-3 = 10-4
[Pb2+ ] = Pb2+ ன் மோல்களின் எண்ணிக்கை / கரைசலின் கன அளவு
= 10-4 / 1.5 ×10-3 mL = 6.7 × 10-2M
NaCl → Na+ +C1-
0.2M 0.2M 0.2M
Cl -ன் மோல் எண்ணிக்கை = 0.2 × 0.5 × 10-3 = 10-4
[Cl-] = 10-4 moles / 1.5 × 10-3 L = 6.7 × 10-2M
அயனிப்பெருக்க மதிப்பு = (6.7 × 10-2) (6.7× 10-2) 2 = 3.01 × 10-4

அயனிப்பெருக்க மதிப்பு 3.01 × 10-4 ஆனது கரைதிறன் பெருக்க மதிப்பை (1.2 × 10-5) விட அதிகமாக இருப்பதால் PbCl2 வீழ்படிவாகிறது.
மோலார் கரைதிறன் மதிப்பிலிருந்து கரைதிறன் பெருக்க மதிப்பை நிர்ணயித்தல்
கரைதிறன் பெருக்க மதிப்பை மோலார் கரைதிறன் மதிப்பிலிருந்து கணக்கிட முடியும். மோலார் கரைதிறன் என்பது ஒரு லிட்டர் கரைசலில் கரையக்கூடிய கரைபொருளின் அதிகபட்ச மோல் எண்ணிக்கை ஆகும். XmYn எனும் கரைபொருளுக்கு,
XmYn (s) ↔ mXn+ (aq) +nYm- (aq)
மேற்காண் விகிதக்கூறு சமன்படுத்தப்பட்ட சமன்பாட்டிலிருந்து, 1மோல் XmYn (s) பிரிகையடைந்து 'm' மோல்கள் Xn+ அயனிகளையும், 'n ' மோல்கள் Ym- அயனிகளையும், உருவாக்குகிறது என்பதை நாம் அறிகிறோம். 'S' என்பது XmYn, இன் மோலார் கரைதிறன் எனில்
[Xn+] = ms மற்றும் [Ym-] = ns
ஃKsp = [Xn+)m (Ym-)n
Ksp = (ms)m (ns)n
Ksp = (m)m (n)n (s)m+n
எடுத்துக்காட்டு 8.10
பின்வருவனவற்றிற்கு, கரைதிறன் பெருக்கம் மற்றும் மோலார் கரைதிறன் ஆகியவற்றிற்கிடையே உள்ள தொடர்பை நிறுவுக.
a. BaSO4
b.Ag2 (CrO4 )
BaSO4 (s) ←H2O→ Ba2+ (aq) + SO42-(aq)
Ksp =[Ba2+ ][SO42-]
= (s) (s)
Ksp = S2
Ag2 CrO4 (s) ←H2O→ 2Ag + (aq) + CrO42-(aq)
Ksp = [Ag+ ]2[CrO42-]
= (2s)2 (s)
Ksp =4s3