11வது இயற்பியல் : அலகு 8 : வெப்பமும் வெப்ப இயக்கவியலும்
பாயில் விதி, சார்லஸ் விதி மற்றும் நல்லியல்பு வாயு விதி - பருப்பொருளின் வெப்பப்பண்புகள்
பருப்பொருளின் வெப்பப்பண்புகள்:
பாயில் விதி, சார்லஸ் விதி மற்றும் நல்லியல்பு வாயு விதி:
பருமன் V கொண்ட கொள்கலனில் குறைந்த அழுத்தத்தில் (அடர்த்தி) உள்ள வாயு ஒன்றினைக் கொண்டு நிகழ்த்தப்பட்ட சோதனையிலிருந்து பின்வரும் முடிவுகள் கிடைக்கின்றன.
· மாறா வெப்பநிலையிலுள்ள வாயு ஒன்றின் அழுத்தம், அதன் பருமனுக்கு எதிர்விகிதத்திலிருக்கும் P ∝ 1/V. இதனை இராபர்ட் பாயில் (Robert Boyle) என்பவர் (1627-1691) கண்டறிந்தார். எனவே இவ்விதி பாயில்விதி என அழைக்கப்படுகிறது.
· மாறா அழுத்தத்திலிருந்து வாயு ஒன்றின்பருமன், அதன் வெப்பநிலைக்கு (கெல்வின்) நேர்த்தகவிலிருக்கும். V ∝ T இதனை ஜாக்ஸ் சார்லஸ் (Jacques Charles) (1743-1823) என்பவர் கண்டறிந்தார். எனவே இவ்விதி சார்லஸ்விதி என்று அழைக்கப்படுகிறது.
· இவ்விரண்டு விதிகளையும் ஒன்றிணைக்கும்போது பின்வரும் சமன்பாடு கிடைக்கும். PV = CT இங்கு C என்பது நேர்க்குறி கொண்ட மாறிலியாகும். இந்த நேர்க்குறி மாறிலி C கொள்கலனிலுள்ள துகள்களின் எண்ணிக்கைக்கு நேர்விகிதத்தில் இருக்கும் என்பதை பின்வரும் விவாதத்தின் மூலம் அறியலாம். ஒத்த பருமன் V, அழுத்தம் P மற்றும் வெப்பநிலை T, கொண்ட ஒரே வகையான வாயுவால் இவ்விரண்டு கொள்கலன்களும் நிரப்பப்பட்டுள்ளன என்க. இரண்டு கொள்கலனிலும் உள்ள வாயு மேலே குறிப்பிட்டுள்ள PV = CT என்ற சமன்பாட்டின்படி செயல்படும். இவ்விரண்டு தனித்தனியான கொள்கலனையும் படம் 8.2 இல் காட்டியுள்ளவாறு ஒரே அமைப்பாகக் கருதினால் அவ்வாயுவின் அழுத்தம் மற்றும் வெப்பநிலை ஒரே மதிப்பினைப் பெறும் ஆனால் பருமனும் மற்றும் வெப்பநிலை துகள்களின் எண்ணிக்கையும் இரண்டு மடங்காகும்
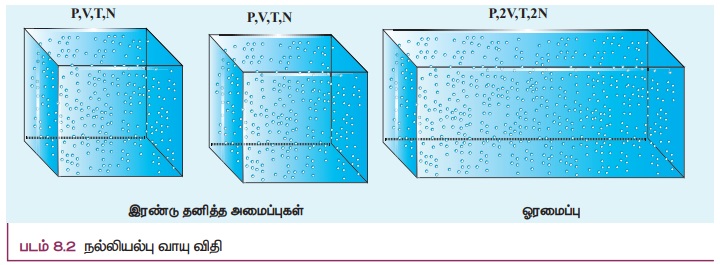
ஆகவே வாயுவின் பருமன் 2V மற்றும் துகள்களின் எண்ணிக்கை 2C. எனவே நல்லியல்பு வாயுச் சமன்பாடு P(2V) / T = 2C. இச்சமன்பாடு நமக்கு உணர்த்துவது என்னவென்றால் நேர்க்குறி மாறிலி C கண்டிப்பாக வாயுவிலுள்ள துகள்களின் எண்ணிக்கையை சார்ந்திருக்கும் என்பதாகும்.
மேலும் இதன் பரிமாணம் [PV/T] = JK-1 இந்த நேர்க்குறி மாறிலி C ஐ துகள்களின் எண்ணிக்கை (N) யின் k மடங்கு என எழுதலாம். இங்கு k என்பது பொது மாறிலியான போல்ட்ஸ்மென் மாறிலியாகும். (1.381×10−23 JK−1)
பொதுவாக ஒரு நல்லியல்பு வாயுச் சமன்பாட்டை பின்வருமாறு எழுதலாம்.
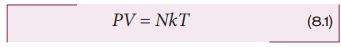
சமன்பாடு (8.1) ஐ மோல்களின் அடிப்படையிலும் எழுதலாம்.
வாயு ஒன்று μ மோல்கள் கொண்ட துகள்களைப் பெற்றிருந்தால், அவ்வாயுவிலுள்ள மொத்தத்துகள்களின் எண்ணிக்கையை பின்வருமாறு குறிப்பிடலாம்.
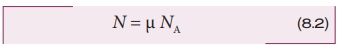
இங்கு NA என்பது அவகாட்ரோ எண் (6.023 × 1023mol-1) ஆகும். சமன்பாடு (8.2) இல் உள்ள N இன் மதிப்பை (8.1) இல் பிரதியிடும்போது PV = μ NAkT எனக் கிடைக்கும். இங்கு NAk=R என்பது பொது வாயுமாறிலி என அழைக்கப்படும். இதன் மதிப்பு 8.314 J/mol. K.
எனவே μ மோல்கொண்ட நல்லியல்பு வாயு ஒன்றின் வாயுச் சமன்பாட்டை பின்வருமாறு எழுதலாம்.

இச்சமன்பாட்டிற்கு நல்லியல்பு வாயுவின் நிலைச்சமன்பாடு [equation of state) என்று பெயர். இச்சமன்பாடு சமநிலையிலுள்ள வெப்ப இயக்கவியல் அமைப்பு ஒன்றின் அழுத்தம், பருமன் மற்றும் வெப்பநிலையை ஒன்றுடன் ஒன்று தொடர்புபடுத்துகிறது.
எடுத்துக்காட்டு 8.2
8 km தொலைவிலிருந்து மிதிவண்டியின் மூலம் பள்ளிக்கு வரும் மாணவியின், மிதிவண்டியின் சக்கரத்தின் காற்றழுத்தம் 27°C இல் 240 kPa. அம்மாணவி பள்ளியை அடைந்தவுடன் சக்கரத்தின் வெப்பநிலை 39°C எனில் சக்கரத்தின் காற்றழுத்தத்தின் மதிப்பினைக் காண்க.

தீர்வு:
சக்கரத்தில் உள்ள காற்றினை நல்லியல்பு வாயுவாகக் கருதினால், வாயு மூலக்கூறுகளின் எண்ணிக்கையும் சக்கரத்தின் பருமனும் இங்கு மாறிலியாகும். எனவே 27°C வெப்பநிலையிலுள்ள வாயு மூலக்கூறுகள் P1V1 = NkT1 இலட்சிய வாயுச் சமன்பாட்டையும், 39°C வெப்பநிலையிலுள்ள வாயு மூலக்கூறுகள் P2V2 = NkT2 என்ற இலட்சிய வாயுச் சமன்பாட்டையும் நிறைவு செய்யும்.
இங்கு T1 மற்றும் T2 என்பது கெல்வின் வெப்பநிலை ஆகும். நாம் அறிந்தபடி
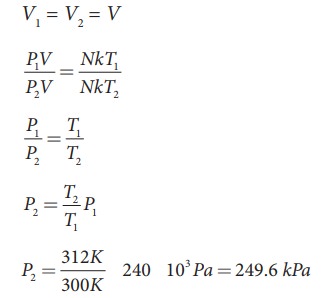 –
–
எடுத்துக்காட்டு 8.3
37°C உடல் வெப்பநிலையுடைய மனிதரொருவர் சுவாசிக்கும் போது, அவரின் நுரையீரலில் 5.5 லிட்டர் காற்று 1 வளி மண்டல அழுத்தத்தில் (1 atm = 101 kPa) உள்ளே செல்கிறது. மனிதரின் நுரையீரலில் உள்ள ஆக்ஸிஜன் மூலக்கூறுகளின் எண்ணிக்கையைக் கணக்கிடுக. (குறிப்பு: காற்றில் 21% ஆக்ஸிஜன் உள்ளது.)
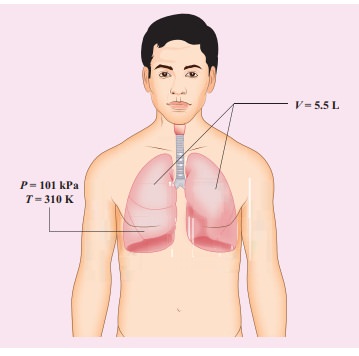
தீர்வு :
நுரையீரலில் உள்ள காற்றை ஓர் நல்லியல்பு வாயுவாகக்கருதி, நல்லியல்புவாயுச்சமன்பாட்டைப் பயன்படுத்தி வாயு மூலக்கூறுகளின் எண்ணிக்கையைக் கணக்கிடலாம்.
PV = NkT
இங்கு வாயுவின் பருமன் லிட்டரில் கொடுக்கப்பட்டுள்ளது. ஒரு லிட்டர் என்பது 10 cm பக்க அளவு கொண்ட கனசதுரக் கொள் கலனின் பருமனுக்குச் சமம் எனவே,
1லிட்டர் = 10cm × 10cm × 10cm = 10-3 m3
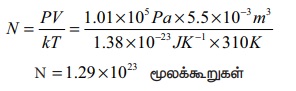
கணக்கிடப்பட்ட N மதிப்பில் 21% மட்டுமே ஆக்ஸிஜன் மூலக்கூறுகளாகும். எனவே மொத்த ஆக்ஸிஜன் மூலக்கூறுகளின் எண்ணிக்கை
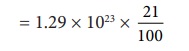
ஆக்ஸிஜன் மூலக்கூறுகளின் எண்ணிக்கை
= 2.7 × 1022 மூலக்கூறுகள்
எடுத்துக்காட்டு 8.4
ஒரு மோல் அளவுள்ள ஏதேனும் ஒரு வாயுவின் பருமனை படித்தர வெப்பநிலை மற்றும் அழுத்தத்தில் (STP) காண்க. மேலும் அதே மூலக்கூறுகளின் பருமனை அறைவெப்பநிலை (300 K) மற்றும் ஒரு வளி மண்டல அழுத்தத்தில் (1atm) கணக்கிடுக.
தீர்வு
படித்தர வெப்பநிலை மற்றும் அழுத்தத்தில், வெப்பநிலை (T= 273K அல்லது 0°C) மற்றும் அழுத்தம் (P = 1 atm அல்லது 101.3 kPa)
நல்லியல்பு வாயுச்சமன்பாட்டை இங்கு பயன்படுத்தும்போது V = μRT / P.
இங்கு μ = 1 mol மற்றும் R = 8.314 J/mol.K. இம்மதிப்புகளை சமன்பாட்டில் பிரதியிடும் போது
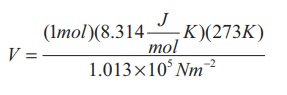
=22.4 × 10-3 m3
நாம் அறிந்தபடி 1 லிட்டர் (L) = 10-3m3.
இதிலிருந்து 1 மோல் அளவுள்ள எந்த ஒரு நல்லியல்பு வாயுவின் பருமன் 22.4 லிட்டர் என நாம் அறிந்து கொள்ளலாம்.
அறை வெப்பநிலையில் ஒரு மோல் அளவுள்ள வாயுவின் பருமனைக்கான 22.4 லிட்டரை 300K/273K ஆல் பெருக்க வேண்டும். அவ்வாறு கணக்கிடும் போது, வாயுவின் பருமன் 24.6 லிட்டர் எனக்கிடைக்கும்.
எடுத்துக்காட்டு 8.5
உனது வகுப்பறையில் உள்ள காற்றின் நிறையை இயல்பு வெப்பநிலை மற்றும் அழுத்தத்தில் (NTP) கணக்கிடுக. இங்கு இயல்பு வெப்பநிலை என்பது அறை வெப்பநிலையையும், இயல்பு அழுத்தம் என்பது ஒரு வளி மண்டல அழுத்தத்தைக் (1 atm) குறிக்கும்.

தீர்வு
வகுப்பறை ஒன்றின் சராசரி அளவு முறையே 6m நீளம், 5 m அகலம் மற்றும் 4 m உயரமாகும். எனவே அறையின் பருமன் V = 6 × 5 × 4 = 120m3 ஆகும். இப்பருமனில் உள்ள மோல்களின் எண்ணிக்கையைக் கணக்கிட வேண்டும்.
அறை வெப்பநிலையிலுள்ள (300K) ஒரு மோல் வாயுவின் பருமன் 24.6 லிட்டர். எனவே,
மூலக்கூறுகளின் எண்ணிக்கை
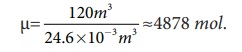
காற்றில் 21% ஆக்ஸிஜன், 78% நைட்ரஜன் மற்றும் 1% ஆர்கான், ஹைட்ரஜன், ஹீலியம் மற்றும் செனான் போன்ற வாயுக்களின் கலவை உள்ளது. காற்றின் மூலக்கூறு நிறை 29 g mol-1 எனவே அறையில் உள்ள காற்றின் மொத்த நிறை m = 4878 × 29 = 141.4kg ஆகும்.