11வது இயற்பியல் : அலகு 8 : வெப்பமும் வெப்ப இயக்கவியலும்
வெப்ப இயக்கவியல்
வெப்ப இயக்கவியல்:
அறிமுகம்:
நாம் முந்தைய பிரிவுகளில் வெப்பம், வெப்பநிலை மற்றும் பொருள்களின் வெப்பப்பண்புகளைப் பற்றி பயின்றோம். வெப்ப இயக்கவியல் என்பது இயற்பியலின் ஒரு பிரிவாகும். இப்பிரிவு வேலையை வெப்பமாகவும் மற்றும் வெப்பத்தை வேலையாகவும் மாற்றுவதில் உள்ள விதிகளை விவரிக்கிறது. வெப்ப இயக்கவியலின் விதிகள் பாயில், சார்லஸ், பெர்னூலி, ஜுல், கிளாசியஸ், கெல்வின், கார்னோ மற்றும் ஹெல்ம்ஹோல்ட்ஸ் போன்ற அறிவியல் அறிஞர்களின் மூன்று நூற்றாண்டுகால ஆய்வுகளின் அடிப்படையில் முறைப்படுத்தப்பட்டதாகும்.
அன்றாட வாழ்வில் நம்மைச்சுற்றி நடைபெறும் அனைத்து நிகழ்வுகளும் ஏன் நமது உடலியக்க நிகழ்வுகள் கூட வெப்ப இயக்கவியல் விதிகளுக்கு உட்பட்டு நடைபெறுகின்றது எனக்கூறினால் அது மிகையாகாது. எனவே வெப்ப இயக்கவியல் என்பது இயற்பியலின் ஓர் இன்றியமையாத பிரிவாகும்.
வெப்ப இயக்கவியல் அமைப்பு
வெப்ப இயக்கவியல் அமைப்பு (Thermodynamic system) என்பது இப்பிரபஞ்சத்தில் வரையறுக்கப்பட்ட ஒரு பகுதியாகும். மேலும் அழுத்தம் (P), பருமன் (V), மற்றும் வெப்பநிலை (T) போன்ற முக்கிய அளவுருக்களால் வரையறுக்கப்பட்ட பெரும் எண்ணிக்கையிலடங்கிய துகள்களின் (அணுக்கள் மற்றும் மூலக்கூறுகள்) தொகுப்பே வெப்ப இயக்கவியல் அமைப்பாகும். மீதமுள்ள இப்பிரபஞ்சத்தின் பகுதியே சூழல் (surrounding) எனப்படும். இவ்விரண்டும் ஓர் எல்லையால் பிரிக்கப்பட்டுள்ளன. இது படம் 8.15 இல் காட்டப்பட்டுள்ளது.
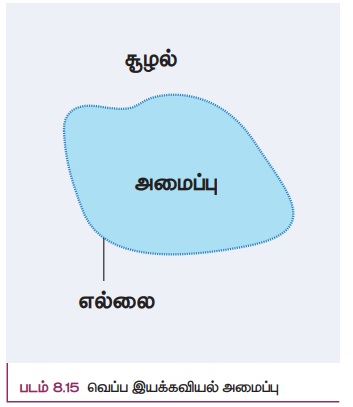
எடுத்துக்காட்டுகள்:
ஓர் வெப்ப இயக்கவியல் அமைப்பு என்பது, திட, திரவ, வாயு மற்றும் கதிர்வீச்சு போன்ற எந்த வடிவிலும் இருக்கலாம்.
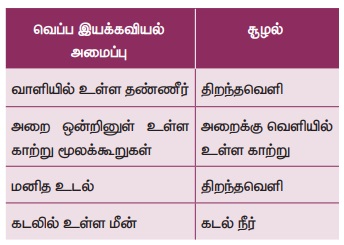
படம் 8.16 இல் காட்டியுள்ளவாறு வெப்ப இயக்கவியல் அமைப்பினை மூன்று வகைகளாகப் பிரிக்கலாம்.
வெப்பச்சமநிலை (Thermal equilibrium)
அறை ஒன்றில் ஒரு கோப்பையில் சூடான தேநீர் வைக்கப்பட்டால், தேநீரிலிருந்து வெப்பம் சூழலுக்குக் கடத்தப்படும். சிறிது நேரத்திற்கு பின்பு சூடான தேநீர் சூழலின் வெப்பநிலைக்கு சமமான வெப்பநிலையை அடையும். இதன் பின்பு தேநீரிலிருந்து சூழலுக்கோ அல்லது சூழலிலிருந்து தேநீருக்கோ வெப்பப் பரிமாற்றம் ஏற்படாது. தேநீரும் சூழலும் வெப்பச்சமநிலையை அடைந்து விட்டதை இது காட்டுகிறது.
இரு அமைப்புகள் ஒன்றுக்கொன்று வெப்பச்சமநிலையில் உள்ளது எனில் அவ்விரண்டு அமைப்புகளும் ஒரே வெப்பநிலையில் இருக்க வேண்டும். மேலும் அது நேரத்தைப் பொருத்து மாறாமல் இருக்க வேண்டும்.
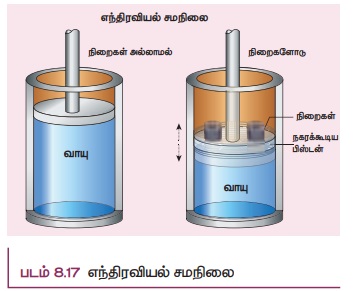
எந்திரவியல் சமநிலை (Mechanical equilibrium)
படம் 8.17 இல் காட்டியுள்ளவாறு பிஸ்டனுடன் உள்ள வாயு அடைத்து வைக்கப்பட்டுள்ள கொள்கலன் ஒன்றைக் கருதுக. அப்பிஸ்டனின் மீது நிறை ஒன்றை வைக்கும் போது கீழ்நோக்கிய புவியீர்ப்பு விசையின் காரணமாக பிஸ்டன் கீழ்நோக்கி நகர்ந்து சில ஏற்ற இறக்கத்திற்குப்பின்பு நிற்கும். பிஸ்டன் ஒரு புதிய இடத்தை அடையும். வாயுவின் மேல் நோக்கிய விசை, கீழ்நோக்கிய புவியீர்ப்பு விசையை சமன் செய்யும். இந்நிலையில் இவ்வமைப்பை எந்திரவியல் சமநிலையில் உள்ளது எனக்கூறலாம். அமைப்பு ஒன்று எந்திரவியல் சமநிலையில் உள்ளது எனில், எவ்விதமான சமன்செய்யப்படாத விசையும் வெப்ப இயக்கவியல் அமைப்பின் மீது செயல்படக்கூடாது.
வேதிச்சமநிலை (Chemical equilibrium)
ஒன்றுடன் ஒன்று தொடர்பிலுள்ள இரண்டு வெப்ப இயக்கவியல் அமைப்புகளுக்கிடையே எவ்வித தொகுபயன் வேதிவினையும் நடைபெறவில்லை எனில் அவ்விரு அமைப்புக்களும் வேதிச்சமநிலையில் உள்ளது எனலாம்.
வெப்ப இயக்கவியல் சமநிலை (Thermodynamic equilibrium)
இரண்டு அமைப்புகள் வெப்ப இயக்கவியல் சமநிலையில் உள்ளன எனில், அவ்விரண்டு அமைப்புக்களும் ஒன்றுக்கொன்று வெப்ப, எந்திரவியல் மற்றும் வேதிச் சமநிலையில் இருக்க வேண்டும். வெப்ப இயக்கவியல் சமநிலையில் மீப்பெரு (Macroscopic) மாறிகளான அழுத்தம், பருமன் மற்றும் வெப்பநிலை ஆகியவை ஒரு நிலையான மதிப்பினைப் பெற்றிருக்க வேண்டும். மேலும் அவை காலத்தைப் பொருத்து மாறாமல் இருக்க வேண்டும்.
வெப்ப இயக்கவியல் நிலை மாறிகள் (Thermodynamic state variables)
இயந்திரவியலில் திசைவேகம், உந்தம் மற்றும் முடுக்கம் போன்றவை இயங்கும் பொருளொன்றின் நிலையை விளக்கப்பயன்படுகின்றன. (தொகுதி 1 இல் இவற்றைப் பற்றி புரிந்துகொண்டிருப்பீர்கள்) வெப்ப இயக்கவியலில், வெப்ப இயக்கவியல் அமைப்பு ஒன்றின் நிலையை விவரிக்கும் மாறிகளின் தொகுப்பிற்கு வெப்ப இயக்கவியல் மாறிகள் என்று பெயர்.
எடுத்துக்காட்டுகள் : அழுத்தம், வெப்பநிலை, பருமன், அக ஆற்றல் போன்றவை.
இந்த மாறிகளின் மதிப்பு வெப்ப இயக்கவியல் அமைப்பின் சமநிலையை முழுவதுமாக விவரிக்கின்றன. வெப்பம் மற்றும் வேலை இவை வெப்ப இயக்கவியல் நிலை மாறிகள் அல்ல மாறாக இவை செயல்மாறிகள் ஆகும். (Process variables). வெப்ப இயக்கவியல் மாறிகள் இரண்டு வகைப்படும் அவை : அளவுச் சார்புள்ள மாறி (Extensive variable) மற்றும் அளவுச் சார்பற்ற மாறி (Intensive variable). அளவுச் சார்புள்ள மாறி, வெப்ப இயக்கவியல் அமைப்பின் அளவு அல்லது நிறையைச் சார்ந்திருக்கும்.
எடுத்துக்காட்டு: பருமன், மொத்த நிறை, என்ட்ரோபி (entropy), அக ஆற்றல், வெப்ப ஏற்புத்திறன் போன்றவை.
அளவுச் சார்பற்ற மாறி வெப்ப இயக்கவியல் அமைப்பின் அளவு அல்லது நிறையைச் சார்ந்திருக்காது.
எடுத்துக்காட்டு: வெப்பநிலை, அழுத்தம், தன்வெப்ப ஏற்புத்திறன், அடர்த்தி போன்றவை
நிலைச் சமன்பாடு (Equation of state):
நிலை மாறிகளை ஒரு குறிப்பிட்ட முறையில் தொடர்புபடுத்தும் சமன்பாடு, நிலைச்சமன்பாடு என்று அழைக்கப்படுகிறது. இந்நிலைச்சமன்பாடு வெப்ப இயக்கவியல் அமைப்பொன்றின் சமநிலையில் நிலை மாறிகளுக்கு இடையே உள்ள தொடர்பை முழுவதுமாக விவரிக்கிறது. வெப்ப இயக்கவியல் அமைப்பு சமநிலையில் இல்லையெனில், இந்நிலைச் சமன்பாடு அமைப்பின் நிலையை விவரிக்காது. வெப்ப இயக்கச் சமநிலையில் உள்ள நல்லியல்பு வாயு (ideal gas) ஒன்று PV = NkT என்ற நிலைச் சமன்பாட்டினால் குறிப்பிடப்படுகிறது. இங்கு நான்கு பேரளவு மாறிகளும் (P,V,T மற்றும் N) நிலைச்சமன்பாட்டினால் ஒன்றுடன் ஒன்று தொடர்புபடுத்தப்பட்டுள்ளன. இச்சமன்பாட்டிலுள்ள ஏதேனும் ஒரு மாறியை மட்டும் மாற்ற இயலாது. எடுத்துக்காட்டாக வாயு நிரம்பியுள்ள கொள்கலனின் பிஸ்டனை அழுத்தும்போது, வாயுவின் பருமன் குறையும். ஆனால் அதன் அழுத்தம் அதிகரிக்கும் அல்லது வாயுவை வெப்பப்படுத்தும்போது அதன் வெப்பநிலை உயரும். வாயுவின் அழுத்தம் மற்றும் பருமனும் உயரலாம்.
நிலைச்சமன்பாட்டிற்கான மற்றொரு எடுத்துக்காட்டு வான்டர்வால்ஸ் சமன்பாடு ஆகும். வெப்ப இயக்கச் சமநிலையில் உள்ள இயல்புவாயுக்கள் (Real gases) இச்சமன்பாட்டிற்கு உட்படும்.
அறை ஒன்றிலுள்ள காற்று மூலக்கூறுகள் வான்டர்வால்ஸ் நிலைச்சமன்பாட்டிற்கு முழுவதுமாக கட்டுப்படுகின்றன. இருப்பினும் அறைவெப்பநிலையில் குறைந்த அடர்த்தியுள்ள காற்று மூலக்கூறுகளை நாம் தோராயமாக நல்லியல்பு வாயுவாகக் (Ideal gas) கருதுகிறோம்.