8 ஆம் வகுப்பு அறிவியல் : அலகு 13 : நீர்
நீரின் வேதியியல் பண்புகள்
நீரின் பண்புகள்
நீரானது நாம் அறிந்துள்ள சில பண்புகளைக் கொண்டுள்ளது. இவை நீருக்கே
உரியவை. ஒருசில இயற்பியல் மற்றும் வேதியியல் பண்புகள் கீழே விளக்கப்பட்டுள்ளன.
1. இயற்பியல் பண்புகள்
அ. தன்மை
தூய நீரானது ஒளி ஊடுருவக்கூடிய தெளிவான திரவமாகும். அதற்கு நிறம்,
மணம், சுவை ஆகியவை இல்லை.
ஆ. கொதிநிலை
ஒரு வளிமண்டல அழுத்தத்தில் தூய நீரின் கொதிநிலையானது 100°C ஆகும்.
இந்த வெப்பநிலையில் நீரானது கொதித்து நீராவியாக மாறுகிறது. அழுத்தம் அதிகரிக்கும்போது
நீரின் கொதிநிலை அதிகரிக்கிறது. உதாரணமாக, உயர் அழுத்த சமயற்கலனில் (Pressure
cooker) வெப்பநிலையை அதிகரிக்குபோது சமையற்கலனின் உள்ளே அதிக அழுத்தம் உருவாகிறது.
இந்த அழுத்தம் நீரின் கொதிநிலையை அதிகரிக்கிறது. எனவே, கலனின் உள்ளே நீரானது அதிக வெப்பநிலையிலும்
(100 க்கு மேல்) திரவ நிலையிலேயே உள்ளது. ஆதலால், உணவு விரைவாக சமைக்கப்படுகிறது.
தூய
நீர் கீழ்க்காணும் இயற்பியல் பண்புகளைப் பெற்றுள்ளது.
தூய
நீரின் கொதிநிலையானது வளிமண்டல அழுத்தத்தில்
100°C ஆகும்.
தூய
நீரின் உறைநிலையானது வணிமண்டல அழுத்தத்தில் 0°C ஆகும்.
தூய
நீரின் அடர்தியானது 1 கி/செ.மீs ஆகும்.
இ. உறைநிலை
நீரின் உறைநிலை 0°C ஆகும். இந்த வெப்பநிலையில் நீரானது உறைந்து
பனிக்கட்டியாக மாறுகிறது.. அழுத்தம் அதிகரிக்கும்போது நீரின் உறைநிலை குறைகிறது.
பனிக்கட்டியின்
மேல் சறுக்கும் ஸ்கேட்டர்கள் அதன் மீது அழுத்தத்தைச் செலுத்துகிறார்கள். அழுத்தம் பனிக்கட்டியின்
உறைநிலையைக் குறைக்கிறது. இதன் விளைவாக ஸ்கேட்டின் அடியில் பனிக்கட்டி உருகி ஸ்கேட்டர்களால்
எளிதில் பனிக்கட்டியின் முடிகிறது. ஸ்கேட்டர்கள்
மீது சுருக்க முன்னோக்கி நகரும்போது அழுத்தம் குறைந்து நீர் மீண்டும் பனிகட்டியாக மாறுகிறது.

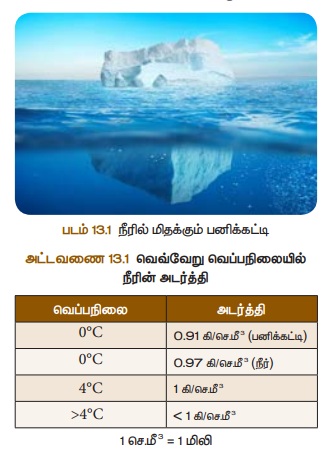
ஈ. அடர்த்தி
அறை வெப்பநிலையில் உள்ள நீர் நிறைந்த குவளையினுள் பனிக்கட்டித் துண்டுகளைப் போடும்போது, அவை மிதக்கின்றன. ஏனெனில், பனிக்கட்டியானது நீரைவிட இலேசானது. பனிக்கட்டியின் அடர்த்தியானது நீரின் அடர்த்தியை விட குறைவு என்பதை இது குறிக்கிறது. குளிர்கால வெப்பநிலை OCக்குக் கீழே செல்லும்போது ஏரியில் உள்ள நீரானது உறைய ஆரம்பிக்கிறது. இவ்வாறு உறைந்த பனிக்கட்டியானது ஏரியின் மேற்பரப்பில் மிதந்து ஏரி முழுவதையும் மூடுகிறது. பனிக்கட்டி குறைவான வெப்பம் கடத்தும் பண்பைப் பெற்றுள்ளதால் மேற்புற வெப்பநிலையைக் கீழே செல்ல அனுமதிப்பதில்லை. எனவே,
பெரும்பாலான நீர்வாழ் உயிரினங்கள் வாழக்கூடிய ஏரியின் கீழ்புறம்
பனிக்கட்டியாக மாறுவதில்லை. இந்தக் காரணத்தால்தான் மிகக் கடுமையான பனிப்பொழிவுமிக்க
காலங்களிலும் ஏரியில் வாழும் தாவர மற்றும் விலங்கு உயிரினங்கள் உயிர்வாழ்கின்றன. பல்வேறு
வெப்பநிலைகளில் நீரின் அடர்த்தியானது அட்டவணை 4.1ல் கொடுக்கப்பட்டுள்ளது.
உ. நீரின் அசாதாரண விரிவடைவு
சமமான நிறையுள்ள பனிக்கட்டி மற்றும் நீரினை எடுத்துக்கொண்டால்,
பனிக்கட்டியின் கனஅளவு நீரின் கனஅளவைவிட அதிகமாக இருக்கும். இது நீரின் ஒரு அசாதாரண
இயற்பியல் பண்பாகும். இமய மலைப் பகுதியில் வெப்பநிலை O°C யை கூட குறையக்கூடும். இந்த
வெப்பநிலையில் நீர்க் குழாய்களில் உள்ள நீர் பனிக்கட்டியாக உறைந்துவிடும். இது நீரின்
கனஅளவில் விரிவாக்கத்தை ஏற்படுத்தும் குழாய்கள் வலுவாக இல்லாவிட்டால் விரிசல், கசிவு
அல்லது வெடிப்பு போன்றவை ஏற்படலாம். நீர் உறைவதால் அதன் கனஅளவு அதிகரிப்பதே இதற்குக்
காரணமாகும்.
உ. உருகுதலின் உள்ளுறை வெப்பம்
ஒரு குவளையில் சில பனிக்கட்டித் துண்டுகளை எடுத்துக்கொண்டு அதனுள்
ஒரு வெப்பநிலைமானியை வைக்கவும். குவளையைச் சூடுபடுத்தும்போது, பனிக்கட்டி முழூவதும்
உருகும்வரை வெப்பநிலைமானியில் மாற்றம் ஏதும் இருக்காது. கொடுக்கப்பட்ட வெப்பம் எங்கே
செல்கிறது என்று நமக்குத் தோன்றலாம். பனிகட்டியை திட நிலையிலிருந்து திரவ நிலைக்கு
மாற்றுவதற்கு வெப்ப ஆற்றல் பயன்படுத்தப்படுகிறது. பனிக்கட்டி தண்ணீராக மாறுவதற்குத்
தேவையான வெப்ப ஆற்றலின் அளவு பனிக்கட்டியின் உருகுதலின் உள்ளுறை வெப்பம் என்று அழைக்கப்படுகிறது.
பனிக்கட்டியானது மிகவும் அதிக உருகுதலின் உள்ளுறை வெப்பத்தைக் கொண்டுள்ளது. அதன் மதிப்பு
80 கலோரிகள்/கிராம். அல்லது 336 ஜூல்/ கிராம் ஆகும்.
மீன்
மற்றும் இறைச்சியை பனிகட்டியினுள் வைப்பதன் மூலம் கெட்டுவிடாமல் அவற்றைப் பராமரிக்க
முடியும். பனிக்கட்டியின் உள்ளுறை வெப்பம் அதிகமாக இருப்பதால், அது உருகும்போது மீன்களிலிருந்து
அதிக அளவு வெப்பத்தை உறிஞ்சிக் கொள்கிறது. இதனால் உணவினை குறைந்த வெப்பநிலையில் நீண்ட
நேரம் கெட்டுப்போகாமல் பாதுகாக்க முடிகிறது.

ஊ. நீர் ஆவியாதலின் உள்ளுறை வெப்பம்
நீரானது 100°C வெப்பநிலையை அடையும் போது அது திரவ நிலையிலிருந்து
வாயு நிலைக்கு மாற்றமடைகிறது. எனினும், நீரின் வெப்பநிலை 100க்கு மேல் உயராது. ஏனெனில்,
கொடுக்கப்படும் வெப்ப ஆற்றல் கொதிக்கும் நீரின் இயற்பியல் நிலையை மட்டுமே மாற்றுகிறது.
இந்த வெப்ப ஆற்றல் நீராவியினுள் சேமிக்கப்படுகிறது. எனவே, இது நீர் ஆவியாதலின் உள்ளுறை
வெப்பம் எனப்படுகிறது. நீராவியானது மிகவும் அதிக ஆவியாதலின் உள்ளுறை வெப்பத்தைக் கொண்டுள்ளது.
அதன் மதிப்பு 540 கலோரி/கிராம் அல்லது 2268 ஜூல்/ கிராம் ஆகும்.
எ. தன்வெப்ப ஏற்புத்திறன்
ஒரு பொருளின் ஓர் அலகு வெப்ப நிலையை 1°C ஆக உயர்த்தத் தேவையான
வெப்பத்தின் அளவு அப்பொருளின் தன் வெப்ப ஏற்புத்திறன் எனப்படும். அனைத்து விதமான திரவங்களுள்
நீரின் தன்வெப்ப ஏற்புத்திறன் மிகவும் அதிகம். ஒரு கிராம் நீரின் வெப்பநிலையை 1° உயர்த்துவதற்கு
1 கலோரி ஆற்றல் தேவைப்படுகிறது. அதிக தன் வெப்ப ஏற்புத்திறனால் நீரானது சூடாகவோ அல்லது
குளிர்ச்சியாவோ மாற அதிக நேரத்தை எடுத்துக்கொள்கிறது. இதனால், நீரானது அதிக வெப்பத்தை
உறிஞ்சி நீண்ட நேரம் அதனைத் தக்கவைத்துக் கொள்ளமுடியும். நீரின் இத்தகைய பண்பானது இயந்திரங்களைக்
குளிர்விக்கப் பயன்படுகிறது. ரேடியேட்டர் பம்பைப் பயன்படுத்தி கார் இயந்திரத்தின் உள்ளே
நீரைச் செலுத்தும்போது நீரானது ரேடியேட்டரில் உள்ள வெப்பத்தை உறிஞ்சிக்கொள்கிறது. இதனால்,
இயந்திரம் மிகவும் சூடாகாமல் பாதுகாக்கப்படுகிறது.

2. வேதியியல்
பண்புகள்
அ. லிட்மஸ் தாளின் மீது வினை
தூய நீர் நடுநிலையானது. இது லிட்மஸ் தாளின்மீது எவ்வித மாற்றத்தையும்
ஏற்படுத்துவதில்லை.
ஆ. நிலைப்புத்தன்மை
நீர் ஒரு நிலையான சேர்மம். சாதாரண வெப்பநிலையில் அதை வெப்பப்படுத்தும்போது
அது தனிமங்களாக சிதைவடைவதில்லை. எனினும், 2000 °C வெப்பநிலையில் 0.02% நீரானது சிதைவடைந்து
ஹைட்ரஜன் மற்றும் ஆக்சிஜன் வாயுவைத் தருகிறது.
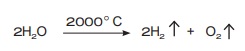
இ. வினையூக்கும் தன்மை
நீர் பல வேதி வினைகளில் வினையூக்கியாக செயல்படுகிறது. உலர்ந்த ஹைட்ரஜன் மற்றும் குளோரின் வாயுக்கள் சூரிய ஒளியின் முன்னிலையில் வினைபுரிவதில்லை. எனினும், சிறிதளவு நீரின் முன்னிலையில் வெடிப்புடன் வினைபுரிந்து ஹைட்ரஜன் குளோரைடைத் தருகின்றன.

ஈ. உலோகங்களுடன் வினை
நீர் சில உலோகங்களுடன் வினை புரிகிறது. அறை வெப்பநிலையில் சோடியம்,
பொட்டாசியம் மற்றும் கால்சியம் போன்ற சில உலோகங்களுடன் நீர் அதிவேகமாக வினைபுரிகிறது.
சோடியம் நீருடன் வினைபுரிந்து ஹைட்ரஜன் வாயு மற்றும் சோடியம் ஹைட்ராக்சைடு கரைசலைத்
தருகிறது. இவ்வினையில் வெளியேரும் வெப்பத்தினால் ஹைட்ரஜன் வாயு தீப்பிடித்து எரியும்.

செயல்பாடு 2
ஒரு
குடுவையினை நீரால் நிரப்பவும்.கத்தியால் சோடியத்தை சிறு துண்டுகளாக வெட்டி நீரினுள்
போடவும். சோடியம் நீருடன் வினைபுரிந்து நீரின் மேற்பரப்பு முழுவதும் நகர்கிறது. மேலும்
நீரின் மேற்பரப்பின் மீது ஒரு சுடர் எரிவதையும் நாம் காணலாம்.
மெக்னீசியம் சற்று மந்தமானது. இது சூடான நீருடன் வினைபுரிந்து
ஹைட்ரஜன் மற்றும் மெக்னீசியம் ஹைட்ராக்சைடு கரைசலைத் தருகிறது.
2Mg + 2H2O -> Mg(OH)2 + H2![]()
பல உலோகங்கள் நீருடன் வினைபுரிந்து ஆக்சைடுகள் மற்றும் ஹைட்ராக்சைடுகளை
உருவாக்குகின்றன. இரும்பு என்பது அத்தகைய உலோகங்களுள் ஒன்று, இது இரும்பு ஆக்சைடு எனப்படும்
துருவை உருவாக்குகிறது. கட்டடங்கள், தொழிற்சாலைகள், பாலங்கள், கப்பல்கள் மற்றும் வாகனங்களில்
இரும்பு பயன்படுத்தப்படுகிறது. இரும்பின் மெதுவான மற்றும் படிப்படியான துருப்பிடித்தல்
அரிமானம் என்று அழைக்கப்படுகிறது.
தாமிரம்
சந்த வெப்பநிலையிலும் நீருடன் வினைபுரிவதில்லை. ஆகையால் குழாய்கள் மற்றும் கொதிகலன்கள்
உருவாக்குவதில் தாமிரம் பயன்படுத்தப்படுகிறது.
உ. அலோகங்களுடன் வினை
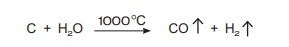
செஞ்சூடான கார்பன் (கல்கரி) நீராவியுடன் வினைபுரிந்து நீர் வாயுவை
(கார்பன் மோனாக்சைடு + ஹைட்ரஜன்) உருவாக்குகிறது.
குளோரின் வாயு நீரில்
ஹைட்ரோகுளோரிக் அமிலத்தைத் தருகிறது.
