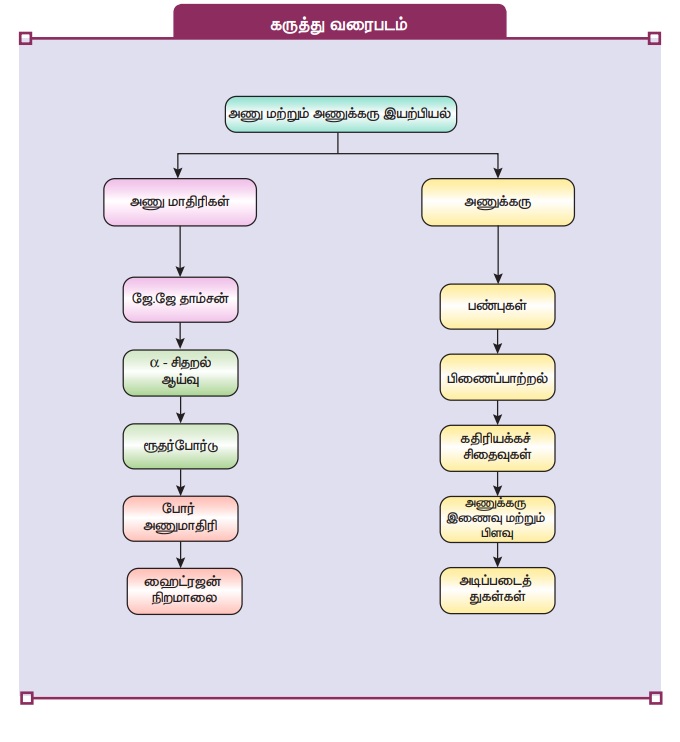
அணு மற்றும் அணுக்கரு இயற்பியல் | இயற்பியல் - பாடச்சுருக்கம், கருத்து வரைபடம் | 12th Physics : UNIT 9 : Atomic and Nuclear Physics
12 வது இயற்பியல் :அலகு 9 : அணு மற்றும் அணுக்கரு இயற்பியல்
பாடச்சுருக்கம், கருத்து வரைபடம்
பாடச்சுருக்கம்
* வளிமங்களின் வழியே மின்னோட்டம் பாயும் நிகழ்வினை
ஆராய உதவும் கருவி மின்னிறக்கக் குழாய் எனப்படும்.
* ஓரலகு நிறைக்கான மின்னூட்ட மதிப்பு மின்னூட்ட
எண் அல்லது இயலுறு மின்னூட்டம் (normalised charge) எனப்படும். இது வளிமத்தையோ மின்வாய்களின்
இயல்பையோ சார்ந்ததல்ல.
* 180° கோணத்தில் திருப்பப்படுவதற்கு முன்னராக
ஆல்பா துகளின் நிலைக்கும் அணுக்கருவின் மையத்திற்கும் இடையே உள்ள சிறும தொலைவு மீச்சிறு
அணுகு தொலைவு r0 எனப்படும்.
* வெகு தொலைவில் ஆல்பா துகள் உள்ள நிலையில்
அதன் திசைவேக வெக்டரின் திசைக்கும் அணுக்கருவின் மையத்திற்கும் இடைப்பட்ட செங்குத்து
தொலைவு மோதல் காரணி b என வரையறுக்கப்படுகிறது.
* போர் அணு மாதிரியின்படி, கோண உந்தம் குவாண்டம் தன்மை உடையது.
* போர் அணு மாதிரியில் சுற்றுப்பாதையின்
* முதல் சுற்றுப்பாதையின் ஆரம் a0 = ε0h2 / πme2 = 0.529 Å இது போர் ஆரம் என்றும் அழைக்கப்படுகிறது.
* n ஆவது சுற்றுப்பாதையில் எலக்ட்ரானின் திசைவேகம் 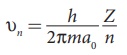
* நுண்வரியமைப்பு மாறிலி a = 1/137 இது பரிமாணமற்ற
மாறிலி
* n ஆவது சுற்றுப்பதையில் எலக்ட்ரானின் ஆற்றல் 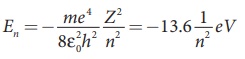
* குறைந்த ஆற்றல் நிலையிலிருந்து அதிக ஆற்றல்
நிலைக்கு ஒரு எலக்ட்ரானை கிளர்வுறச் செய்யத் தேவைப்படும் ஆற்றல் கிளர்வு ஆற்றல் எனப்படும்,
அதற்கு தேவையான மின்னழுத்தம் கிளர்வு மின்னழுத்தம்
எனப்படும்.
* அடி நிலையிலுள்ள ஒரு எலக்ட்ரானை அணுவிலிருந்து
வெளியேற்றத் தேவைப்படும் சிறும் ஆற்றல் அயனியாக்க ஆற்றல் எனப்படும்.
* அயனியாக்க ஆற்றலைப் பெற எலக்ட்ரானை முடுக்குவிக்கத்
தேவைப்படும் மின்னழுத்த வேறுபாடு அயனியாக்க மின்னழுத்தம் எனப்படும்.
* லைமன் வரிசைக்கான நிறமாலை வரிகளின் அலைநீளம்
புற ஊதாப் பகுதியிலும் பாமர் வரிசைக்கான அலைநீளம் கண்ணுறு ஒளிப் பகுதியிலும் பாஷன்
மற்றும் பிராக்கெட் வரிசைகளுக்கான அலைநீளங்கள் அகச்சிவப்புப் பகுதியிலும் அமைகின்றன.
* Z அணு எண்ணும் A நிறை எண்ணும் கொண்ட தனிமத்தின்
(X) அணுக்கரு AZX என்று குறிக்கப்படுகிறது.
* நிறை எண் A கொண்ட அணுக்கருவின் ஆரம் R =
R0A1/3 இங்கு R0 = 1.2F அணுக்கருவின் அடர்த்தி
p=2.3x1017 kgm-3
* M, mP மற்றும் mn
ஆகியவை முறையே அணுக்கரு, புரேட்டான் மற்றும் நியூட்ரானின் நிறைகள் எனில், நிறை இழப்பு
Am = (Zmp + Nmn) - M –
* அணுக்கருவின் பிணைப்பாற்றல் B.E = (Zmp
+ Nmn - M)c2
* இரும்பு அணுக்கருவின் ஒரு நியூக்ளியானுக்கான
பிணைப்பாற்றல் பெரும் மதிப்பைப் (8.8 MeV) பெற்றுள்ளது.
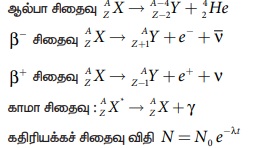
* பொதுவாக , n அரை ஆயுள்களுக்குப் பிறகு சிதைவடையாமல்
இருக்கும் அணுக்கருக்களின் எண்ணிக்கை N = (1/2)n N0
* அரை ஆயுளுக்கும் சிதைவு மாறிலிக்கும் இடையேயுள்ள
தொடர்பு
* அதிக நிறை கொண்ட ஒரு அணுக்கரு குறைந்த நிறை
கொண்ட அணுக்கருக்களாக சிதைவுறுவது அணுக்கரு பிளவு எனப்படும்.
* குறைந்த நிறை கொண்ட இரு அணுக்கருக்கள் அதிக
நிறை கொண்ட அணுக்கருவாக இணைவது அணுக்கரு இணைவு எனப்படும்.
* அணுக்கரு உலைகளில் அணுக்கரு தொடர்வினை கட்டுக்குள்
உள்ளது. விண்மீன்களில் அணுக்கரு இணைவு நிகழ்வினால் ஆற்றல் உருவாகிறது.