11 வது வேதியியல் : அலகு 10 : வேதிப் பிணைப்புகள்
பின்வரும் வினாக்களுக்கு சுருக்கமாக விடையளி
31. பின்வருவனவற்றை வரையறு
i) பிணைப்புத்தரம்
ii) இனக்கலப்பு
iii) σ- பிணைப்பு
விடை :
i) பிணைப்புத்தரம்
இணையும் இரு அணுக்களுக்கிடையே காணப்படும் பிணைப்புகளின் எண்ணிக்கையே 'பிணைப்புத்தரம்' எனப்படும்.
பிணைப்புத்தரம் = Nb – Na / 2
ii) இனக்கலப்பு :
ஒரு அணுவின் ஒப்பிடத்தக்க அளவு ஆற்றலுடைய அணு ஆர்பிட்டால்கள் ஒன்றோடொன்று கலந்து, சம எண்ணிக்கையில் சம ஆற்றலைப் பெற்றுள்ள புதிய சமமான ஆர்பிட்டால்களைத் தரும் செயல்முறை ‘இனக்கலப்பு' எனப்படும்.
iii) σ- பிணைப்பு:
இரண்டு அணு ஆர்பிட்டால்கள், அச்சுகளின் வழியே மேற்பொருந்தும்போது உருவாகும் பிணைப்பு ' σ ' சகப்பிணைப்பு எனப்படும்.
32. பை (π) பிணைப்பு என்றால் என்ன?
விடை :
இரு அணு ஆர்பிட்டால்கள் பக்கவாட்டில் மேற்பொருந்தும் போது உருவாகும் சகப்பிணைப்பு பை பிணைப்பு (π) எனப்படும்.
33. CH4, NH3 மற்றும் H2O, ஆகியவற்றிலுள்ள மைய அணுக்கள் sp3 இனக்கலப்பிற்கு உட்பட்டுள்ளன. எனினும் அவற்றின் பிணைப்புக் கோணங்கள் வெவ்வேறாக உள்ளன. ஏன்?
விடை :
● மீத்தேன்
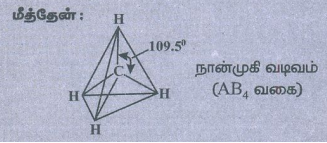
தனித்த இரட்டை எலக்ட்ரான்கள் (lp) இல்லை. எனவே, பிணைப்புக் கோணம் 109° 28' (அல்லது) 109.5°
● அம்மோனியா :
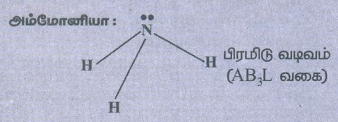
தனித்த இரட்டை எலக்ட்ரான்களின் (lp) எண்ணிக்கை = 1
lp - bp விலக்கு விசை செயல்படுகிறது. எனவே, பிணைப்புக் கோணம் 107° ஆகக் குறைகிறது.
● நீர்:

வளைந்த அமைப்பு - V வடிவம் (AB2 L2 வகை)
தனித்த இரட்டை எலக்ட்ரான்களின் (lp) எண்ணிக்கை = 2
lp - bp விலக்கு விசை செயல்படுகிறது. எனவே, பிணைப்புக் கோணம் 104.5° ஆகக் குறைகிறது.
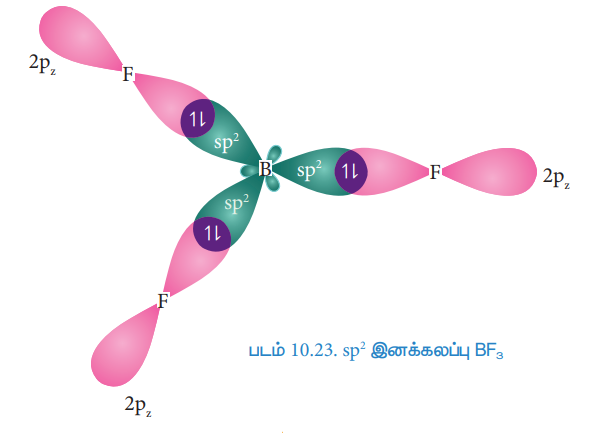
34. BF3 மூலக்கூறில் காணப்படும் sp2 இனக்கலப்பை விளக்குக.
விடை :
போரானின் எலக்ட்ரான் அமைப்பு (Z = 5)
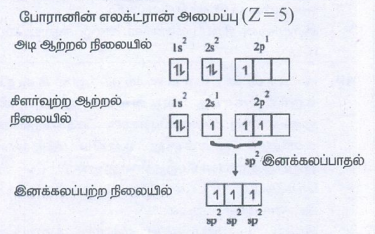
● அடி ஆற்றல் நிலையில் B - ன் இணைதிறன் கூட்டில் ஒரேயொரு இணையுறா e- உள்ளது.
● ஆனால் புளூரினுடன் மூன்று சகப்பிணைப்பு உருவாக்க மூன்று இணையுறா e-கள் தேவை.
● எனவே, 2S ஆர்பிட்டாலிலுள்ள ஒரு e-, 2p ஆர்பிட்டாலுக்கு கிளர்வுறுகிறது.
● இதனால் மூன்று சமமான 2p2 இனக்கலப்படைந்த ஆர்பிட்டால்கள் உருவாகின்றன.
● போரானின் இந்த மூன்று 2p2 இனக்கலப்படைந்த ஆர்பிட்டால்களுடன், மூன்று புளூரின் அணுக்களின் 2p ஆர்பிட்டால்கள் நேர்கோட்டில் மேற்பொருந்துவதால் படத்தில் உள்ளபடி மூன்று சகப்பிணைப்புகள் உருவாகின்றன.
35. ஆக்ஸிஜன் மூலக்கூறிற்கு மூலக்கூறு ஆர்பிட்டால் (MO) வரைபடத்தை வரைக. அதன் பிணைப்புக் தரத்தை கணக்கிடுக, மேலும் O2 மூலக்கூறு பாரா காந்தத்தன்மை கொண்டது எனக் காட்டுக.
விடை :
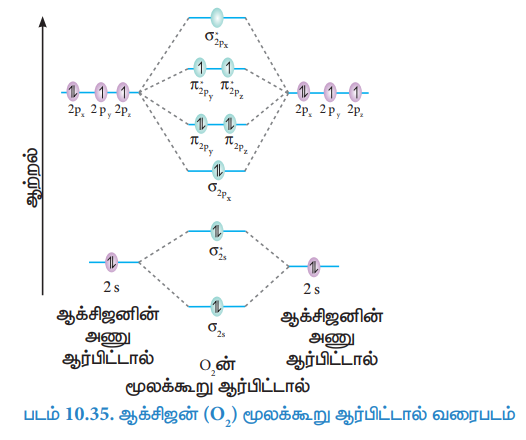
● பிணைப்புத் தரம் = Nb – Na / 2 = 10 – 6 / 2 = 2
● O2 மூலக்கூறின் மூலக்கூறு ஆர்பிட்டால்களில் இரண்டு தனித்த எலக்ட்ரான்கள் உள்ளன.
● எனவே O2 மூலக்கூறு பாரா காந்தத்தன்மை கொண்டது.
36. CO இன் மூலக்கூறு ஆர்பிட்டால் MO வரைபடத்தை வரைக, மேலும் அதன் பிணைப்புத் தரத்தை கணக்கிடுக.
விடை :
● பிணைப்புத் தரம் = Nb – Na / 2 = 10 – 4 / 2 = 3
37. மூலக்கூறு ஆர்பிட்டால் (MO) கொள்கையில், அணு ஆர்பிட்டால்களின் நேர்க்கோட்டு மேற்பொதிதல் என்பதிலிருந்து நீவிர்புரிந்து கொண்டது என்ன?
விடை :
அணு ஆர்பிட்டால்களின் நேர்க்கோட்டு மேற்பொதிதல் இணைவில் இரு குறுக்கீட்டு விளைவுகள் உள்ளன.
a) ஆக்கக் குறுக்கீட்டு விளைவு : இரு ஆர்பிட்டால்கள் ஒரே கட்டத்தில் உள்ளன.
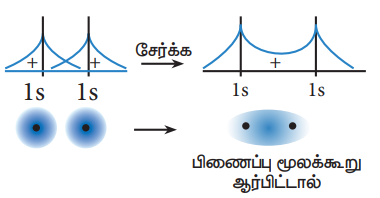
இவ்விளைவினால் பிணைப்பு மூலக்கூறு ஆர்பிட்டால் உருவாகிறது.
b) அழித்தல் குறுக்கீட்டு விளைவு : இரு ஆர்பிட்டால்கள் வெவ்வேறு கட்டத்தில் உள்ளன.
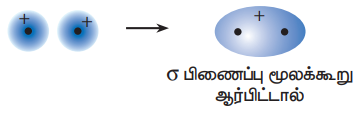
இவ்விளைவினால் எதிர்பிணைப்பு மூலக்கூறு ஆர்பிட்டால் உருவாகிறது.
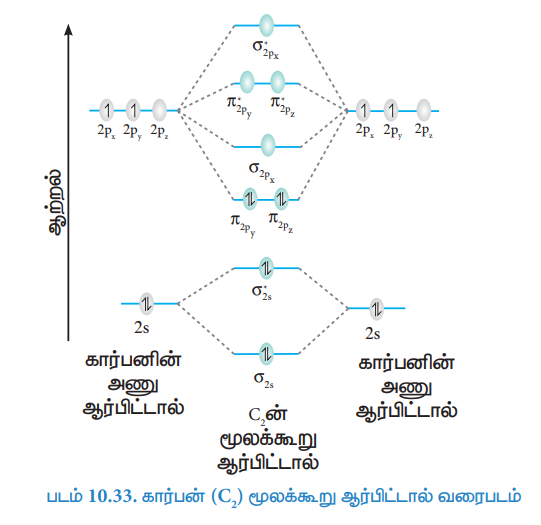
38. N2 மூலக்கூறு உருவாதலை மூலக்கூறு ஆர்பிட்டால் (MO) கொள்கை மூலம் விவாதிக்கவும்.
விடை :
நைட்ரஜன் அணுவின் எலக்ட்ரான் அமைப்பு 1s2 2s2 sp3
நைட்ரஜன் மூலக்கூறின் எலக்ட்ரான் அமைப்பு
(σ1s)2, (σ*1s)2, (σ2s)2, (σ*2s)2, (π2Py)2, (π2Pz)2 , (σ 2Px)2
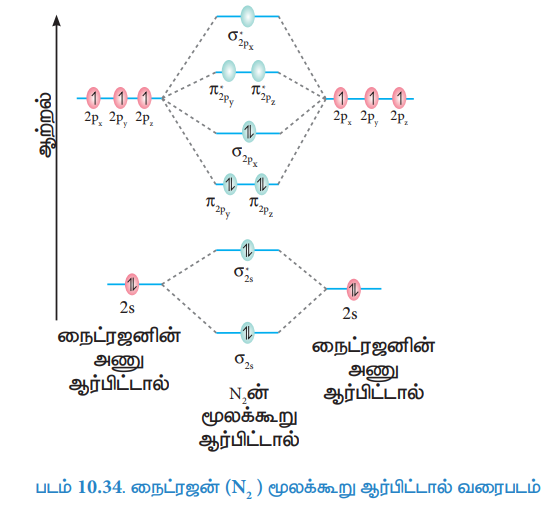
● பிணைப்புத்தரம் = Nb – Na / 2 = 10-4/2 = 3
● மூலக்கூறில் தனித்த எலக்ட்ரான்கள் இல்லை. எனவே, டையா காந்தப் பண்புடையது.
39. இரு முனை திருப்புத் திறன் என்றால் என்ன?
விடை :
ஒரு சகப்பிணைப்பின் முனைவுத் தன்மையை அளவிடப் பயன்படும் அலகு இருமுனைத் திருப்புத்திறன் ஆகும். µ = q × 2d
● இது ஒரு வெக்டார் அளவீடாகும்.'
● இதன் திசை எதிர்மின் சுமையிலிருந்து நேர்மின் சுமையினை நோக்கி அமையும்.
● இருமுனை திருப்புத்திறனின் அலகு கூலூம் மீட்டர் (Cm).
40. கார்பன்டையாக்சைடு மூலக்கூறின் நேர்க்கோட்டு வடிவமானது இரண்டு முனைவுற்ற பிணைப்புகளை கொண்டுள்ளது. எனினும் மூலக்கூறு பூஜ்ஜிய இருமுனை திருப்புத்திறனை பெற்றுள்ளது ஏன்?
● நேர்கோட்டு CO2ல் இரு முனைவுற்ற C-O பிணைப்புகள் உள்ளன.
● இவை சம மதிப்புடைய எதிரெதிர் திசையிலான இருமுனை திருப்புத்திறன்களைப் பெற்றுள்ளன.
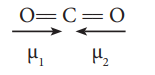
எனவே, CO2 ன் நிகர இருமுனை திருப்புத் திறனின் மதிப்பு = O.
அதாவது,
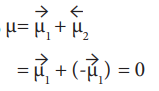
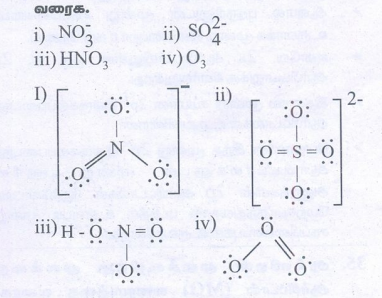
41. பின்வருவனவற்றிற்கு லூயி வடிவமைப்புகளை வரைக.
i) NO-3
ii) SO2-4
iii) HNO3
iv) O3
விடை :
42. BeCl2 மற்றும் MgCl2 ஆகியவற்றில் பிணைப்புகள் உருவாதலை விளக்குக.
விடை :
BeCl2 பிணைப்பு உருவாதல்:
Be ன் எலக்ட்ரான் அமைப்பு (Z = 4)
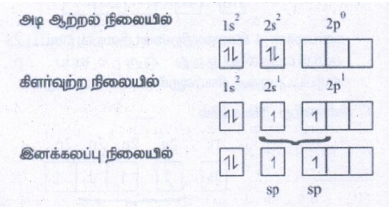
பெரிலியத்தின் ஒவ்வொரு sp இனக்கலப்பு ஆர்பிட்டால்களுடன், Cl-ன் ஆர்பிட்டால் நேர்கோட்டில் மேற்பொருந்துவதால் Be - க்கும் Cl- க்கும் இடையே சகப்பிணைப்பு உருவாகிறது.
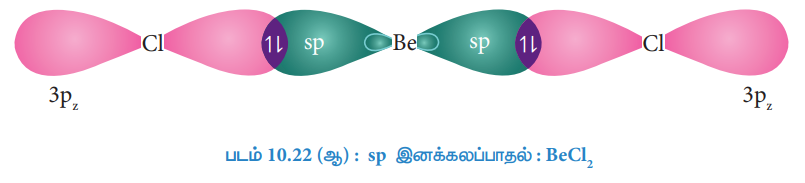
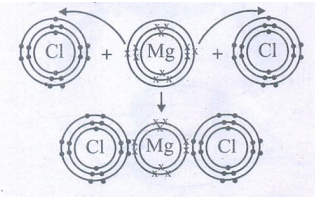
MgCl2 பிணைப்பு உருவாதல்
Mg (Z = 12) இரு எலக்ட்ரான்களை, இழந்து Ne-ன் அமைப்பைப் பெறுகிறது.
Mg → Mg2+ + 2e-
(2,8,2) (2,8)
Mg இழந்த இரு எலக்ட்ரான்களை , இரு Cl அணுக்கள் தலா ஒன்று வீதம் ஏற்று Ar -ன் அமைப்பைப் பெறுகின்றன.
2Cl + 2e- → 2Cl-
(2,8,7) (2,8,8)
Mg2+ ஆனது இரண்டு 2Cl- அயனிகளுடன் பிணைந்து MgCl2 – மூலக்கூறை உருவாக்குகிறது.
43. σ மற்றும் π பிணைப்புகளில் எது வலிமையானது? ஏன்?
விடை :
● இரு அணு ஆர்பிட்டால்கள் அச்சுகளின் வழியே மேற்பொருந்தும் போது σ -பிணைப்பும், பக்கவாட்டில் மேற்பொருந்தும் போது π - பிணைப்பும் உருவாகின்றன.
● இவற்றுள் σ- பிணைப்பு வலிமையானது.
● காரணம் நேர்கோட்டு மேற்பொருந்துதல் (Head- on overlap) பக்கவாட்டு மேற்பொருந்துதலை விட (Side - by - side overlap) வலிமையானது.
44. பிணைப்பு ஆற்றல் வரையறு.
விடை :
வாயு நிலையிலுள்ள ஒரு மூலக்கூறின் ஒரு மோல் பிணைப்பைப் பிளக்கத் தேவைப்படும் குறைந்தபட்ச ஆற்றலின் அளவு பிணைப்பு ஆற்றல் எனப்படும். பிணைப்பு ஆற்றலின் அலகு KJmol-1
45. ஹைட்ரஜன் வாயுவானது ஈரணு மூலக்கூறாகும், அதேசமயம் மந்த வாயுக்கள் ஓரணு வாயுக்களாகும், மூலக்கூறு ஆர்பிட்டால் (MO) கொள்கையின் அடிப்படையில் விளக்குக.
விடை :
● மூலக்கூறு ஆர்பிட்டால் கொள்கையின் அடிப்படையில்
பிணைப்புத்தரம் = Nb – Na / 2
Nb - பிணைப்பு மூலக்கூறு ஆர்பிட்டால்களிலுள்ள மொத்த e- கள்
● Na - எதிர் பிணைப்பு மூலக்கூறு ஆர்பிட்டால்களிலுள்ள மொத்த e- கள்
● பிணைப்புத் தரத்திலிருந்து பிணைப்புகளின் எண்ணிக்கையை அறியலாம்.
● ஹைட்ரஜன் மூலக்கூறு ஆர்பிட்டால் வரைபடத்திலிருந்து, Nb = 2, Na = 0 எனவே பிணைப்புத்தரம் = 1. H-H
● ஹீலியம் மூலக்கூறு MO வரைபடத்தில்
Nb = Na = 2
எனவே பிணைப்புத்தரம் = 0.
He2 மூலக்கூறு உருவாவதில்லை.
46. முனைவுற்ற சகப்பிணைப்பு என்றால் என்ன? எடுத்துக்காட்டுடன் விவரி,
விடை :
● மாறுபட்ட e- கவர்தன்மை கொண்ட அணுக்களுக்கு இடையே சகப்பிணைப்பு உருவாகும்போது, அவற்றுள் அதிக எலக்ட்ரான் கவர்தன்மை கொண்ட அணு, பிணைப்பு எலக்ட்ரான்களை அதிகமாக ஈர்க்கும் தன்மை பெற்றுள்ளது.
● இதனால், அந்த அணுவின் மீது பகுதி எதிர்மின் சுமையும், மற்றொரு அணுவின் மீது பகுதி நேர்மின் சுமையும் உருவாகின்றன. இதுவே முனைவுற்ற சகப்பிணைப்பு எனப்படுகிறது.
● உதாரணம்: HF மூலக்கூறு Hδ+- H δ-
(H மற்றும் Fன் e- கவர்தன்மைகள் முறையே 2.1 மற்றும் 4.0)
47. x- அச்சை மூலக்கூறு அச்சாகக் கருதினால், பின்வருவனவற்றுள் எவை சிக்மா பிணைப்பை உருவாக்கக்கூடும்?
i) ls மற்றும் 2py
ii) 2Px மற்றும் 2Px
iii) 2px மற்றும் 2pz
iv) ls மற்றும் 2pz
விடை :
i) 1s மற்றும் 2py
H - Cσ - பிணைப்பு (CH4மூலக்கூறு)
ii) 2px மற்றும் 2px
B - B σ - பிணைப்பு (B2 மூலக்கூறு)
iii) 2px மற்றும் 2pz
C = Nπ - பிணைப்பு (HCN மூலக்கூறு)
iv) 1s மற்றும் 2p
H - N σ - பிணைப்பு (NH3 மூலக்கூறு)
48. கார்பனேட் அயனியை மேற்கோளாக கொண்டு ஒத்திசைவை விளக்குக.
விடை :
கார்பனேட் அயனி CO32- க்கு பின்வரும் மூன்று உடனிசைவு வடிவமைப்புகளை வரைய இயலும்.
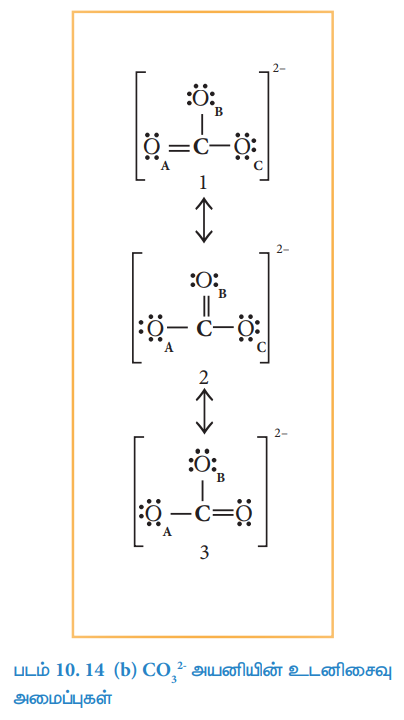
● இந்த வடிவமைப்புகளில் அணுக்கள் அமைந்துள்ள இட அமைவு மாறுவதில்லை.
● பிணைப்பின் இட அமைவு மற்றும் தனித்த இரட்டை எலக்ட்ரான்களின் இட அமைவு மட்டுமே மாறுபடுகிறது.
● இந்த அமைப்புகள் உடனிசைவு அமைப்புகள் எனவும், இந்நிகழ்வு உடனிசைவு எனவும் அழைக்கப்படுகின்றன.
49. எத்திலீன் மற்றும் அசிட்டிலீனில் பிணைப்புகள் உருவாதலை விளக்குக.
விடை :
எத்திலீனில் பிணைப்புகள் உருவாதல் :
● எத்திலீன் மூலக்கூறு வாய்பாடு C2H4. கார்பனின் எலக்ட்ரான் அமைப்புகள்
அடி ஆற்றல் நிலையில்

கார்பனின் 4 இணைதிறனை நிறைவு செய்ய 2s ஆர்பிட்டாலிலிருந்து ஒரு e- யை 2pz ஆர்பிட்டாலுக்கு கிளர்வுற செய்ய வேண்டும்.
கிளர்வுற்ற நிலையில்
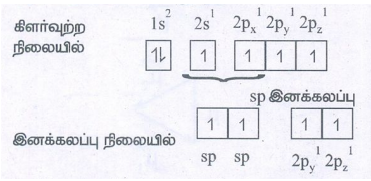
● ஒவ்வொரு கார்பன் அணுவிலும் 3 சமமான sp2 இனக்கலப்படைந்துள்ள ஆர்பிட்டால்கள் உருவாகின்றன. இவை ஒன்றுக்கொன்று 120° கோண இடைவெளியில் x y தளத்தில் அமைகின்றன. 2pz ஆர்பிட்டால் தளத்திற்கு செங்குத்தாக உள்ளது.
● இரு கார்பன் அணுக்களின் ஒவ்வொரு sp2 இனக்கலப்பு ஆர்பிட்டால்கள் ஒரே நேர்கோட்டில் மேற்பொருந்தி C - C σ- பிணைப்பை உருவாக்குகின்றன.
● இரு கார்பன் அணுக்களின் மற்ற இரண்டு sp2 இனக்கலப்பு ஆர்பிட்டால்கள் நான்கு ஹைட்ரஜன் அணுக்களின் 1 s ஆர்பிட்டால்களுடன் ஒரே நேர்கோட்டில் மேற்பொருந்தி 4C-H
σ -பிணைப்புகளை உருவாக்குகின்றன.
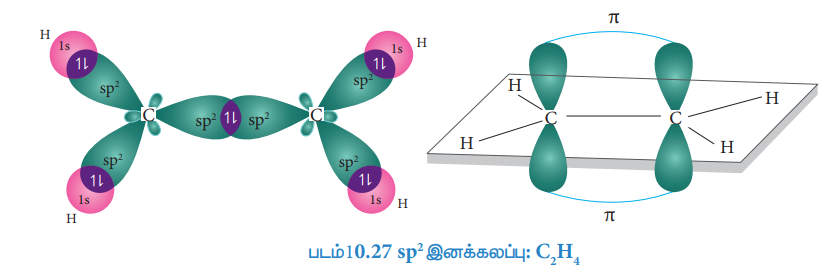
● இரு கார்பன் அணுக்களின் இனக்கலப்பில் ஈடுபடாத 2Pz ஆர்பிட்டால்களும் பக்கவாட்டில் மேற்பொருந்தி π - பிணைப்பு உருவாகிறது.
அசிட்டிலீனில் பிணைப்புகள் உருவாதல் :
● அசிட்டிலீன் மூலக்கூறு வாய்பாடு C2H2.
கார்பனின் எலக்ட்ரான் அமைப்புகள்
அடி ஆற்றல் நிலையில்

கார்பனின் 4 இணைதிறனை நிறைவு செய்ய 2s ஆர்பிட்டாலிலிருந்து ஒரு எலக்ட்ரான் 2pz ஆர்பிட்டாலுக்கு கிளர்வுறுகிறது.
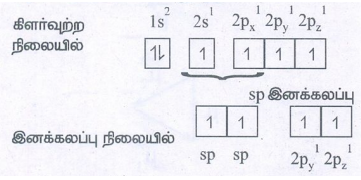
● ஒவ்வொரு C அணுவிலும் 2 சமமான sp இனக்கலப்படைந்த ஆர்பிட்டால்கள் உருவாகின்றன. இனக்கலப்படையாத 2py மற்றும் 2pz ஆர்பிட்டால்கள் மூலக்கூறு அச்சிற்கு செங்குத்தாக உள்ளன.
● ஒவ்வொரு கார்பனின் ஒரு sp இனக்கலப்பு ஆர்பிட்டால்கள், ஒரே நேர்கோட்டில் மேற்பொருந்தி C – C σ பிணைப்பை உருவாக்குகின்றன.
● இரு கார்பன்களின் மற்றொரு sp இனக்கலப்பு ஆர்பிட்டால்கள், இரு ஹைட்ரஜன் அணுக்களின் 1s ஆர்பிட்டால்களுடன் ஒரே நேர்கோட்டில் மேற்பொருந்தி 2C – H σ - பிணைப்புகளை உருவாக்குகின்றன.
● இரு கார்பனணுக்களிலும் உள்ள இனக்கலப்பில் ஈடுபடாத 2py மற்றம் 2pz ஆர்பிட்டால்கள் பக்கவாட்டில் மேற்பொருந்தி இரு π- பிணைப்புகள் உருவாகின்றன.

50. பின்வரும் வடிவங்களில், என்னவகை இனக்கலப்புகள் நிகழசாத்தியப்படும்?
அ) எண்முகி
ஆ) நான்முகி
இ) சதுரதளம்
விடை :

51. VSEPR கொள்கையை விளக்குக. இக்கொள்கையை பயன்படுத்தி IF7, மற்றும் SF6 ஆகியவற்றின் வடிவமைப்புகளை கண்டுபிடி
விடை :
IF7 வடிவமைப்பு:
● அயோடின் அணுவின் இணைதிறன் கூட்டு e- அமைப்பு
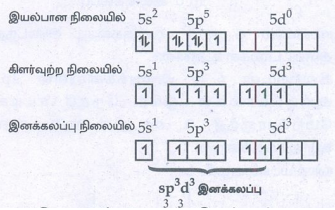
● அயோடினில் 7 sp3 d3 இனக்கலப்பு அடைந்த ஆர்பிட்டால்கள் உள்ளன.
● இவற்றுடன் ஏழு F அணுக்களிலுள்ள 2pz ஆர்பிட்டால்கள் ஒரே நேர்கோட்டில் மேற்பொருந்தி ஏழு σ- பிணைப்புகளை உருவாக்குகின்றன.
● வடிவம்: ஐங்கோண இருபிரமிடு.
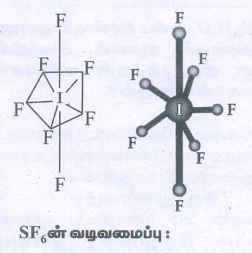
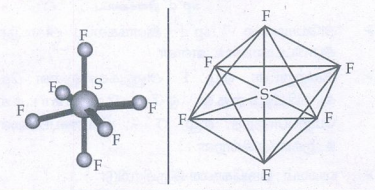
SF6 ன் வடிவமைப்பு :
● சல்ஃபர் அணுவின் இணைதிறன் கூட்டு e- அமைப்பு
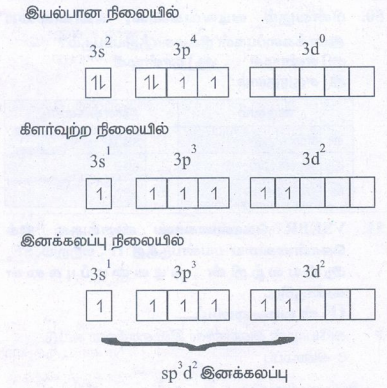
● சல்ஃபரில் 6 sp3 d2 இனக்கலப்பு அடைந்த ஆர்பிட்டால்கள் உள்ளன.
● இவற்றுடன் 6 F அணுக்களிலுள்ள 2pz ஆர்பிட்டால்கள் ஒரே நேர்கோட்டில் மேற்பொருந்தி 6 σ- பிணைப்புகளை உருவாக்குகின்றன.
● வடிவம்: எண்முகி.
52. CO2 மற்றும் H2O ஆகிய இரண்டும் மூவணு மூலக்கூறுகளாகும் ஆனால் அவற்றின் இருமுனை திருப்புத் திறன் மதிப்புகள் வெவ்வேறாக உள்ளன. ஏன்?
விடை :
CO2 :
● மூலக்கூறின் வடிவம் : நேர்க்கோட்டு அமைப்பு
● இரு முனைவுற்ற C-O பிணைப்புகள் உள்ளன. ஆனால் இருமுனைத்திருப்புத்திறன் = O.
● காரணம் : இரு முனைவுற்ற C - O பிணைப்புகளும், சம மதிப்புடைய எதிரெதிர் திசையிலான இருமுனைத் திருப்புத் திறன்களைப் பெற்றுள்ளன.
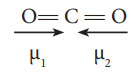
அதாவது, நிகர இருமுனைத் திருப்புத்திறன்
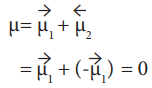
H2O
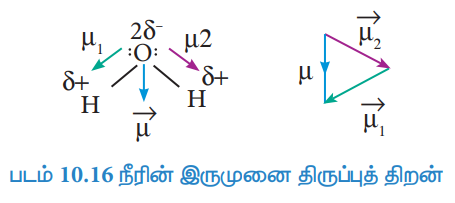
● நீரின் நிகர இருமுனைத் திருப்புத்திறன்
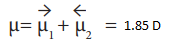
53. பின்வருவனவற்றுள் எந்த ஒன்று அதிகபட்ச பிணைப்புத் தரத்தைக் கொண்டுள்ளது?
N2 , N+2 அல்லது N-2
விடை :

எனவே, அதிகபட்ச பிணைப்புத்தரம் கொண்டது N2 ஆகும்.
54. அயனிப் பிணைப்பிலுள்ள சகப்பிணைப்புத் தன்மையை விளக்குக.
விடை :
● அயனிச் சேர்மங்கள் பகுதி சகப்பிணைப்புத் தன்மையினைப் பெற்றுள்ளன.
● உதாரணம்: LiCl - இது ஒரு அயனிச்சேர்மம். ஆனால் பகுதி சகப்பிணைப்புத் தன்மை பெற்றுள்ளது. எனவே, எத்தனாலில் கரைகிறது. இப்பண்பை 'முனைவுறுதல்' மூலம் விளக்கலாம்.
● நேர்மின் அயனியானது, எதிர்மின் அயனியின் இணைதிறன் எலக்ட்ரான்களைக் கவருகிறது. ஆனால், அதன் அணுக்கருவை விலக்குகிறது.
● இதனால், எதிர்மின் அயனியின் எலக்ட்ரான் மேகம் உருக்குலைந்து, அதன் எலக்ட்ரான் அடர்த்தி நேர்மின் அயனியை நோக்கி நகருகிறது.
● இதன் விளைவாக இரு அயனிகளுக்கிடையே சிறிது எலக்ட்ரான் பங்கீடு ஏற்படுகிறது. அதாவது, பகுதி சகப்பிணைப்புத் தன்மை ஏற்படுகிறது. இந்நிகழ்வே 'முனைவுறுதல்' எனப்படுகிறது.
● ஒரு எதிர்மின் அயனியை முனைவுறச் செய்யும் நேர்மின் அயனியின் திறன் அதன் 'முனைவுறுத்தும் திறன்' எனப்படும்.
55. ஃபஜான் விதியை விளக்குக.
விடை :
● அயனிச் சேர்மங்களில் எந்த அளவிற்கு முனைவாக்கம் நிகழ்கிறது என்பதை ஃபஜான் விதி மூலம் அறியலாம்.
● நேர்மின் அயனியின் மின்சுமை அதிகரிக்கும்போது, எதிர்மின் அயனியின் எலக்ட்ரான் மேகத்தின் மீது அது செலுத்தும் கவர்ச்சி விசையும் அதிகரிக்கிறது.
● எதிர்மின் அயனியின் மின்சுமை எண் மதிப்பு அதிகரிக்கும்போது, அதன் முனைவுறும் திறன் அதிகரிக்கிறது.
● நேர் அயனி மற்றும் எதிர் அயனியின் மின்சுமை அதிகமாக இருப்பின் சகப்பிணைப்புத் தன்மை அதிகரிக்கும்.
● உதாரணம் : AlCl3, MgCl2, NaCl மூலக்கூறுகளைக் கருதுவோம்.
● நேர்மின் அயனிகளின் மின்சுமை வரிசை :
Na+ < Mg2+ < Al3+
● சகப்பிணைப்புத் தன்மை வரிசை :
NaCl < MgCl2 < AlCl3.
● சகப்பிணைப்புத் தன்மை: LiCl > NaCl
காரணம், Li+ன் உருவளவு < Na+ ன் உருவளவு. எனவே Li+ ன் முனைவுறுத்தும் திறன் அதிகம்.
● சகப்பிணைப்புத் தன்மை: Lil > LiCl
காரணம், I- ன் உருவளவு > Cl- ன் உருவளவு. எனவே I- ன் முனைவுறும் தன்மை அதிகம்.