11 வது வேதியியல் : அலகு 10 : வேதிப் பிணைப்புகள்
பாடச்சுருக்கம்: வேதிப் பிணைப்புகள்
பாடச்சுருக்கம்
மூலக்கூறுகளிலுள்ள அணுக்களுக்கிடையே உள்ள கவர்ச்சிவிசையே வேதிப்பிணைப்பு எனப்படும். முதன்முதலில் கோசல் மற்றும் லூயிஸ் ஆகிய அறிஞர்கள் வேதிப்பிணைப்பிற்கான தர்க்கரீதியான விளக்கங்களை அளித்தனர். வேதிப்பிணைப்பு உருவாகும் போது ஒன்று (அ) அதற்கு மேற்பட்ட அணுக்கள் எலக்ட்ரான்களை ஏற்பதன் மூலமோ அல்லது இழப்பதன் மூலமோ அல்லது பங்கீட்டின் மூலமோ தமக்கு அருகிலுள்ள மந்தவாயுவின் எலக்ட்ரான் அமைப்பை பெற முயல்கின்றன. இணைதிறன் கூட்டில் எட்டு எலக்ட்ரான் அமைப்பினை பெற்றுள்ள மந்தவாயுக்கள் நிலைப்புத் தன்மை உள்ளவைகளாக கருதப்படுகின்றன. வேதிப் பிணைப்பு பற்றிய கோசல் - லூயிஸ் அணுகுமுறையானது எண்மவிதி உருவாக காரணமாக அமைந்தது. அதன்படி ஒரு வேதிப்பிணைப்பில் ஈடுபடும் அனைத்து அணுக்களும் தங்களது இணைதிறன் கூட்டில் 8 எலக்ட்ரான்களைப் பெறும் வகையில் தங்களுக்குள் எலக்ட்ரான்களைப் பரிமாற்றம் அல்லது பங்கீடு செய்து கொள்கின்றன.
வேதிப்பிணைப்பில் பல்வேறு வகைகள் உள்ளன. NaCl போன்ற மூலக்கூறுகளில் Na அணு இழக்கும் ஒரு எலக்ட்ரானை Cl அணு ஏற்பதால் Na+ மற்றும் Cl- அயனிகள் உருவாகின்றன. இந்த அயனிகள் நிலைமின்னியல் ஈர்ப்பு விசையினால் பிணைக்கப்பட்டுள்ளன, இப்பிணைப்பே அயனிப் பிணைப்பு ஆகும். மேலும் சில சேர்மங்களில் எலக்ட்ரான்கள் முழுவதுமாக பரிமாற்றம் செய்யப்படாமல் இரு அணுக்களுக்கிடையே பங்கிடப்படுகின்றன. இணையும் இரு அணுக்களும் அவைகளுக்கிடையே பங்கிடப்பட்ட எலக்ட்ரான்களின் மீதான சமமான கவர்ச்சிவிசையால் ஒன்றோடொன்று பிணைக்கப்பட்டுள்ளன. இதுவே சகப்பிணைப்பு எனப்படும். இவ்வகை பிணைப்புகளுடன் இணையும் இரு அணுக்களுக்கிடையே ஒரு அணு மட்டும் சகப்பிணைப்பிற்கு தேவையான எலக்ட்ரானை வழங்கும் ஈதல் சகப்பிணைப்பும் சில சேர்மங்களில் காணப்படுகிறது. மேலும் உலோகங்களில் உலோகப் பிணைப்பு எனும் ஒரு வகைப் பிணைப்பு காணப்படுகிறது. லூயிஸ் கொள்கையுடன் VSEPR கொள்கையை பயன்படுத்தி மூலக்கூறுகளின் வடிவங்களைத் தீர்மானிக்க இயலும். இக்கொள்கையின்படி மூலக்கூறுகளின் மைய அணுவைச்சுற்றி காணப்படும் இணைதிற கூட்டு எலக்ட்ரான் இரட்டைகளைப் பொருத்து (பிணைப்பு இரட்டை மற்றும் தனித்த இரட்டை) அதன் வடிவமைப்பு அமைகிறது. ஒவ்வொரு இணைதிற கூட்டு எலக்ட்ரான் இரட்டையும் ஒன்றையொன்று விலக்குகின்றன. எனவே இவ்விலக்கு விசையை குறைக்கும் வகையில் அவைகள் எவ்வளவு தூரம் விலகி இருக்க இயலுமோ, அவ்வகையில் புறவெளியில் அமைகின்றன. ஹைய்ட்லர் மற்றும் லண்டன் ஆகிய அறிவியல் அறிஞர்கள் ஹைட்ரஜன் மூலக்கூறில் சகப்பிணைப்பு உருவாதலை, எலக்ட்ரானின் அலை இயக்கவியலை அடிப்படையாகக் கொண்டு கருத்தியலாக விளக்கினார்கள். இக்கருத்துக்கள் பாலிங் மற்றும் ஸ்லேட்டர் ஆகியோர்களால் மேலும் மேம்படுத்தப்பட்டது. இவர்களின் கொள்கையின் படி இரு அணுக்களின் சரிபாதி நிரம்பியுள்ள ஆர்பிட்டால்கள் மேற்பொருந்தும்போது அவைகளுக்கிடையே சகப்பிணைப்பு உருவாகிறது. லினஸ் பாலிங் இனக்கலப்பாதல் என்ற கருத்தினை அறிமுகப்படுத்தினார். ஒரே அணுவின், ஒப்பிடத்தக்க அளவு ஆற்றலுடைய அணு ஆர்பிட்டால்கள் ஒன்றோடொன்று கலந்து, சம எண்ணிக்கையில் சம ஆற்றலை பெற்றுள்ள புதிய சமமான ஆர்பிட்டால்களை தரும் செயல்முறை இனக்கலப்பாதல் என வரையறுக்கப்படுகிறது. இனக்கலப்பாதலில், sp, sp2, sp3, sp3,d2..... போன்ற வெவ்வேறு வகைகள் உள்ளன.
F. ஹீண்ட் மற்றும் ராபர்ட் S. முல்லிக்கன் ஆகிய அறிஞர்கள் மூலக்கூறு ஆர்பிட்டால் கொள்கை என்ற பிணைப்பு பற்றிய கொள்கையினை உருவாக்கினர். இக்கொள்கையின்படி, அணுக்கள் இணைந்து மூலக்கூறுகளை உருவாக்கும் போது, அணு ஆர்பிட்டால்கள் தங்களின் தனித்துவத்தினை இழக்கின்றன. மேலும் மூலக்கூறு ஆர்பிட்டால்கள் உருவாகின்றன இத்தகைய மூலக்கூறு ஆர்பிட்டால்களில் எலக்ட்ரான்கள் நிரப்பப்படுதல் அணு ஆர்பிட்டால்களில் எலக்ட்ரான்கள் நிரப்பப்படுதலைப் போன்றே ஆஃபா கொள்கை, பாலியின் தவிர்ப்புக்கொள்கை மற்றும் ஹீண்ட்விதி ஆகியனவற்றை பின்பற்றி நிகழ்கிறது.
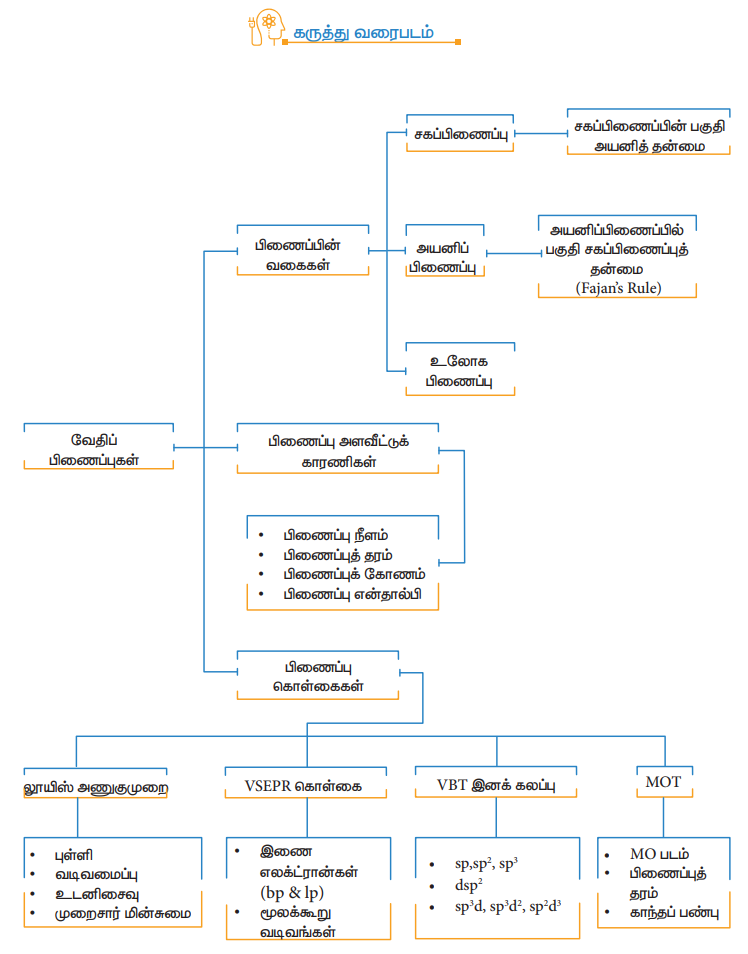
கருத்து வரைபடம்
இணையச் செயல்பாடு
மூலக்கூறுகளின் வடிவங்கள் (VSEPR கொள்கை)
இச்செயல்முறையை பயன்படுத்துவதன் மூலம், நீங்கள் வெவ்வேறு எண்ணிக்கையிலான பிணைப்பு மற்றும் தனித்த எலக்ட்ரான் இரட்டைகளை கொண்ட மூலக் கூறுகளை உருவாக்கவும், காணவும் முடியும்.
https://phet.colorado.edu/sims/html/ molecule-shapes/latest/molecule shapes_en.html
உரலிக்குச் செல்க அல்லது வலது புறத்தில் உள்ள விரைவுத் துலக்கக் குறியீட்டினை (QR code) ஸ்கேன் செய்க.
நிலைகள்:
● இணையப் பக்கத்தினை திறந்து, கொடுக்கப்பட்ட உரலியை(URL) தட்டச்சு செய்க (அல்லது) விரைவுத் துலக்கக் குறியீட்டினை (QR code) ஸ்கேன் செய்க.
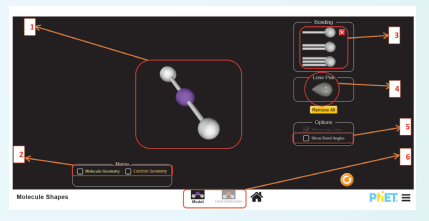
● வலைப்பக்கத்தில் கொடுக்கப்பட்டுள்ள "modals" பொத்தானை அழுத்தவும். நீங்கள், தற்போது கீழே காட்டப்பட்டுள்ளவாறு வலைப்பக்கத்தினை காண்பீர்கள்.
● இப்பொழுது, பெட்டி 3 மற்றும் 4 ல் கொடுக்கப்பட்டுள்ள விருப்பங்களிலிருந்து பிணைப்பு எலக்ட்ரான் இரட்டை மற்றும் தனித்த எலக்ட்ரான் இரட்டைகளின் எண்ணிக்கையை தேர்ந்தெடுப்பதன் மூலம், அதைச் சார்ந்த மூலக்கூறின் வடிவமைப்பை நீங்கள் காண்பீர்கள்.
● பெட்டி 5 ல் குறிப்பிடப்பட்டுள்ள "show bond angles" பொத்தானை சொடுக்குவதன்மூலம், பிணைப்புகளுக்கிடையேயான பிணைப்புக் கோணங்களை நீங்கள் காண முடியும்.
● பெட்டி 2 ல் கொடுக்கப்பட்டுள்ள தொடர்புடைய வாய்ப்புகளை தேர்ந்தெடுப்பதன் மூலம் மூலக்கூறு வடிவமைப்பு மற்றும் எலக்ட்ரான் வடிவமைப்புகளையும் நீங்கள் காண முடியும்.
● எளிய மூலக்கூறுகளின் வடிவமைப்புகள்:
● பெட்டி 6 ல் குறிப்பிடப்பட்டுள்ள "real molecules" பொத்தானை தேர்ந்தெடுப்பதன் மூலம் கீழே குறிப்பிடப்பட்டுள்ளவாறு திரையை காணமுடியும். இந்த திரையில், பெட்டி 7 ல் குறிப்பிடப்படுள்ள dropdown menu வை பயன்படுத்தி ஒரு மூலக்கூறை நீங்கள் தேர்ந்தெடுக்க முடியும். பெட்டி 8 இல் உள்ள விருப்பங்களை பயன்படுத்தி நீங்கள் மூலக்கூறுகளில் உள்ள தனித்த இரட்டை மற்றும் பிணைப்பு இரட்டைகளை காண முடியும்.