அணு மற்றும் அணுக்கரு இயற்பியல் | இயற்பியல் - நெடுவினாக்கள் | 12th Physics : UNIT 9 : Atomic and Nuclear Physics
12 ஆம் வகுப்பு இயற்பியல் : அலகு 9 : அணு மற்றும் அணுக்கரு இயற்பியல்
நெடுவினாக்கள்
III. நெடுவினாக்கள்
1. எலக்ட்ரானின் மின்னூட்ட எண்ணைக் கண்டறிய உதவும் ஜே.ஜே. தாம்சன் ஆய்வினை விவரிக்கவும்.
• ஓரலகு நிறைக்கான மின்னூட்டமே, மின்னூட்ட நிறைத்தகவு எனப்படும்.
தத்துவம்:
• கேத்தோடுக்கதிர்களை (எலக்ட்ரான்களை) மின்புலத்தாலும், காந்தப்புலத்தாலும் விலகமடையச் செய்யும் தத்துவம் இம்முறையில் பயன்படுகிறது.
அமைப்பு:
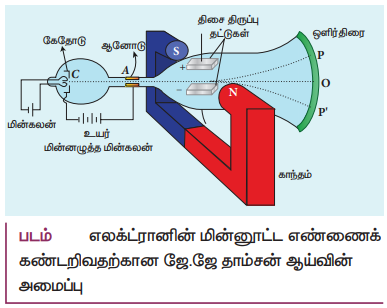
எலக்ட்ரானின்ன மின்னூட்ட எண்ணைக் கண்டறிவதற்கான ஜே.ஜே. தாம்ச்ன ஆய்வின் அமைப்பு
• உயர் வெற்றிட மின்னிறக்கக்குழாய் பயன்படுத்தப்படுகிறது.
• கேதோடிலிருந்து வெளியேறும் கேதோடு கதிர்களானது ஆனோடு வட்டு A யால் கவரப்பட்டு அதில் உள்ள சிறுதுளை வழியாக செல்லுவதால் அவை குறுகிய கேதோடு கதிர்களாக அனுப்பப்படுகின்றன.
• குறிப்பிட்ட மின்னழுத்த வேறுபாட்டில் உள்ள இணையான உலோகத்தகடுகளுக்கு இடையே செலுத்தப்படுகின்றன. ஒன்றுக்கொன்று செங்குத்தான திசையிலுள்ள மின் மற்றும் காந்தப்புலங்களுக்கு இடையில் மின்னிறக்கக் குழாய் வைக்கப்பட்டு உள்ளது.
• கேதோடு கதிர்கள் திரையில் பட்டவுடன் ஒளிர்தலை ஏற்படுத்துவதால், ஒரு ஒளிர்வுப்புள்ளி தோன்றுகிறது.
• திரையில் துத்தநாக சல்பைடு (ZnS) பூச்சு அளிப்பதன் மூலம் இந்த ஒளிர்தல் ஏற்படுகிறது.
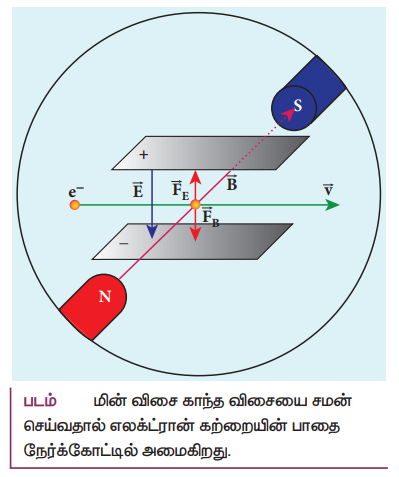
கேதோடு கதிர்களின் திசைவேகத்தைக் கண்டறிதல்:
• தகடுகளுக்கிடையே, மின்புலம் மற்றும் காந்தப்புலம் ஒன்றையொன்று சமன் செய்வதன் மூலம் எலக்ட்ரான் கற்றை முதலில் இருந்த O புள்ளியை வந்து அடையுமாறு செய்யப்படுகிறது.
மின்விசை = காந்த விசை
eE = eBv
⇒ v = E/B --------------(1)
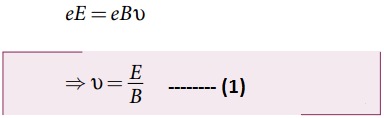
மின்னூட்ட எண்ணைக் கண்டறிதல்:
• கேதோடிலிருந்து ஆனோடிற்கு கேதோடு கதிர்கள் (எலக்ட்ரான் கற்றை) முடுக்கப்படுவதால், கேதோடில் எலக்ட்ரான் கற்றை பெறும் மின்னழுத்த ஆற்றலானது அது ஆனோடை அடையும் போது பெற்றுள்ள இயக்க ஆற்றலுக்குச் சமமாகும்.
• ஆற்றல் மாறா தத்துவத்தின் படி,
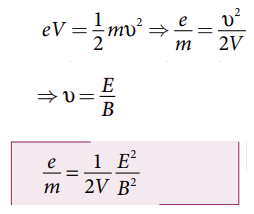
E, B மற்றும் V மதிப்புகளைப் பிரதியிட மின்னூட்ட எண்ணின் மதிப்பு
e/m = 1.7 × 1011 Ckg −1 எனக் கண்டறியப்பட்டுள்ளது.
2. எலக்ட்ரானின் மின்னூட்ட மதிப்பைக் கண்டறிய உதவும் மில்லிகன் எண்ணெய்த் துளி ஆய்வினை விவரிக்கவும்
எலக்ட்ரானின் மின்னூட்ட மதிப்பு காணல் − மில்லிகனின் எண்ணெய்த்துளி ஆய்வு.
தத்துவம்: மின்புலத்தைத் தகுந்த முறையில் மாற்றுவதன் மூலம் எண்ணெய்த் துளியின் இயக்கத்தைக் கட்டுப்படுத்தலாம். அதாவது அதை மேல் நோக்கியோ அல்லது கீழ் நோக்கியோ நகரச் செய்யலாம் அல்லது புலத்திலேயே நிலையாக இருத்தி அதிக நேரம் அதை பார்க்கும் வண்ணமும் செய்யலாம்.
அமைப்பு:
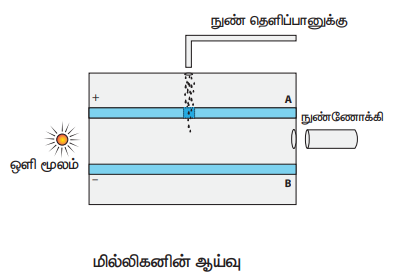
• A மற்றும் B உலோகத்தட்டுகள் ஆனது வட்டவடிவம் உடையது. 20 cm விட்டம் உடையது மற்றும் அவற்றுக்கான இடைவெளி 1.5 cm ஆகும். மேலும் கிடைத்தளமாக உள்ளது.
• இது கண்ணாடி சுவர்கள் கொண்ட கலனால் சூழப்பட்டுள்ளன.
• கிட்டத்தட்ட 10 KV உயர் மின்னழுத்த வேறுபாடு அளிக்கப்படுவதால் செங்குத்தாக, கீழ்நோக்கிய திசையில் மின்புலம் ஏற்படுகிறது.
• நுண்தெளிப்பான் உதவியுடன் கிளிசரின் போன்ற அதிக பாகுநிலை கொண்ட திரவம் தெளிக்கப்படும் போது, சிறுதுளிகள் மேல்தட்டு A−ல் ஒரு சிறிய துளையின் வழியே ஈர்ப்பு விசையினால் கீழே விழுகின்றன.
• காற்றுடன் ஏற்படும் உராய்வு அல்லது X−கதிர்களைக் காற்றினூடே செலுத்துவதால் கலனிலுள்ள சில எண்ணெய்த் துளிகள் மின்னூட்டத்தைப் பெறுகின்றன. மேலும் கிடைமட்டத் திசையில் கலன் ஒளியூட்டப்படுவதால், ஒளிக்கற்றைக்கு செங்குத்தாக வைக்கப்பட்டுள்ள நுண்ணோக்கியின் மூலம் துளிகளைத் தெளிவாகக் காண முடியும்.
• மின்புலத்தைத் தகுந்த முறையில் மாற்றுவதன் மூலம் எண்ணெய்த் துளியின் இயக்கத்தைக் கட்டுப்படுத்தலாம் அதாவது, அதை மேல்நோக்கி அல்லது கீழ்நோக்கி நகரச் செய்யலாம். அல்லது அந்தரத்திலேயே நிலையாக நிறுத்தலாம்.
• எண்ணெய்த் துளியின் நிறை m எனவும், அதன் மின்னூட்டம் q எனவும் கொள்க. எனவே, துளியின் மீது செயல்படும் விசைகள்
அ) புவிஈர்ப்பு விசை Fg = mg
ஆ) மிதப்பு விசை (buoyant force) Fb மற்றும்
இ) பாகியல் விசை Fv
ஈ) மின் விசை Fe = qE
(அ) எண்ணெய்த் துளியின் ஆரம் காணல்
• மின்புலம் இல்லாத நிலையில், எண்ணெய்த் துளி கீழ்நோக்கி முடுக்கம் அடைகிறது. காற்றினால் ஏற்படும் பின்னிழு (பாகியல்) விசையினால் எண்ணெய்த் துளி எளிதில் சீரான திசைவேகத்தை அடைகிறது. இது முற்றுத் திசைவேகம் எனப்படும்.
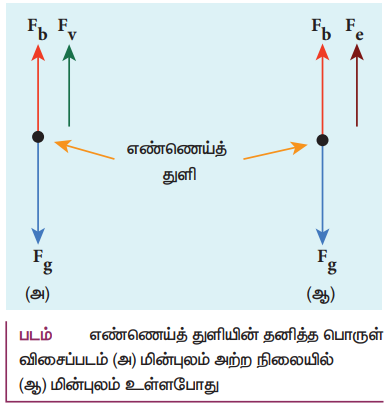
எண்ணெய்த் துளியின் மீது செயல்படும் விசைகள்:
அ) புவிஈர்ப்பு விசை Fg = mg
அடர்த்தி p = m /v ⇒ m = ρ V = ρ[4/3 πr3] ; Fg = ρ[4/3 πr3]g
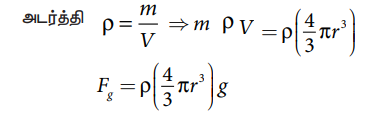
ρ - எண்ணெய்த்துளியின் அடர்த்தி ;
r - எண்ணெய்த்துளியின் ஆரம்
ஆ) மிதப்பு விசை Fb = σ [4/3 πr3]g; σ - காற்றின் அடர்த்தி
இ) ஸ்டோக்ஸ் விதிப்படி, பாகியல் விசை
Fv = 6 πrvղ
மின்புலம் அற்ற நிலையில் Fg = Fb + Fv
ρ[4/3 πr3]g = σ [4/3 πr3]g + 6 πrvղ
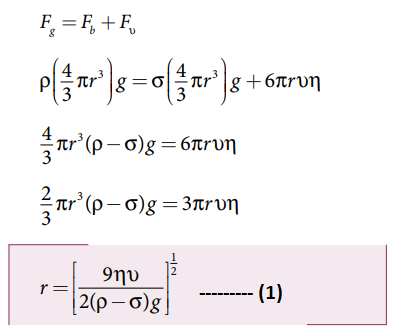
சமன்பாடு (1) ன் மூலம் எண்ணெய்த் துளியின் ஆரத்தைக் கணக்கிடலாம்.
(ஆ) மின்னூட்ட மதிப்பைக் காணல்:
• எண்ணெய்த் துளிகளை சுற்றி மின் புலத்தை ஏற்படுத்தும் போது, அதன் மீது ஒரு மேல்நோக்கிய மின் விசை (qE) செயல்படுகின்றது.
• மின்புலத்தின் வலிமையை சரிசெய்து, அத்துளியை நிலையாக வைக்கவும். பாகியல் விசை எதுவும் செயல்படாது.

• இந்த ஆய்வை பல முறை செய்து, எண்ணெய்த் துளிகளின் மின்னூட்ட மதிப்பைக் கணக்கிட்ட மில்லிகன், எந்தவொரு எண்ணெய்த் துளியின் மின்னூட்ட மதிப்பும் e = −1.6 × 10−19 C என்ற அடிப்படை மதிப்பின் முழு மடங்குகளாக இருப்பதை கண்டறிந்தார். இந்த அடிப்படை மதிப்பே (e = −1.6 × 10−19 C) எலக்ட்ரானின் மின்னூட்ட மதிப்பு ஆகும்.
3. போர் அணு மாதிரியைப் பயன்படுத்தி ஹைட்ரஜன் அணுவின் ஆற்றலுக்கான கோவையைத் தருவிக்கவும்.
• அணுக்கருவைச் சுற்றி எலக்ட்ரான் வட்டப்பாதையில் இயங்கத் தேவையான மையநோக்கு விசையை கூறும் நிலைமின்னியல் கவர்ச்சி விசை அளிக்கின்றது.
• நிலைத்தன்மை பெற்ற சுற்றுப்பாதைகளில் உள்ள எலக்ட்ரானின் கோண உந்தத்தின் மதிப்பானது h/2π ன் முழு மடங்காகவே இருக்கும். இது கோண உந்த குவாண்டமாக்கல் நிபந்தனை எனப்படும்.
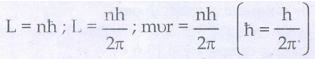
• இரு சுற்றுப்பாதைகளின் ஆற்றல் வேறுபாட்டுக்குச் சமமான ஆற்றல் கொண்ட ஃபோட்டானை உட்கவர்வதனாலோ அல்லது வெளியிடுவதனாலோ மற்றொன்றுக்கு தாவ இயலும்.
∆E = Eஇறுதி − Eதொடக்கம்
∆E = hv
∆E = hc / λ [c = v λ]
• சுற்றுப்பாதையில் உள்ள எலக்ட்ரானின் ஆரம் மற்றும் திசைவேகம்
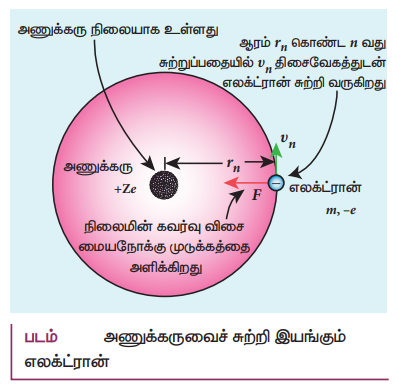
நிலையாகவுள்ள அணுக்கரு மற்றும் rn ஆரம் கொண்ட வட்டப்பாதையில் அணுக்கருவைச் சுற்றி இயங்கும் எலக்ட்ரான் கொண்ட அணு ஒன்றைக் கருதுக.
• அணுக்கருவானது புரோட்டான் மற்றும் நியூட்ரான்களை உள்ளடக்கியது.
புரோட்டான் நேர் மின்தன்மையையும் நியூட்ரான் மின் நடுநிலைமையாகவும் உள்ளதால், அணுக்கருவின் மின்னூட்டம் முழுவதும் புரோட்டான்களின் மின்னூட்டத்தையே சாரும். கூலூம் விதிப்படி,
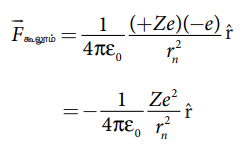
இங்கு
+Ze ⇒ அணுக்கருவின் மின்னூட்டம்
Z ⇒ அணு எண்
−e ⇒ எலக்ட்ரானின் மின்னூட்டம்
இந்த விசையே எலக்ட்ரான் சுற்றுப்பாதையில் இயங்கத் தேவைப்படும் மையநோக்கு விசையை அளிக்கிறது.
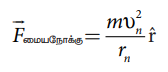
இங்கு
m ⇒ எலக்ட்ரானின் நிறை
vn ⇒ திசைவேகம்
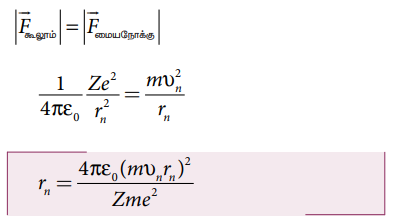
இருபுறமும் m ஆல் பெருக்க
நீல்ஸ்போர் கொள்கையின் படி, கோண உந்த குவாண்டமாக்கல் நிபந்தனை
Mvnrn = ln = nh
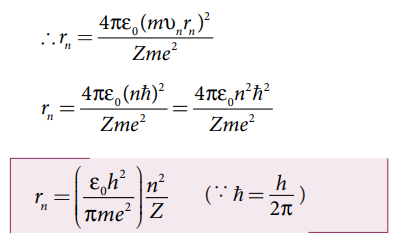
இங்கு εo, h, e மற்றும் π → மாறிலிகள் n ∈ N
சுற்றுப்பாதையின் ஆரம், 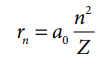
போர் ஆரம் 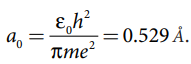
ao = 0.529 Å
நீளத்தின் ஒரு அலகாகப்பயன்படுகிறது
l B0hr = 0.53 Å
ஹைட்ரஜன் அணுக்கு Z = 1
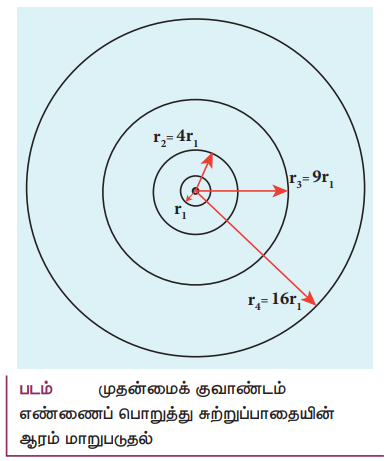
rn = ao n2
rn & n2
முதன்மைக் குவாண்டம் எண்ணைப் பொறுத்து சுற்றுப் பாதையின் ஆரம் மாறுபடுதல்
r1 = ao
r2 = 4ao = 4r1
r3 = 9ao = 9r1
r4 = 16ao = 16r1
n−வது வட்டப்பாதையில் எலக்ட்ரானின் ஆற்றல்:
அ) n−வது சுற்றுப்பாதையின் நிலை மின்னழுத்த ஆற்றல்
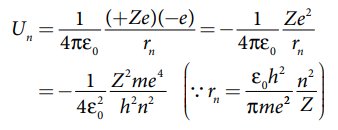
ஆ) n−வது சுற்றுப்பாதையின் இயக்க ஆற்றல்
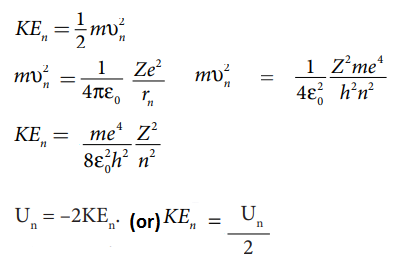
இ) n−வது சுற்றுப்பாதையின் மொத்த ஆற்றல்
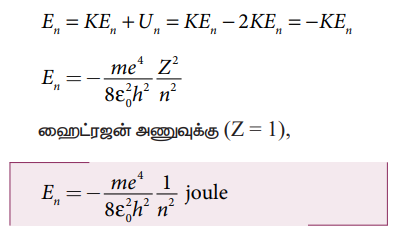
எதிர்க்குறி அணுக்கருவுடன் எலக்ட்ரான் பிணைக்கப்பட்டு உள்ளதைக் காட்டுகிறது.
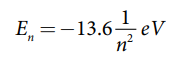
n− முதன்மை குவாண்டம் எண்
• முதல் சுற்றுப்பாதையில் (அடிநிலை) எலக்ட்ரானின் மொத்த ஆற்றல் E1 = 13.6 ev
• இரண்டாவது சுற்றுப்பாதையில் (முதல் கிளர்வு நிலை) எலக்ட்ரானின் மொத்த ஆற்றல் E2 = −3.4 ev
• மூன்றாவது சுற்றுப்பாதையில் (இரண்டாவது கிளர்வு நிலை) எலக்ட்ரானின் மொத்த ஆற்றல் E3 = −1.51 ev
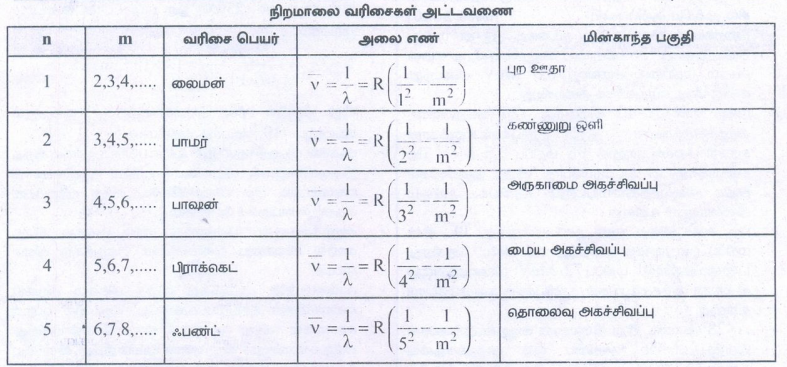
4. ஹைட்ரஜன் அணுவின் நிறமாலை தொடர்களை விளக்குக.
ஹைட்ரஜன் வெளிவிடு நிறமாலை:
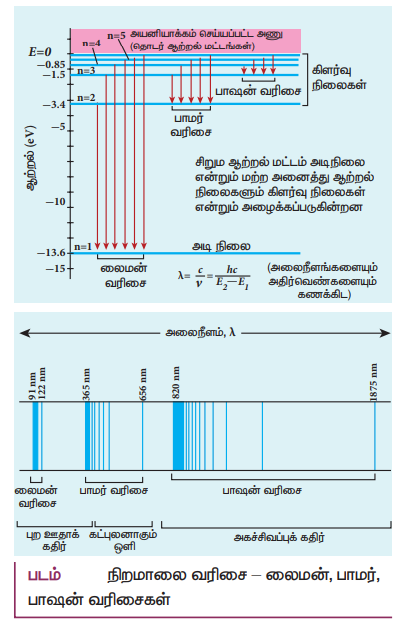
• கிளர்வு நிலைகளில் எலக்ட்ரான்களின் ஆயுட்காலம் மிகக்குறைவாக உள்ளதால் (கிட்டத்தட்ட 10−8s), தன்னியல்பு உமிழ்வின் காரணமாக அவை மீண்டும் அடிநிலைக்குத் தாவுகின்றன.
• எந்த அலைநீளங்களை உட்கவர்வு செய்தனவோ அதே நிறங்களை வெளிவிடுகின்றன.
• ஹைட்ரஜனின் நிறமாலை வரிகள் வெவ்வேறு வரிசைத் தொகுதிகளாக உள்ளது.
• இந்த வரிசைகளுக்கு லைமன் வரிசை, பாமர் வரிசை, பாஷன் வரிசை, பிராக்கெட் வரிசை மற்றும் ஃபண்ட் வரிசை என்று பெயரிடப்பட்டுள்ளன.
• நிறமாலை வரிகளின் அலைநீளங்கள் போர் அணு மாதிரியின் படி,
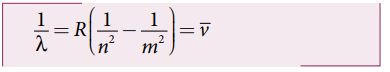
![]() = அலை எண்:
= அலை எண்:
R = ரிட்பர்க் மாறிலி:
R = 1.09737 × 107 m−1
m1,n = நேர்க்குறி முழு எண் [m > n]
5. நிறை எண்ணைப் பொருத்து சராசரி பிணைப்பாற்றலின் மாறுபாட்டை வரைபடத்துடன் விளக்கி அதன் இயல்புகளை விளக்குக.
• ஒரு நியூக்ளியானுக்கான சராசரி பிணைப்பாற்றல் என்பது அணுக்கரு ஒன்றிலிருந்து ஒரு நியூக்ளியானை வெளியேற்றத் தேவைப்படும் ஆற்றலாகும்.
• நியூக்ளியான்களின் எண்ணிக்கை A (நிறை எண்) மதிப்புகளை X−அச்சிலும் அவற்றின் ஒரு நியூக்ளியானுக்கான சராசரி பிணைப்பாற்றல் ![]() மதிப்புகளை Y−அச்சிலும் வைத்து வரைபடம் வரைந்தால் வளைகோடு கிடைக்கின்றது.
மதிப்புகளை Y−அச்சிலும் வைத்து வரைபடம் வரைந்தால் வளைகோடு கிடைக்கின்றது.
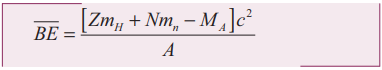
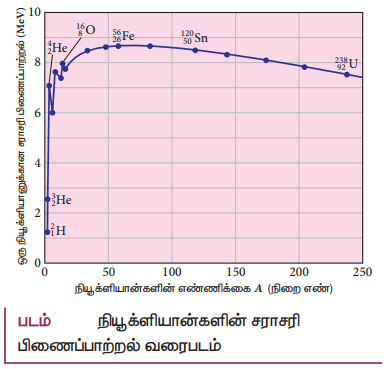
சராசரி பிணைப்பாற்றல் வளைகோடு தொடர்பான சில முக்கிய குறிப்புகள்:
• நிறையெண்ணின் மதிப்பு கூடக்கூட ![]() −ன் மதிப்பு அதிகரித்து, A = 56 (இரும்பு) அணுக்கருவிற்கு அதன் பெரும் மதிப்பை , அதவாது 8.8 MeV அடைந்து, அதன் பிறகு மெதுவாகக் குறைகிறது.
−ன் மதிப்பு அதிகரித்து, A = 56 (இரும்பு) அணுக்கருவிற்கு அதன் பெரும் மதிப்பை , அதவாது 8.8 MeV அடைந்து, அதன் பிறகு மெதுவாகக் குறைகிறது.
• நிறை எண் A = 40 இலிருந்து 120 வரையிலான அணுக்கருக்களின் ஒரு நியூக்ளியானுக்கான சராசரி பிணைப்பாற்றல் ![]() மதிப்பு 8.5 MeV பிற தனிமங்களுடன் ஒப்பிடும்போது இந்த தனிமங்கள் அதிக நிலைத்தன்மையுடனும் கதிரியக்கத்தன்மை இல்லாமலும் உள்ளன.
மதிப்பு 8.5 MeV பிற தனிமங்களுடன் ஒப்பிடும்போது இந்த தனிமங்கள் அதிக நிலைத்தன்மையுடனும் கதிரியக்கத்தன்மை இல்லாமலும் உள்ளன.
• பிற அதிக நிறை எண் தனிமங்களுக்கு, ![]() இன் மதிப்பு மெதுவாகக் குறைந்து கொண்டே வருகிறது. யுரேனியத்தின்
இன் மதிப்பு மெதுவாகக் குறைந்து கொண்டே வருகிறது. யுரேனியத்தின் ![]() மதிப்பு 7.6 MeV. நிலைத்தன்மை இல்லாத இத்தனிமங்கள் கதிரியக்கத் தன்மையோடு உள்ளன.
மதிப்பு 7.6 MeV. நிலைத்தன்மை இல்லாத இத்தனிமங்கள் கதிரியக்கத் தன்மையோடு உள்ளன.
• A < 28 கொண்ட இரு இலேசான அணுக்கருக்களைச் சேர்த்து Å < 56 கொண்ட ஒரு அணுக்கருவை உருவாக்கும் போது படத்தின் படி, இறுதி அணுக்கருவின் ![]() மதிப்பு தொடக்க அணுக்கருவின் மதிப்பைவிட அதிகமாக உள்ளதைக் காணலாம்.
மதிப்பு தொடக்க அணுக்கருவின் மதிப்பைவிட அதிகமாக உள்ளதைக் காணலாம்.
• எனவே, இரு இலேசான தனிமங்களை இணைவு செய்து அதன் மூலம் ஒரு இடைநிலை A மதிப்புடைய தனிம அணுக்கருவை உருவாக்கும் போது, ஏராளமான ஆற்றல் வெளிப்படுகின்றது. இதுவே அணுக்கரு இணைவு (nuclear fusion) என்ற நிகழ்விற்கான அடிப்படையாகவும் ஹைட்ரஜன் குண்டின் தத்துவமாகவும் விளங்குகிறது.
• கனமான தனிமத்தின் அணுக்கருவைப் பிளவு (fission) செய்து இரண்டு அல்லது அதற்கு மேலான, இடைநிலை A மதிப்புடைய அணுக்கருக்களை உருவாக்கும் போதும் ஏராளமான ஆற்றல் வெளிப்படுகின்றது.
• அணு குண்டின் தத்துவமாக இது விளங்குகிறது. மேலும், கட்டுப்பாடற்ற அணுக்கரு பிளவு ஏற்படும் போது தான் அணு குண்டிலிருந்து ஏராளமான ஆற்றல் வெளிப்படுகின்றது.
6. அணுக்கரு விசையைப் பற்றி விளக்குக.
• அணுக்கருவினுள் உள்ள புரோட்டான்கள் ஒரு சில பெர்மி (10−15m) அளவேயுள்ள (மிக நெருங்கிய) தொலைவுகளால் பிரிக்கப்பட்டுள்ளதால், அவற்றிற்கிடையே மிக வலிமையான விலக்கு விசை இருத்தல் வேண்டும்.
• இடைவெளியில் உள்ள புரோட்டான்களுக்கு இடையேவுள்ள நிலைமின்னியல் விலக்கு விசை,
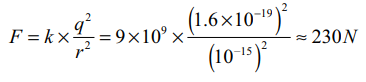
• இவ்விசையால் (230N) ஒரு புரோட்டான் அடையும் முடுக்கம்
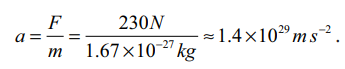
• இது புவியின் ஈர்ப்பு முடுக்கத்தைக் (g) காட்டிலும் கிட்டத்தட்ட 1028 மடங்கு அதிகமாகும்.
• ஆகவே, அணுக்கருவினுள் உள்ள புரோட்டான்கள் இந்த நிலைமின்னியல் விசையை மட்டுமே உணர்வதாகக் கொண்டால், மிக விரைவிலேயே அந்த அணுக்கரு சிதறிப் போயிருக்க வேண்டும்.
• அணுக்கருவைப் பிணைத்து வைத்திருக்கும் இந்த கவர்வு விசையை வலிமையான அணுக்கரு விசை என்பர்.
• வலிமைமிக்க அணுக்கரு விசை மிகவும் குறுகிய எல்லைக்குள் செயல்படக்கூடியது. ஒரு சில பெர்மி தொலைவு வரை மட்டுமே அது செயல்படுகிறது. அணுக்கருவினுள் இரு புரோட்டான்களுக்கு இடையே செயல்படும் கூலூம் விலக்கு விசை மற்றும் ஈர்ப்பு விசைகள் மிகவும் வலிமை குறைந்தவை.
• அதே போல், இரு நியூட்ரான்களுக்கு இடையே நிலவும் ஈர்ப்பு விசையும் கூட அவை இரண்டிற்கும் இடையேயான வலிமைமிக்க அணுக்கரு விசையை விட மிகவும் வலிமை குறைந்தது. எனவே. இயற்கையிலேயே மிகவும் வலிமையானது அணுக்கரு விசையே ஆகும்.
• வலிமைமிக்க அணுக்கரு விசை ஒரு கவர்வு விசையாகும். மேலும் புரோட்டான்−புரோட்டான், புரோட்டான்−நியூட்ரான் மற்றும் நியூட்ரான்−நியூட்ரான் இவற்றிற்கு இடையே அவ்விசை சம வலிமையுடன் (மதிப்புடன்) செயல்படுகின்றது.
• வலிமைமிக்க அணுக்கரு விசை எலக்ட்ரான்களின் மீது செயல்படுவதில்லை. எனவே அது அணுவின் வேதியியல் பண்புகளை மாற்றியமைப்பதில்லை.
7. ஆல்பா சிதைவு நிகழ்வினை எடுத்துக்காட்டுடன் விளக்குக.
ஆல்பா சிதைவு (Alpha decay):
• நிலைத்தன்மையற்ற அணுக்கரு ஒன்று α −துகளை ( 42He அணுக்கரு) வெளியிடும் போது, அது இரு புரோட்டான்களையும் இரு நியூட்ரான்களையும் இழக்கின்றது.
• இதன் விளைவாக. அதன் அணு எண் மதிப்பில் (Z) இரண்டும். நிறை எண் மதிப்பில் (A) நான்கும் குறையும். 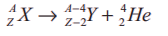
• இங்கு X என்பது தாய் அணுக்கரு என்றும் Y என்பது சேய் அணுக்கரு என்றும் அழைக்கப்படுகின்றன.
• எடுத்துக்காட்டு: 42He அணுக்கருவை (α− துகள்) உமிழ்வதன் மூலம் யுரேனியம் 23892U தோரியமாக 23490Th சிதைவுறுதல்.
23892U → 23490Th + 42He
• நிறை வேறுபாடு (∆m = mx – my – mα )
• சிதைவு ஆற்றல் Q = ( mx – my – mα )c2
• இச்சிதைவு ஆற்றல் Q−வானது, α−துகள் மற்றும் சேய் அணுக்கரு ஆகியவற்றின் இயக்க ஆற்றலாகத் தோன்றுகிறது.
• தன்னியல்பு அல்லது இயற்கைக் கதிரியக்கம் Q > 0
• தன்னிச்சையாக நிகழாத கதிரியக்கம் Q < 0
• ஆல்பா சிதைவு நிகழ்வில், சிதைவு ஆற்றலின் மதிப்பு நேர்க்குறி Q > 0 உடையது என்பது தெளிவு.
8. பீட்டா சிதைவு நிகழ்வினை எடுத்துக்காட்டுடன் விளக்குக.

β− சிதைவு
• β− சிதைவில் அணுக்கருவின் நிறையெண் மதிப்பு மாறாத நிலையில் அதன் அணு எண் மதிப்பு ஒன்று அதிகரிக்கும். AZX → AZ+1Y + e− + ⊽
• ஒவ்வொரு β− சிதைவிலும் அணுக்கரு X ல் உள்ள நியூட்ரான் ஒன்று ஒரு எலக்ட்ரான் மற்றும் ஒரு எதிர் நியூட்ரினோவை வெளியிடுவதால் புரோட்டானாக மாறுகின்றது.
• n → p + e− + ⊽
இங்கு p – புரோட்டான்
⊽ − எதிர் நியூட்ரினோ
• எடுத்துக்காட்டு: β− சிதைவின் மூலம் கார்பன் (146C) நைட்ரஜனாக (147N) மாறுகின்றது.
146C → 147N + e− + ⊽
β+ சிதைவு
• β+ சிதைவில் அணு எண் மதிப்பு ஒன்று குறையும், ஆனால் நிறை எண் மாறாமல் இருக்கும்.
AZX → AZ-1Y + e+ + v
• ஒவ்வொரு β+ சிதைவிலும் அணுக்கரு X ல் உள்ள புரோட்டான் ஒன்று ஒரு பாசிட்ரான் (e+) மற்றும் ஒரு நியூட்ரினோவை வெளிவிடுவதால் நியூட்ரானாக மாறுகின்றது.
• p → n + e+ + v
இங்கு n – நியூட்ரான்
V − நியூட்ரினோ
• எடுத்துக்காட்டு: சோடியம் (2211Na) β+ சிதைவின் மூலம் நியானாக (2210Ne) மாறுகின்றது.
2211Na → 2210Ne + e+ + v
• நியூட்ரான் புரோட்டானாகவோ அல்லது புரோட்டான் நியூட்ரானாகவோ அணுக்கருவினுள்ளேயே மாறும் போது அணுக்கருவிலிருந்து எலக்ட்ரான்கள், பாசிட்ரான்கள் வெளியேறுகின்றன.
ஆனால் தனித்த ஒரு புரோட்டான் (எந்தவொரு அணுக்கருவிற்கும் உள்ளே இல்லையெனில்) β+ சிதைவுக்கு உட்படாது. ஏனென்றால் நியூட்ரானின் நிறையானது, புரோட்டானின் நிறையை விட அதிகமாக உள்ளதால், ஆற்றல் மாறா விதியின்படி, இந்த நிகழ்வு சாத்தியப்படாது.
ஆனால் தனித்த ஒரு நியூட்ரான் (எந்தவொரு அணுக்கருவிற்கும் உள்ளே இல்லையென்றாலும்) β− சிதைவுக்கு உட்படுகிறது.
9. காமா உமிழ்வு நிகழ்வினை எடுத்துக்காட்டுடன் விளக்குக.
இச்சிதைவு நிகழ்வில், சேய் அணு கிளர்வு நிலையில் உள்ளது (126C*) மேலும் பீட்டா சிதைவிற்குப் பின்னர் காமா சிதைவு ஏற்படுகிறது
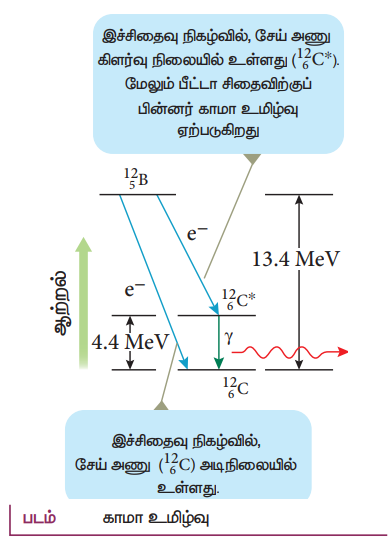
காமா சிதைவு:
• காமா சிதைவில் நிறை எண் மற்றும் அணு எண்ணில் எவ்வித மாற்றமும் இருப்பதில்லை.
• α மற்றும் β சிதைவுகளில் சேய் அணுக்கரு பெரும்பாலும் கிளர்வுற்ற நிலையிலேயே காணப்படும். கிளர்வு நிலையின் ஆயுட்காலம் கிட்டத்தட்ட 10−11s ஆக இருக்கும். ஆகவே இக்கிளர்வு நிலை அணுக்கரு, γ கதிர்கள் எனப்படும் உயர் ஆற்றல் ஃபோட்டான்களை வெளிவிடுவதன் மூலம் குறைந்த ஆற்றல் நிலைக்குத் திரும்புகின்றது

• இங்கு மேல் இடப்பட்டுள்ள உடுகுறி (*) கிளர்வு நிலையிலுள்ள அணுக்கருவைக் குறிக்கின்றது
• போரான் (125B) பீட்டா சிதைவு ஆனது இரு வழிகளில் நடைபெறுகிறது
1) 13.4 MeV பெரும் ஆற்றல் கொண்ட எலக்ட்ரானை வெளிவிடுவதன் மூலம் போரான் நேரடியாக பீட்டா சிதைவை அடைந்து அடி நிலையிலுள்ள கார்பனாக (126C) மாறுகிறது.
2) 9.0 MeV பெரும் ஆற்றல் கொண்ட எலக்ட்ரானை வெளிவிடுவதன் மூலம் அது கிளர்வு நிலையிலுள்ள கார்பனாக (126C*) மாறுகிறது. அதன் பின்பு 4.4 MeV ஆற்றல் கொண்ட போட்டானை வெளிவிடுவதன் மூலம் அடி நிலைக்கு வருகிறது.
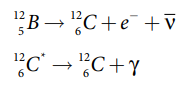
10. கதிரியக்க சிதைவு விதியினைத் தருவிக்க
கதிரியக்க சிதைவு விதி:
• ஒரு குறிப்பிட்ட கணத்தில் ஓரலகு நேரத்தில் நடைபெறும் சிதைவுகளின் எண்ணிக்கை 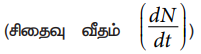 ஆனது, அக்கணத்தில் உள்ள அணுக்கருக்களின் எண்ணிக்கைக்கு (N) நேர்த்தகவில் இருக்கும்.
ஆனது, அக்கணத்தில் உள்ள அணுக்கருக்களின் எண்ணிக்கைக்கு (N) நேர்த்தகவில் இருக்கும்.
• 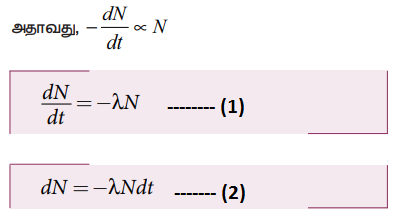
• λ− சிதைவு மாறிலி
• எதிர்க்குறியானது நேரம் செல்லச்செல்ல அணுக்கருக்களின் எண்ணிக்கை N இன் மதிப்பு குறையும் என்பதைக் காட்டுகிறது. dN = − λNdt
• இங்கு dN என்பது dt நேர இடைவெளியில் சிதைவடையும் அணுக்கருக்களின் எண்ணிக்கையைக் குறிக்கும்.
t = 0, N = No .
• சமன்பாடு (2) ஐத் தொகையீடு செய்யும் போது, எந்தவொரு t கணத்திலும் உள்ள அணுக்கருக்களின் எண்ணிக்கையைக் கணக்கிடலாம்.
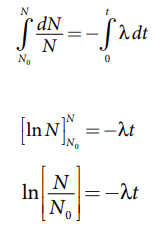
• இருபுறமும் அடுக்குக்குறி மதிப்பைப் பெற நமக்கு கிடைப்பது
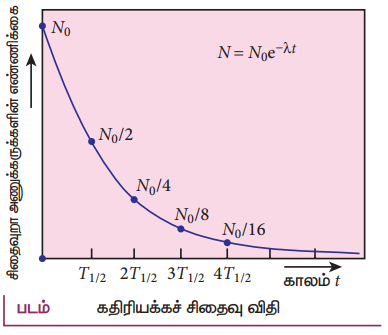
N = Noe−λt …………………..(4)
(குறிப்பு : e1nx = ey = x = ey) சமன்பாடு கதிரியக்கச் சிதைவு விதி எனப்படும்.
• நேரம் ஆக ஆக அணுக்களின் எண்ணிக்கை அடுக்குக்குறி முறைப்படி குறையும் என்பதை இச்சமன்பாட்டிலிருந்து நாம் அறிந்து கொள்ளலாம்.
• அனைத்து கதிரியக்க அணுக்கருக்களும் சிதைவடைய முடிவிலா காலம் (infinte) ஆகும்.
• கதிரியக்கச் செயல்பாடு:
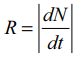
N = No e−λt ; R = Ro e−λt ; Ro = λ No ; R = λ N
கதிரியக்கச் செயல்பாட்டின் SI அலகு
Bq (பெக்கரல்) (அல்லது) [ சிதைவுகள் / வினாடி ]
மற்றொரு அலகு: 1 கியூரி = 1 Ci
= 3.7 × 10l0 Bq = 3.7×1010 சிதைவுகள் / வினாடி
11. நியூட்ரினோவின் பண்புகளை விளக்கி பீட்டா சிதைவில் அதன் பங்கினை எடுத்துரைக்க.
நியூட்ரினோ:
• பீட்டா சிதைவின் போது, தாய் அணுக்கருவிலுள்ள நியூட்ரான் ஒன்று எலக்ட்ரானை வெளிவிட்டு சேய் அணுக்கருவாக மாறுகின்றது.

• ஆனால் அணுக்கருவிலிருந்து வெளியேறும் எலக்ட்ரானின் இயக்க ஆற்றல் மதிப்பு ஆய்வுகளின் முடிவுகளுடன் பொருந்தவில்லை .
• பீட்டா சிதைவில் β−துகள்கள் தொடர்ச்சியான ஆற்றல் மதிப்புகளைப் பெற்று விளங்குகின்றன.
• ஆற்றல் மாறாவிதி மற்றும் உந்தம் மாறா விதியின் அடிப்படையில் எலக்ட்ரான் ஆற்றல் மற்றும் சேய் அணுக்கரு Y ஆகியவை குறிப்பிட்ட தனித்த மதிப்புகளைப் பெற்றிருக்க வேண்டும்.
• பீட்டா சிதைவில் இன்னுமொருதுகள் இருக்கவேண்டும் என்று கொள்கை மற்றும் சோதனைகளின் அடிப்படையில் பவுலி என்பார் 1931ஆம் ஆண்டு எடுத்துரைத்தார்.
• மின்னூட்டமற்ற மிகச்சிறிய நிறை கொண்ட துகளுக்கு நியூட்ரினோ என்ற பெயரை பெர்மி சூட்டினார்.
• 1956ஆம் ஆண்டு பிரடெரிக் ரெயின்ஸ் மற்றும் கிளைடு கோவன் ஆகியோர் சோதனைகளின் மூலம் நியூட்ரினோவைக் கண்டுபிடித்தனர். இந்தக் கண்டுபிடிப்புக்காக 1995ஆம் ஆண்டு ரெயின்ஸ் நோபல் பரிசினைப் பெற்றார்.
நியூட்ரினோ பின்வரும் பண்புகளைப் பெற்றுள்ளது:
• அதன் மின்னூட்டம் சுழி ஆகும் .
• அது எதிர் நியூட்ரினோ என்ற எதிர்த்துகளை பெற்றுள்ளது.
• அண்மைக்கால ஆய்வுகளின் அடிப்படையில் மிகச்சிறிய நிறையை நியூட்ரினோ பெற்றுள்ளது என்பது கண்டறியப்பட்டுள்ளது.
• பருப்பொருளுடன் நியூட்ரினோ மிகமிகக் குறைந்த அளவே இடைவினை புரிகிறது. எனவே அதைக் கண்டுபிடிப்பது மிகவும் கடினம். உண்மையில், ஒவ்வொரு வினாடியும் சூரியனிலிருந்து வரும் டிரில்லியன் கணக்கிலான நியூட்ரினோக்கள் நம் உடலினூடே புகுந்து செல்கின்றன. எந்த இடைவினையும் இல்லாததால் நம்மால் அவற்றை அறிய இயலவில்லை. .
12. கார்பன் காலக்கணிப்பை விளக்கவும்.
கார்பன் காலக்கணிப்பு:
• பீட்டா சிதைவின் ஒரு முக்கியமான பயன்பாடு கதிரியக்கக் காலக்கணிப்பு அல்லது கார்பன் காலக்கணிப்பு ஆகும். இந்த வழிமுறையைப் பயன்படுத்தி பழங்காலப் பொருள்களின் வயதைக் கண்டறியலாம்.
• வாழும் அனைத்து உயிரினங்களும் காற்றிலிருந்து கார்பன் டையாக்சைடை (CO2) உட்கவர்ந்து கரிம மூலக்கூறுகளை உருவாக்குகின்றன.
• இவ்வாறு உட்கவரப்பட்ட CO2 வில் பெரும்பகுதி 126C ஆகவும், மிகவும் சிறிய பகுதி (1.3 × 10−12) கதிரியக்க 146C ஆகவும் உள்ளது (இதன் அரை ஆயுட்காலம் 5730 ஆண்டுகள்).
• வளிமண்டலத்திலுள்ள கார்பன்−14 தொடர்ந்து சிதைவடைகிறது. அதே நேரத்தில், புற விண்வெளியிலிருந்து வரும் காஸ்மிக் கதிர்களால் வளிமண்டலத்திலுள்ள அணுக்கள் தொடர்ந்து மோதுவதால் 146C ஆனது தொடர்ந்து உருவாகிக் கொண்டேயிருக்கும்.
• இத்தொடர் உருவாதல் மற்றும் சிதைவு நிகழ்வுகளினால் 146C மற்றும் 126C க்கு இடையேயான விகிதம் மாறாமல் இருக்கும்.
• மனிதர்கள், மரங்கள் அல்லது எந்தவொரு உயிரினமும் வளிமண்டலத்திலிருந்து தொடர்ந்து CO2ஐ உட்கவர்கின்றன. எனவே வாழும் உயிர் ஒன்றில் காணப்படும் 146C மற்றும் 126C விகிதம் ஏறக்குறைய மாறிலியாக இருக்கும்.
• அவ்வுயிரினம் இறந்தவுடன் CO2 உட்கவர்வது நின்று விடுகிறது. எனவே 146C சிதைவு காரணமாக, இறந்த உயிரினத்தின் உடலில் உள்ள 146C, 126C விகிதம் நாளடைவில் குறையத் தொடங்குகிறது.
• மண்ணுக்குள் புதைந்த ஒரு பழங்கால மரத்தின் மாதிரிப்பொருள் ஒன்று தோண்டி எடுக்கப்பட்டு, அதன் 146C : 126C விகிதம் அறியப்பட்டால் அம்மரத்தின் வயதைக் கணக்கிட முடியும்.
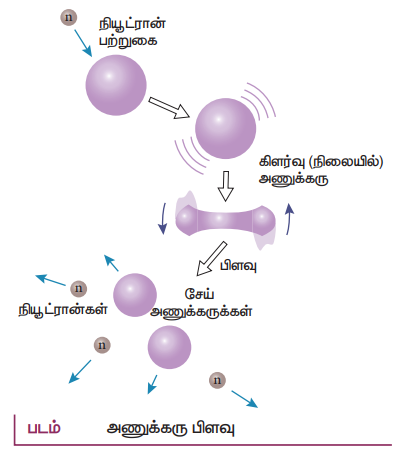
13. அணுக்கரு பிளவு நிகழ்வினையும் அதன் பண்புகளையும் எடுத்துரைக்க.
அணுக்கரு பிளவு (Nuclear Fission):
• கனமான அணுவின் அணுக்கரு ஒன்று இரு சிறிய அணுக்கருக்களுடன் அதிக அளவிலான ஆற்றலும் வெளிப்படும் வண்ணம் பிளவுறும் நிகழ்வு அணுக்கரு பிளவு எனப்படும்.
• யுரேனியம் அணுக்கருவை நியூட்ரானால் மோதச் செய்யும்போது, அது கிட்டத்தட்ட சமமான நிறைகளையுடைய இரு சிறிய அணுக்கருக்களாகவும், அவற்றுடன் ஆற்றலும் வெளிப்படும் வண்ணம் பிளவுறுகிறது என்பதை ஜெர்மானிய அறிவியல் அறிஞர்களான ஆட்டோஹான் (Otto Hahn) மற்றும் ஸ்டிராஸ்மன் (Strassmann) ஆகியோரால் 1939ம் ஆண்டு கண்டுபிடிக்கப்பட்டது.
• 90 வெவ்வேறு வழிகளில் யுரேனியத்தின் பிளவு வினை நடைபெறுகின்றது.
• பெரும்பான்மையாக நிகழும் பிளவு வினைகள் கீழே கொடுக்கப்பட்டுள்ளன.
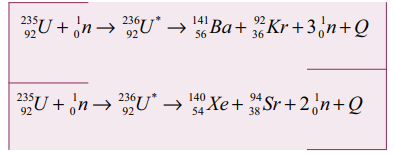
• ஒவ்வொரு வினையிலிருந்தும் சராசரியாக 2.5 நியூட்ரான்கள் வெளிப்படுகின்றன.
• இங்கு Q என்பது ஒவ்வொரு யுரேனிய அணுக்கருவும் பிளவுறும் போது வெளிப்படும் ஆற்றலைக் குறிக்கும்.
• பிளவில் வெளிப்படும் ஆற்றல்: ஒவ்வொரு யுரேனியம் அணுக்கருவின் பிளவிலும் வெளிப்படும் ஆற்றல் Qஐ நாம் கணக்கிடலாம்.
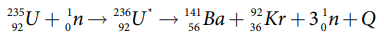
• குறைவேக நியூட்ரான் ஒன்றினை யுரேனியம் அணுக்கரு உட்கவரும் போது, அதன் நிறை எண் ஒன்று அதிகரித்து 23692U* என்ற கிளர்வு நிலைக்குச் செல்கிறது. ஆனால் இந்நிலை 10−12 S நேரத்திற்கு மேலாக நிலைக்க இயலாததால் அது 2 அல்லது 3 நியூட்ரான்களுடன் கூடிய இரு சேய் அணுக்கருக்களாகச் சிதைவுறுகிறது.
• ஒவ்வொரு பிளவிலும் வெளிப்படும் ஆற்றல்
= 0.225303 × 931MeV ≈ 200 MeV
• இந்த ஆற்றல் முதலில் சேய் அணுக்கருக்கள் மற்றும் நியூட்ரான்களின் இயக்க ஆற்றலாக வெளிப்பட்டு பின்னர் இந்த இயக்க ஆற்றல் சுற்றியுள்ள பொருள்களில் வெப்ப ஆற்றலாக மாற்றப்படுகின்றது.
14. அணுக்கரு இணைவினை விளக்கி விண்மீன்களில் ஆற்றல் உருவாதலை விரிவாக எழுதுக.
அணுக்கரு இணைவு (Nuclear Fusion):
• இரண்டு அல்லது அதற்கு மேற்பட்ட குறைந்த நிறை கொண்ட (A < 20) அணுக்கருக்கள் இணைந்து அதிக நிறை கொண்ட அணுக்கருவை உருவாக்கும் நிகழ்வு அணுக்கரு இணைவு எனப்படும்.
• அணுக்கரு இணைவில் உருவாகும் அணுக்கருவின் நிறையானது தொடக்கத்தில் உள்ள அணுக்கருக்களின் நிறைகளின் கூடுதலை விடக் குறைவாக இருக்கும்.
• அணுக்கரு பிளவைப் போல அறை வெப்ப நிலையில் அணுக்கரு இணைவு நிகழாது. ஏனெனில், குறைந்த நிறையுடைய இரு அணுக்கருக்கள் ஒன்றையொன்று நெருங்கும் போது கூலூம் விலக்கு விசையினால் அவை கடுமையாக விலக்கப்படுகின்றன.
• சூழலின் வெப்பநிலை 107 K ஐ நெருங்கும் போது குறைந்த நிறையுடைய அணுக்கருக்கள் இணைந்து அதிக நிறையுடைய அணுக்கருவை உருவாக்குவதால் இந்நிகழ்வு வெப்ப அணுக்கரு இணைவு வினை என்றழைக்கப்படுகிறது.
விண்மீன்களில் ஆற்றல் உருவாதல்:
• விண்மீன்களின் வெப்பநிலை கிட்டத்தட்ட 107 K அளவில் இருப்பதால் இயற்கையிலேயே அணுக்கரு இணைவு நடைபெறுகிது. ஒவ்வொரு விண்மீனிலும் ஆற்றல் உருவாகும் நிகழ்வு ஒரு வெப்ப அணுக்கரு இணைவு வினையே.
• நம் சூரியன் உட்பட பெரும்பாலான விண்மீன்களில் ஹைட்ரஜன் இணைந்து ஹீலியமும் சில விண்மீன்களில் ஹீலியம் இணைந்து மேலும் அதிக நிறையுடைய தனிமங்களும் உருவாகின்றன.
• விண்மீன்களின் தொடக்க கட்டத்தில் மேகமும் தூசுகளும் மட்டுமே காணப்படுகின்றன. தன் ஈர்ப்பு விசையினால் அம்மேகங்கள் உள்நோக்கி வீழ்கின்றன. இதனால் ஈர்ப்பழுத்த ஆற்றல் இயக்க ஆற்றலாகவும் இறுதியில் வெப்ப ஆற்றலாகவும் மாறுகிறது.
• வெப்ப அணுக்கரு வினையைத் துவக்கத் தேவையான வெப்பநிலையை அடைந்த பின் ஏராளமான ஆற்றல் வெளிப்படுவதனால் உள்நோக்கிய வீழ்வு தடுக்கப்பட்டு விண்மீன் சமநிலையை எட்டுகிறது.
• சூரியனின் உட்பகுதி வெப்ப நிலை ஏறக்குறைய 1.5 × 107 K ஒவ்வொரு வினாடியும் அது 6 × 1011 kg ஹைட்ரஜனை ஹீலியமாக மாற்றுகிறது. இந்த இணைவு வினை மேலும் 5 பில்லியன் ஆண்டுகளுக்கு நீடித்திருப்பதற்குத் தேவையான ஹைட்ரஜன் சூரியனில் உள்ளது.
• ஹான்ஸ்பெத்தே (Hans Bethe) என்பாரின் கருத்துப்படி சூரியனின் ஆற்றல் புரோட்டான்−புரோட்டான் சுற்று எனப்படும் இணைவு வினையினால் உருவாகிறது.
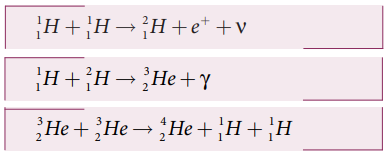
• மேலே குறிப்பிடப்பட்ட வினைகளில் உருவாகும் மொத்த ஆற்றலின் மதிப்பு 27 MeV.
• அனைத்து ஹைட்ரஜனும் எரிந்த பிறகு, சிவப்புப் பெருமீன் (red gaint) என்ற புதிய கட்டத்தை சூரியன் அடையும்.
• இதில் ஹீலியம் இணைந்து கார்பனாக மாறுகின்ற அணுக்கரு இணைவு வினை நடக்க ஆரம்பிக்கும்.
• இக்கட்டத்தில் சூரியன் அனைத்து கோள்களையும் விழுங்கும் அளவிற்கு மிகப்பெரியதாக விரிவடையும்.
15. படத்தின் உதவியுடன் அணுக்கரு உலை வேலை செய்யும் விதத்தை விளக்கவும்.
அணுக்கரு உலை:
• அணுக்கரு உலை என்பது தற்சார்புடைய மற்றும் கட்டுக்குள் இருக்கும் வகையில் அணுக்கரு பிளவு நடைபெறும் அமைப்பாகும்.
• இதில் உருவாகும் ஆற்றல் ஆராய்ச்சித் தேவைகளுக்கோ அல்லது மின்திறன் உருவாக்கத்திற்கோ பயன்படுத்தப்படுகிறது.
• முதல் அணுக்கரு உலை என்ரிகோ பெர்மி (Enrico Fermi) என்ற இயற்பியல் அறிஞரால் 1942ஆம் ஆண்டு அமெரிக்க நாட்டின் சிகாகோ நகரில் கட்டப்பட்டது.
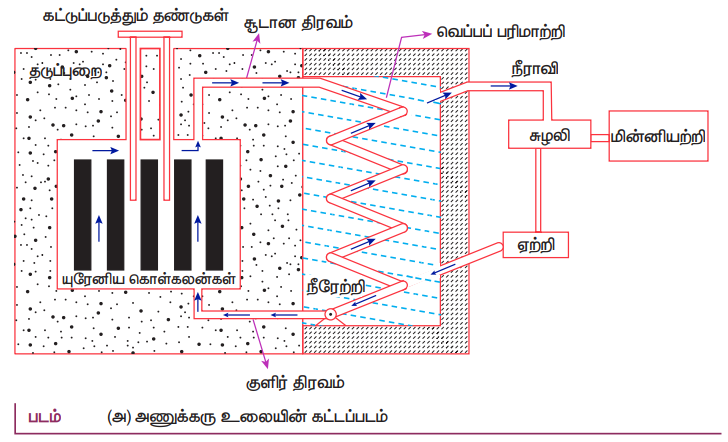
எரிபொருள் :
• எரிபொருள் என்பது அணுக்கரு பிளவுக்கு உட்படும் பொருள் (பொதுவாக, யுரேனியம் அல்லது புளுட்டோனியம்). இயற்கையில் கிடைக்கும் யுரேனியத்தில் 0.7% அளவே 23592U உள்ளது, 99.3% அளவு 23892U உள்ளது. எனவே, 23892U செறிவூட்டப்பட்டு, அதில் 2−4% அளவு 23592U இருக்குமாறு செய்யப்படுகிறது.
• அணுக்கரு வினைகள் தொடர்ந்து நடைபெறுவதற்கு குறைவேக நியூட்ரான்கள் பயன்படுத்தப்படுகின்றன.
தணிப்பான்கள்:
• வேக நியூட்ரான்களை குறைவேக நியூட்ரான்களாக மாற்றுவதற்கு உதவும் பொருள் தணிப்பான் எனப்படும். பொதுவாக, நியூட்ரான்களின் நிறைக்குச் சமமான நிறையுடைய இலேசான அணுக்கருக்களே தணிப்பான்களாகப் பயன்படுத்தப்படுகின்றன.
• இந்த இலேசான அணுக்கருக்களுடன் வேக நியூட்ரான்கள் மோதலை நிகழ்த்தும் போது நியூட்ரான்களின் வேகம் குறைக்கப்படுகிறது.
• நீர், கனநீர் (D2O) மற்றும் கிராபைட் ஆகிய பொருள்களே தணிப்பான்களாகப் பயன்படுத்தப்படுகின்றன. யுரேனிய அடுக்குகளின் தொகுதியுடன் இடையில் கிராபைட் தண்டுகள் (தணிப்பான்கள்) இணைக்கப்பட்டு ஒரு பெரிய அடுக்காக உள்ளதை காணலாம்.
கட்டுப்படுத்தும் தண்டுகள்:
• அணுக்கரு பிளவு வினை நடைபெறும் வீதத்தை சரிசெய்வதற்கு அல்லது கட்டுக்குள் வைப்பதற்கு கட்டுப்படுத்தும் தண்டுகள் பயன்படுகின்றன.
• ஒவ்வொரு அணுக்கரு பிளவின் போதும் சராசரியாக 2.5 நியூட்ரான்கள் வெளியேறுகின்றன. எனவே, தொடர் வினையைக் கட்டுக்குள் வைப்பதற்கு ஒரேயொரு நியூட்ரான் மட்டுமே அடுத்த பிளவை ஏற்படுத்துமாறு செய்யப்பட்டு, மற்ற நியூட்ரான்கள் கட்டுப்படுத்தும் தண்டுகளால் உட்கவரப்படுகின்றன.
• பொதுவாக, காட்மியம் அல்லது போரான் ஆகியவை கட்டுப்படுத்தும் தண்டுப்பொருளாக செயல்படுகிறது.
• யுரேனிய அடுக்குகளில் இத்தண்டுகள் செருகி வைக்கப்படுகின்றன.
• செயல்பாட்டு நிலை: சராசரி நியூட்ரான்களின் எண்ணிக்கை ஒன்று,
• மீச்செயல்பாட்டு நிலை: சராசரி நியூட்ரான்களின் எண்ணிக்கை ஒன்றை விட அதிகம்.
தடுப்பு அமைப்பு (Shielding):
• தீமை பயக்கும் கதிர்வீச்சுகளிலிருந்து நம்மை பாதுகாத்துக் கொள்ள 2−2.5 m தடிமனுள்ள கற்காரையினால் (concrete) ஆன சுவரானது அணுக்கரு உலையைச் சுற்றி அமைக்கப்படுகிறது.
குளிர்விக்கும் அமைப்பு:
• அணுக்கரு உலையின் உள்ளகத்தில் உருவாகும் வெப்பத்தை நீக்க குளிர்விக்கும் அமைப்பு உதவுகிறது. மிக அதிக தன் வெப்ப ஏற்புத்திறனும், அதிக அழுத்தத்தில் அதிக கொதிநிலையையும் கொண்டுள்ள நீர், கனநீர் மற்றும் திரவ சோடியம் ஆகியவை குளிர்விப்பான்களாகப் பயன்படுத்தப்படுகின்றன.
• குளிர்விப்பான் அமைப்பானது, எரிபொருள் அடுக்கின் வழியே சென்று உட்கவர்ந்த வெப்பத்தை நீராவி இயற்றிக்குக் கடத்துகின்றது. நீராவியினால் சுழலிகள் (turbines) இயக்கப்பட்டு மின்சார உற்பத்தி உலைகளில் மின்னாற்றல் உற்பத்தி செய்யப்படுகிறது.
16. நான்கு அடிப்படை விசைகளைப் பற்றி விரிவாக எழுதவும்.
• ஈர்ப்பு விசை, மின்காந்த விசை, அணுக்கரு விசை மற்றும் மென்விசை ஆகிய நான்கும் இயற்கையின் அடிப்படை விசைகள்.
• நாம் அன்றாட வாழ்வில் கூட இந்த அடிப்படை விசைகள் தேவைப்படுகின்றன.
ஈர்ப்பு விசை:
• இரு நிறைகளுக்கு இடையில் ஈர்ப்பு விசை செயல்படுவதையும் அது அனைத்துக்கும் பொதுவான ஒன்று.
• . நாம் பூமியில் இருப்பதற்கு புவியின் ஈர்ப்பு விசை காரணமாக உள்ளது.
மின்காந்த விசை:
• இரு மின் துகள்களுக்கு இடையே மின்காந்த விசை செயல்படுகிறது.
• நாம் புவியின் பரப்பில் இருத்தலுக்கு புவிப்பரப்பிலுள்ள அணுக்களுக்கும் நாம் பாதத்திலுள்ள அணுக்களுக்கும் இடையேயுள்ள மின்காந்த விசை காரணமாக உள்ளது.
வலிமையான அணுக்கரு விசை:
• இரு நியூக்ளியான்களுக்கு இடையே ஒரு வலிமையான அணுக்கரு விசை செயல்படுகிறது. அணுக்கருவின் நிலைத்தன்மைக்கு இது காரணமாக உள்ளது.
• நம் உடலிலுள்ள அணுக்கள் நிலைத்தன்மையுடன் இருப்பதற்கு வலிமையான அணுக்கரு விசை தேவைப்படுகிறது.
வலிமை குன்றிய விசை அல்லது மென்விசை:
• இது அணுக்கரு விசையை விடக் குறைந்த தொலைவுகளில் செயல்படக் கூடியது.
• பீட்டா சிதைவு மற்றும் வீண்மீன்களில் ஆற்றல் உருவாதல் ஆகிய நிகழ்வுகளில் இந்த விசை முக்கிய பங்காற்றுகிறது.
• சூரியனில் ஹைட்ரஜன் ஹீலியமாகும் நிகழ்வில் நியூட்ரினோக்களும் ஏராளமான கதிர்வீச்சுகளும் மென்விசையின் காரணமாக உருவாகின்றன.
• பூமியிலுள்ள பல்வேறு உயிரினங்களின் வாழ்விற்குத் தேவையான சூரிய ஆற்றல், சூரியனிலிருந்து உருவாதலுக்குக் காரணமாகவும், சூரியனின் உள்ளகத்தில் அணுக்கரு இணைவு வினை நிகழ்வதற்கு மென்விசை முக்கிய பங்கு வகிக்கிறது.
17. இயற்கையில் உள்ள அடிப்படைத் துகள்களைப் பற்றி விளக்குக.
அடிப்படைத் துகள்கள் (Elementary particles):
• ஓர் அணுவில் அணுக்கருவும் அதனைச் சுற்றி எலக்ட்ரான்களும் உள்ளன. அணுக்கரு புரோட்டான்கள் மற்றும் நியூட்ரான்களைக் கொண்டது.
• புரோட்டான்கள், நியூட்ரான்கள், எலக்ட்ரான்கள் ஆகியவையே பருப்பொருள்களின் அடிப்படைத் துகள்கள் என 1960கள் வரை நம்பப்பட்டு வந்தது.
• 1964ஆம் ஆண்டில் முர்ரே கெல்மேன் (Murray Gellman) மற்றும் ஜார்ஜ் ஸ்வேக் (George Zweig) ஆகிய இயற்பியல் அறிஞர்கள் புரோட்டான்களும் நியூட்ரான்களும் அடிப்படைத் துகள்கள் அல்ல. அவை குவார்க்குகள் என்ற துகள்களால் ஆனவை என்ற கருத்தியலை முன்மொழிந்தனர்.
• 1968ஆம் ஆண்டு அமெரிக்காவிலுள்ள ஸ்டான்போர்டு துகள் முடுக்கி மையத்தில் (SLAC) நடந்த சோதனைகளில் குவார்க்குகள் கண்டுபிடிக்கப்பட்டன.
• மேல் (up) குவார்க், கீழ் (down) குவார்க், கவர்வு (charm) குவார்க், புதுமை (strange) குவார்க், உச்சி (top) குவார்க், அடி (bottom) குவார்க் என ஆறு வகை குவார்க்குகளும் அவற்றின் எதிர்த்துகள்களும் உள்ளன.
• குவார்க்குகள் அனைத்துமே பின்ன மதிப்புடைய மின்னூட்டங்களைப் பெற்றுள்ளன.
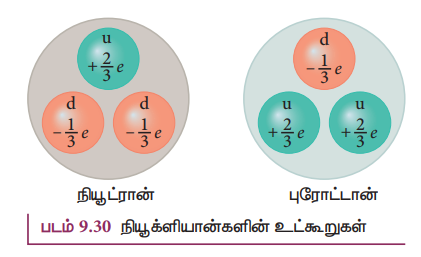
• மேல் குவார்க்கின் மின்னூட்ட மதிப்பு + 2/3 e
• கீழ் குவார்க்கின் மின்னூட்ட மதிப்பு –1/3 e
• ஒரு நியூட்ரான் இரண்டு கீழ் குவார்க்குகள் மற்றும் ஒரு மேல் குவார்க்காலும் ஆக்கப்பட்டிருக்கிறது.
• புரோட்டான் இரண்டு மேல் குவார்க்குகள், மற்றும் ஒரு கீழ் குவார்க்காலும் ஆக்கப்பட்டிருக்கிறது.
• எலக்ட்ரான்கள் வேறு எந்த துகள்களாலும் உருவாக்கப்படாததால் அவை அடிப்படைத் துகள்களாகவே கருதப்படுகின்றன.
• அடிப்படைத் துகள்கள் ஆராயும் இயல் ‘துகள் இயற்பியல்' என்றழைக்கப்படுகிறது.