அணு மற்றும் அணுக்கரு இயற்பியல் | இயற்பியல் - சிறுவினாக்கள் | 12th Physics : UNIT 9 : Atomic and Nuclear Physics
12 ஆம் வகுப்பு இயற்பியல் : அலகு 9 : அணு மற்றும் அணுக்கரு இயற்பியல்
சிறுவினாக்கள்
II. சிறுவினாக்கள்
1. கேத்தோடு கதிர்கள் என்றால் என்ன?
ஒரு மின்னிறக்கக் குழாயில் ஒரு வகை கண்ணிற்குப் புலனாகாத கதிர்கள் எதிர் மின்வாயிலிருந்து (கேதோடிலிருந்து) வெளியேறுகின்றன. இக்கற்றைகள் கேதோடு கதிர்கள் (cathode rays) என்றழைக்கப்பட்டன. பின்னர் இக்கேதோடு கதிர்கள் என்பது எலக்ட்ரான் கற்றை எனக் கண்டறியப்பட்டது.
2. கேத்தோடு கதிர்களின் பண்புகளை எழுதுக.
கேதோடு கதிர்களின் பண்புகள்:
1) கேத்தோடு கதிர்கள் ஆற்றல் மற்றும் உந்தத்தைப் பெற்றுள்ளன. 107 ms−1 என்ற அளவிலான அதிவேகத்துடன் நேர்க்கோட்டில் அவை செல்கின்றன. மின் மற்றும் காந்தப்புலங்களால் அவை விலக்கம் அடைகின்றன. இவ்விலக்கத்தின் திசையை வைத்து அவை எதிர் மின்துகள்கள் என்பதை அறியலாம்.
2) பொருள்களின் மீது கேதோடு கதிர்கள் விழும் போது, வெப்பம் உருவாகின்றது. கேதோடு கதிர்கள் புகைப்படத் தகட்டை பாதிக்கின்றன. மேலும் சில படிகங்கள் மற்றும் கனிமப் பொருள்கள் மீது அவை படும் போது ஒளிர்தலை ஏற்படுத்துகின்றன.
3) அதிக அணு எடை கொண்ட பொருள்களின் மீது அவை விழும்போது, X−கதிர்கள் உருவாகின்றன.
4) கேதோடு கதிர்கள் வாயுக்களின் வழியே செல்லும்போது அவ்வாயுக்களை அயனியாக்கம் செய்கின்றன.
5) கேதோடு கதிர்கள் ஒளியின் வேகத்தில் (1/10) மடங்கு வரையிலான வேகத்தில் இயங்குகின்றன.
3. ரூதர்போர்டு ஆல்பா சிதறல் ஆய்வின் முடிவுகளைக் கூறுக.
• பெரும்பாலான ஆல்பா துகள்கள் தங்க மென்தகட்டினால் விலக்கம் அடையாமல் நேராக செல்கின்றன.
• சில ஆல்பா துகள்கள் சிறிய கோண அளவே விலக்கம் அடைகின்றன.
• குறைந்த எண்ணிக்கையிலான (ஆயிரத்தில் ஒன்று) ஆல்பா துகள்கள் 90° கோணத்திற்கும் மேலான விலக்கம் அடைகின்றன.
• மிகக்குறைந்த எண்ணிக்கையிலான ஆல்பா துகள்கள் 180° கோண அளவில் பின்னோக்கிய சிதறல் அடைகின்றன.
4. போர் அணு மாதிரியின் கருதுகோள்களைக் கூறுக.
• அணுக்கருவைச் சுற்றி எலக்ட்ரான் வட்டப்பாதையில் இயங்கத் தேவையான மையநோக்கு விசையை கூலூம் நிலைமின்னியல் கவர்ச்சி விசை அளிக்கின்றது.
• நிலைத்தன்மை பெற்ற சுற்றுப்பாதைகளில் உள்ள எலக்ட்ரானின் கோண உந்தத்தின் மதிப்பானது h/2π ன் முழு மடங்காகவே இருக்கும். இது கோண உந்த குவாண்டமாக்கல் நிபந்தனை எனப்படும்.
L = nh ; L = nh / 2π ; mvr = nh / 2π [h = h/2π]
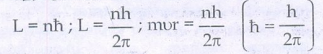
• இரு சுற்றுப்பாதைகளின் ஆற்றல் வேறுபாட்டுக்குச் சமமான ஆற்றல் கொண்ட ஃபோட்டானை உட்கவர்வதனாலோ அல்லது வெளியிடுவதனாலோ மற்றொன்றுக்கு தாவ இயலும்.
∆E = Eஇறுதி − Eதொடக்கம்
∆E = hv
∆E = hc / λ [c = v λ]
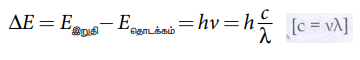
5. கிளர்வு ஆற்றல் என்றால் என்ன?
எந்தவொரு குறைந்த ஆற்றல் நிலையிலிருந்து அதைவிட அதிக ஆற்றல் நிலைக்கு ஒரு எலக்ட்ரானை கிளர்வுறச் செய்ய தேவைப்படும் ஆற்றல் கிளர்வு ஆற்றல் எனப்படும்.
6. அயனியாக்க ஆற்றல் மற்றும் அயனியாக்க மின்னழுத்தம் - வரையறுக்கவும்.
அயனியாக்க ஆற்றல்:
அடிநிலையிலுள்ள அணுவின் எலக்ட்ரான் ஒன்றினை அதிலிருந்து வெளியேற்றத் தேவைப்படும் சிறும ஆற்றல் பிணைப்பு ஆற்றல் அல்லது அயனியாக்க ஆற்றல் என்று அழைக்கப்படுகிறது.
Eஅயனியாக்கம் = E∞ − En
Eஅயனியாக்கம் = (13.6 / n2)Z2 eV
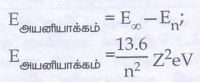
அயனியாக்க மின்னழுத்தம்:
ஓரலகு மின்னூட்டத்திற்கான அயனியாக்க ஆற்றல் அயனியாக்க மின்னழுத்தம் என வரையறுக்கப்படுகிறது.
Eஅயனியாக்கம் =1/e Eஅயனியாக்கம்
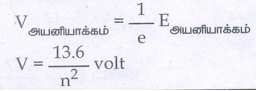
V = (13.6 / n2) Volt
7. போர் அணு மாதிரியின் குறைபாடுகளைக் கூறுக.
போர் அணு மாதிரியின் குறைபாடுகள் பின்வருமாறு:
• ஹைட்ரஜன் அல்லது ஹைட்ரஜனைப் போன்ற அணுக்களுக்கு மட்டுமே போர் அணு மாதிரி பொருத்தமானது. பிற சிக்கலான அணுக்களுக்கு இது பொருந்துவதில்லை.
• ஹைட்ரஜன் நிறமாலையின் வரிகளை உற்றுநோக்கும் போது, ஒவ்வொரு வரியும் பல மங்கலான வரிகளால் ஆனது எனத் தெரிகிறது. இதை நுண்வரியமைப்பு (fine structure) என்பர். போர் கொள்கை இதற்கு விளக்கம் தரவில்லை .
• நிறமாலை வரிகளின் செறிவில் காணப்படும் மாற்றங்களுக்கான விளக்கம் போர் அணு மாதிரியால் தரப்படவில்லை.
• அணுக்களில் எலக்ட்ரான்களின் பகிர்வு தொடர்பான முழுமையான விளக்கமும் போர் அணு மாதிரியால் தரப்படவில்லை.
8. மீச்சிறு அணுகு தொலைவு என்றால் என்ன?
• அணுக்கருவை நோக்கி நேராக ஓர் ஆல்பா துகள் செல்லும்போது, குறிப்பிட்ட ஒரு புள்ளியை அது அடைந்த பிறகு, சிறிது நேரம் நின்று பின் திரும்புகின்றது.
• இவ்வாறு 180° கோணத்தில் எதிரொளிப்பு அடைவதற்கு முன், ஆல்பா துகள் மற்றும் அணுக்கரு ஆகிய இரண்டிற்கும் இடையே உள்ள சிறும தொலைவு 'மீச்சிறு அணுகு தொலைவு' r0 எனப்படும். (இதை தொடுகை தொலைவு எனவும் அழைப்பர்).
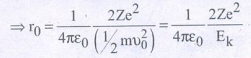
9. மோதல் காரணி − வரையறுக்கவும்.
அணுக்கருவின் (தங்க) மையத்திற்கும், ஆல்பா துகள் அதிக தொலைவில் உள்ள போது அதன் (நீட்டிக்கப்பட்ட) திசைவேக வெக்டரின் திசைக்கும் இடைப்பட்ட செங்குத்துத் தொலைவானது, மோதல் காரணி (b) என வரையறுக்கப்படுகிறது.
10. தனிமத்தின் அணுக்கருவின் குறியீட்டு முறையை எழுதுக. அதில் ஒவ்வொரு உறுப்பும் எதைக் குறிக்கின்றன?
• ஒரு தனிமத்தின் அணுக்கருவை குறிப்பதற்கு பின்வரும் குறிமுறையைப் பயன்படுத்துகிறோம்.
AZX
• இங்கு X என்பது தனிமத்தின் வேதிக் குறியீடு, A என்பது நிறை எண் மற்றும் Z என்பது அணு எண்.
• எடுத்துக்காட்டாக நைட்ரஜன் அணுக்கரு 7N15 என்று குறிப்பிடப்படுகிறது. இது நைட்ரஜன் அணுக்கருவில் 15 நியூக்ளியான்கள் உள்ளன என்பதை உணர்த்துகிறது. இதில் 7 புரோட்டான்கள் (Z = 7) மற்றும் 8 நியூட்ரான்கள் (N = A − Z = 8) உள்ளன.
11. ஐசோடோப்பு என்றால் என்ன? எடுத்துக்காட்டு ஒன்று தருக.
அணு மூன்று ஐசோடோப்புகளைக் கொண்டது, அவை 11H (ஹைட்ரஜன்), 21H (டியூட்டிரியம்) மற்றும் 31H (டிரிட்டியம்) எனக் குறிப்பிடப்படுகின்றன. இவை அனைத்திலும் ஒரேயொரு புரோட்டான் மட்டுமே உள்ளதைக் கவனிக்கவும்.
12. ஐசோடோன் என்றால் என்ன? எடுத்துக்காட்டு ஒன்று தருக.
ஐசோடோன்கள்: சம எண்ணிக்கையில் நியூட்ரான்களைக் கொண்டுள்ள வெவ்வேறு தனிமங்களின் அணுக்கள் ஐசோடோன்கள் எனப்படும். (எ.கா) 125B மற்றும் 126B இவற்றில் 7 நியூட்ரான்கள் உள்ளன.
13. ஐசோபார் என்றால் என்ன? எடுத்துக்காட்டு ஒன்று தருக.
ஐசோபார்கள்:
• ஐசோபார்கள் என்பவை சமமான நிறை எண் (A) மற்றும் வேறுபட்ட அணு எண் (Z) கொண்ட வெவ்வேறு தனிமங்களின் அணுக்கள் ஆகும்.
• எடுத்துக்காட்டாக 4016S, 4017Cl, 4018Ar, 4019K மற்றும் 4020Ca ஆகியவை சமமான நிறை எண் 40 மற்றும் வெவ்வேறு அணு எண்களையும் கொண்ட ஐசோபார்கள்.
14. வரையறு − அணுநிறை அலகு u.
அணு நிறை அலகு (u) என்பது 126C ஐசோடோப்பின் நிறையில் 12 இல் ஒரு பங்கு ஆகும்.
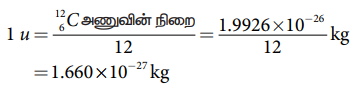
1u = 1.660 × 10−27 kg
15. அனைத்து அணுக்கருக்களின் (Z > 10) அணுக்கரு அடர்த்தி மாறிலி எனக் காட்டுக.
அணுக்கருவின் அடர்த்தி
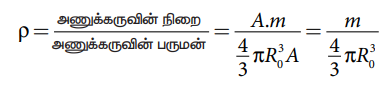
இந்த கோவையில் அணுக்கரு அடர்த்தி நிறை எண்ணைச் சார்ந்ததல்ல. அதாவது அனைத்து அணுக்கருக்களும் (Z > 10) ஒரே அடர்த்தியை உடையன.
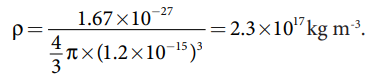
16. நிறை குறைபாடு என்றால் என்ன?
• எந்தவொரு அணுக்கருவின் நிறையும் அதிலுள்ள நியூக்ளியான் நிறைகளின் கூட்டுத்தொகையைவிட குறைவாக உள்ளதே நிறை குறைபாடு (∆m) எனப்படும்.
• பொதுவாக M, mp மற்றும் mn ஆகிய குறியீடுகள் முறையே ![]() அணுக்கருவின் நிறை, புரோட்டானின் நிறை மற்றும் நியூட்ரானின் நிறை ஆகியவற்றைக் குறிக்கின்றன எனில், நிறை குறைபாடு ∆m = (Zmp + Nmn) −M
அணுக்கருவின் நிறை, புரோட்டானின் நிறை மற்றும் நியூட்ரானின் நிறை ஆகியவற்றைக் குறிக்கின்றன எனில், நிறை குறைபாடு ∆m = (Zmp + Nmn) −M
17. அணுக்கருவின் பிணைப்பாற்றல் என்றால் என்ன? அதன் கோவையை எழுதுக.
• புரோட்டான்களும். நியூட்ரான்களும் இணைந்து அணுக்கரு உருவாகும்போது மறையும் நிறை (∆m) அதற்கு சமமான ஆற்றலாக வெளிப்படுகின்றது. இந்த ஆற்றல் அணுக்கருவின் பிணைப்பு ஆற்றல் எனப்படும்.
BE = (Zmp + Nmn – M)c2
18. ஒரு அணு நிறை அலகிற்கு சமமான ஆற்றல் மதிப்பைக் கணக்கிடுக.
ஐன்ஸ்டீனின் நிறை ஆற்றல் சமத்தன்மையைப் பயன்படுத்தி ஒரு அணு நிறை அலகிற்குச் சமமான ஆற்றல் வருமாறு. 1u = 1.66 × 10−27 × (3 × 108)2 =14.94 × 10−11 J ≈ 931 MeV ஆகும்.
19. நியூக்ளியான் ஒன்றுக்கான பிணைப்பாற்றல் என்பதன் அர்த்தத்தை கூறுக.
அணுக்கரு ஒன்றிலிருந்து ஒரு நியூக்ளியானை வெளியேற்றத் தேவைப்படும் ஆற்றலாகும்.
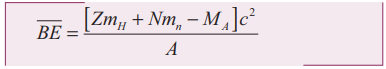
20. கதிரியக்கம் என்றால் என்ன?
ஒரு தனிமத்திலிருந்து அதிக ஊடுருவு திறன் கொண்ட கதிர்வீச்சுகளான α. β மற்றும் γ கதிர்கள் தன்னிச்சையாக உமிழப்படும் நிகழ்வு கதிரியக்கம் எனப்படும். மேலும், இத்தகைய கதிர்வீச்சுகளை உமிழும் தனிமங்கள் கதிரியக்கத் தனிமங்கள் எனப்படும்.
21. குறியீட்டு முறையில் பின்வருவனவற்றை எழுதுக: (i) ஆல்பா சிதைவு (ii) பீட்டா சிதைவு (iii) காமா உமிழ்வு
ஆல்பா சிதைவு குறியீட்டு முறையில்:
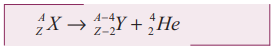
இங்கு X என்பது தாய் அணுக்கரு என்றும் Y என்பது சேய் அணுக்கரு என்றும் அழைக்கப்படுகின்றன.
β− சிதைவு: 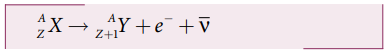
அணுக்கரு X ஒரு எலக்டரானையும் ஒரு எதிர் நியூட்ரினோவையும் (antineutrino) வெளியிடுவதனால் Y ஆக மாறுகின்றது.
β+ சிதைவு: 
அணுக்கரு X ஒரு பாசிட்ரானையும் ஒரு நியூட்ரினோவையும் வெளியிட்டு Y ஆக மாறுகின்றது.
காமா சிதைவு: 
இங்கு மேல் இடப்பட்டுள்ள உடுகுறி (*) கிளர்வு நிலையிலுள்ள அணுக்கருவைக் குறிக்கின்றது. காமா சிதைவில் நிறை எண் மற்றும் அணு எண்ணில் எவ்வித மாற்றமும் இருப்பதில்லை.
22. ஆல்பா சிதைவில் நிலைத்தன்மையற்ற ஒரு அணுக்கரு ஏன் 24He அணுக்கருவை உமிழ்கிறது? நான்கு தனித்தனி நியூக்ளியான்களை அது ஏன் உமிழ்வதில்லை?
• ஏனெனில் 42He இலும் இரண்டு புரோட்டான்களும் இரண்டு நியூட்ரான்களும் அல்லவா உள்ளன.
• இதன் காரணத்தை பின்வருமாறு விளக்கலாம். எடுத்துக்காட்டாக 23892U அணுக்கருவானது நான்கு தனித்தனி நியூக்ளியான்களை (இரண்டு புரோட்டான்கள் மற்றும் இரண்டு நியூட்ரான்கள்) வெளியிடுவதன் மூலம் 23490Th அணுக்கருவாகச் சிதைவுற்றால், இந்நிகழ்வின் சிதைவு ஆற்றல் Q எதிர்க்குறி கொண்டதாக இருக்க வேண்டும்.
• ஆல்பா சிதைவிற்கு பிறகு உண்டாகும் விளைவுப் பொருள்களின் மொத்த நிறையானது தாய் அணுக்கருவின் (23892U) நிறையை விட அதிகமாக இருக்கும் என்பதை இது காட்டுகிறது. ஆற்றல் மாறா விதியை இது மீறும் என்பதால் இத்தகைய நிகழ்வு இயற்கையில் ஏற்படாது.
• எந்தவொரு சிதைவு நிகழ்வும் ஆற்றல் மாறா விதி, நேர்க்கோட்டு உந்தம் மாறா விதி மற்றும் கோண உந்த மாறா விதி ஆகியவற்றுக்கு உட்பட்டு இருக்க வேண்டும்.
23. அணுக்கருவின் சராசரி ஆயுட்காலம் என்றால் என்ன? அதன் சமன்பாட்டினை எழுதுக.
• அனைத்து அணுக்கருக்களின் ஆயுட்காலங்களின் கூடுதல் அல்லது தொகையீட்டிற்கும், தொடக்கத்தில் இருந்த மொத்த அணுக்கருக்களின் மொத்த எண்ணிக்கைக்கும் உள்ள தகவு ஆகும்.
τ = 1 / λ
• சராசரி ஆயுளும் சிதைவு மாறிலியும் எதிர்த்தகவில் உள்ளதைக் கவனிக்கவும்.
24. அணுக்கருவின் அரை ஆயுட்காலம் என்றால் என்ன? அதன் சமன்பாட்டினை எழுதுக.
தொடக்கத்தில் உள்ள அணுக்களில் பாதியளவு அணுக்கள் சிதைவடைய ஒரு தனிமம் எடுத்துக்கொள்ளும் காலம் அரை ஆயுட்காலம் T1/2 எனப்படும்.
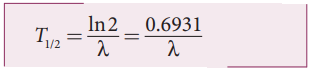
25. கதிரியக்கச் செயல்பாடு அல்லது சிதைவு வீதம் என்றால் என்ன? அதன் அலகு என்ன?
கதிரியக்கச் செயல்பாடு அல்லது சிதைவு வீதம் (R) என்பது ஒரு வினாடியில் சிதைவடையும் அணுக்கருக்களின் எண்ணிக்கை ஆகும். R என்பது ஒரு நேர்க்குறி மதிப்புடைய அளவீடு ஆகும்.
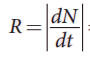
SI அலகு: Bq (பெக்கரல்) (அல்லது) [ சிதைவுகள் / வினாடி ]
மற்றொரு அலகு: 1 கியூரி = 1 Ci = 3.7 × 1010 Bq
26. கியூரி − வரையறுக்கவும்.
ஒரு கியூரி என்பது 1g ரேடியம் 1 வினாடியில் உமிழும் சிதைவுகளின் எண்ணிக்கைக்குச் சமமாகும். அதாவது ஒரு வினாடிக்கு 3.7× 1010 சிதைவுகள்.
27. நியூட்ரான் மற்றும் புரோட்டான் ஆகியவை எந்த துகள்களினால் ஆனவை?
• புரோட்டான்களும், நியூட்ரான்களும் குவார்க்குகள் என்ற அடிப்படைத் துகள்களால் ஆனவை.
• ஒரு புரோட்டான் இரண்டு மேல் குவார்க்குகள், மற்றும் ஒரு கீழ் குவார்க்காலும் ஆக்கப்பட்டிருக்கிறது. அதே போல், ஒரு நியூட்ரான் இரண்டு கீழ் குவார்க்குகள் மற்றும் ஒரு மேல் குவார்க்காலும் ஆக்கப்பட்டிருக்கிறது.