11 வது வேதியியல் : அலகு 4 : ஹைட்ரஜன்
சுருக்கமாக விடையளிக்கவும்
II. சுருக்கமாக விடையளிக்கவும்
22. தனிம வரிசை அட்டவணையில் ஹைட்ரஜன் ஏன் ஹேலஜன்களுடன் வைக்கப்படவில்லை?
(i) ஹைட்ரஜனின் எலக்ட்ரான் அமைப்பு 1s1 இது கார உலோகங்களின் பொதுவான இணைதிறன் கூட்டு எலக்ட்ரான் அமைப்பான ns1 ஐ ஒத்திருக்கிறது.
(ii) மேலும் ஹைட்ரஜன் கார உலோகங்களின் பண்புகளையும் ஒத்துள்ளது.
(iii) ஹேலஜன்கள், ஹேலைடு அயனிகளை (x−) உருவாக்குவதைப்போல, ஹைட்ரஜனும் ஒரு எலக்ட்ரானை ஏற்றுக்கொண்டு ஹைட்ரைடு அயனியை (H−) உருவாக்குகிறது.
(iv) இருப்பினும் ஹைட்ரஜனின் எலக்ட்ரான் நாட்ட மதிப்பானது ஹேலஜன்களை விடக் குறைவாக உள்ளது.
(v) ஹைட்ரஜன், ஹைட்ரைடு அயனியை உருவாக்கும் இயல்பினைக் காட்டிலும் குறைவாகவே உள்ளது.
சான்று:
½ H2 + e− → H− ∆H = +36 kcalmol−1
½ Br2 + e− → Br− ∆H = −55 kcalmol−1
எனவே ஹைட்ரஜன் தனிம வரிசை அட்டவணையில் தனியாக வைக்கப்பட்டுள்ளது.
23. மூன்று வகையான சகப்பிணைப்பு ஹைட்ரைடுகளைக் குறிப்பிடுக.
1. எலக்ட்ரான் குறைபாடுடையவை (B2H6)
2. எலக்ட்ரான் அதிகமாக உள்ள ஹைட்ரைடுகள் (NH3, H2O)
3. சரியான எலக்ட்ரானைக் கொண்டுள்ள ஹைட்ரைடுகள் (CH4 ,C2H6, SiH4, GeH4)
24. HCl மற்றும் NaH ஆகியனவற்றுள் எந்த ஹைட்ரைடு திடப்பொருள் மீதான வாயு. உனது விடைக்கான காரணத்தினைக் கூறு.
அ) HCl -இது ஒரு சகப்பிணைப்பு ஹைட்ரைடு, ஏனெனில், இத்தகைய ஹைட்ரைடுகள் தனித்த, சிறிய மூலக்கூறுகளாக உள்ளன. அவற்றிற்கிடையே ஒப்பீட்டளவில் குறைவான கவர்ச்சிவிசை காணப்படுகிறது.
25. 4 - வது வரிசையில் உள்ள தனிமங்களின் ஹைட்ரைடுகளின் எதிர்பார்க்கப்படும் வாய்ப்பாட்டினை எழுதுக. வாய்ப்பாட்டின் போக்கு (trend) என்ன? இவ்வரிசையில் முதல் இரண்டு தனிமங்கள் மற்றவற்றிலிருந்து எவ்வாறு மாறுபடுகின்றன?
(i) எதிர்ப்பார்க்கப்படும் வாய்ப்பாடு : MH (அ) MH2
(ii) வேதிவினைக் கூறு விகிதத்தில் அமையாத மாறுபடும் இயைபினை (TiH1.5−1.8 (ம) Pd0.6−0.8) பெற்றுள்ளன.
(iii) முதல் இரண்டு தனிமங்கள் அயனி ஹைட்ரைடுகளை உருவாக்குபவை. மற்றவை சகப்பிணைப்பு (ம) உலோக ஹைட்ரைடுகளை உருவாக்குபவை.
26. கீழ்க்கண்ட வினைகளுக்கு வேதிச் சமன்பாட்டினை எழுதுக.
(i) டங்க்ஸ்டன் (vi) ஆக்ஸைடுடன், ஹைட்ரஜனை வெப்பப்படுத்துதல்
(ii) ஹைட்ரஜன் வாயு மற்றும் குளோரின் வாயு
i) WO3 + 3H2 → W + 3H2O
ii) ஹைட்ரஜன் வாயு ஒளி உள்ள நிலையில் குளோரினுடன் வினைபுரிந்து ஹைட்ரஜன் குளோரைடைத் தருகிறது.
H2 + Cl2 → 2HCl
27. கீழ்க்கண்ட வேதி வினைகளை பூர்த்தி செய்து.
(அ) நீராற் பகுத்தல்
(ஆ) ஆக்ஸிஜனேற்ற ஒடுக்க வினைகள்
(இ) நீரேற்ற வினைகள் என வகைப்படுத்துக
(i) KMnO4 + H2O2 →
(ii) CrCl3 + H2O →
(ii) CaO + H2O →
i) 2KMnO4 (aq) + 3H2O2 (aq) → 2MnO2 + 2KOH + 2H2O + 3O2 (g) − ஆக்ஸிஜனேற்ற ஒடுக்க வினை.
ii) CrCl3 + 6H2O → [Cr(H2O)6]Cl3 – நீரேற்ற வினை.
iii) CaO + H2O → Ca(OH)2 − நீராற் பகுத்தல் வினை.
28. ஹைட்ரஜன் பெராக்சைடு ஒரு ஆக்சிஜனேற்றியாகவும், ஆக்சிஜன் ஒடுக்கியாகவும் செயல்படுகிறது. இக்கூற்றினை தகுந்த எடுத்துக்காட்டுகளுடன் நிரூபிக்கவும்.
ஹைட்ரஜன் பெராக்சைடு, ஆக்சிஜனேற்றி மற்றும் ஆக்சிஜன் ஒடுக்கி ஆகிய இரண்டு வினைபொருட்களாகவும் செயல்படும் தன்மையுடையது.
அமில ஊடகத்தில் ஆக்சிஜனேற்ற வினைகள்
H2O2 + 2H+ + 2e− → 2H2O (E0 = + 1.77V)
எடுத்துக்காட்டாக,
2FeSO4 + H2SO4 + H2O2 → Fe2 (SO4)3 + 2H2O
கார ஊடகத்தில், ஆக்சிஜன் ஒடுக்க வினைகள்
H2O2 + OH− → O2 + H2O + 2e− (E0 = +0.08V)
எடுத்துக்காட்டாக, 2KMnO4 (aq) + 3H2O2 (aq) → 2MnO2 + 2KOH + 2H2O + 3O2(g)
29. கனநீரை குடிப்பதற்கு பயன்படுத்தலாம் என நீ கருதுகிறாயா?
(i) கனநீர் குடிப்பதற்கு பயன்படுவதில்லை. ஏனெனில் இது தாவரங்கள், விலங்குகள் மற்றும் மனிதர்களின் வினை வேகத்தினை குறைத்து பாதிப்பை ஏற்படுத்த வல்லது.
(ii) நீரைப் போன்று அனைத்து உயிரினங்களின் வாழ்விற்கு அடிப்படையாக கனநீர் அமைவதில்லை. எனவே கனநீரைக் குடிக்கப் பயன்படுத்த இயலாது.
30. நீர்வாயு மாற்ற வினை என்றால் என்ன?
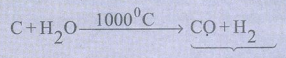
செஞ்சூட்டு கல்கரி + நீராவி → நீர்வாயு / தொகுப்பு வாயு
நீர்வாயுக் கலவை + நீராவி 400°C / (Fe/Cu) CO2 + H2
இம்முறையில் நீர் வாயுக்கலவையில் உள்ள CO, CO2வாக மாறுகிறது. இவ்வினை நீர்வாயு மாற்ற வினை எனப்படும்.
CO + H2O → CO2 + H2
31. தனிம வரிசை அட்டவணையில் ஹைட்ரஜனின் இடத்தை நியாயப்படுத்துக.
ஹைட்ரஜனின் எலக்ட்ரான் அமைப்பு 1s1 ஆகும். இது கார உலோகங்களின் பொதுவான இணைதிறன் கூட்டு எலக்ட்ரான் அமைப்பான ns1ஐ ஒத்திருக்கிறது. மேலும் ஹைட்ரஜன் கீழ்க்கண்டவாறு கார உலோகங்களின் பண்புகளையும் ஒத்துள்ளது.
1. கார உலோகங்களைப் போன்றே (Na+, K+, Cs+) ஒற்றை நேர்மின் சுமை உடைய அயனியை (H+) உருவாக்குகிறது.
2. கார உலோகங்களைப் (NaX, Na2O, Na2O2, Na2S) போன்றே ஹைட்ரஜனும் ஹேலைடுகள், (HX) ஆக்சைடுகள் (H2O), பெராக்சைடுகள் (H2O2) மற்றும் சல்ஃபைடுகளை (H2S) உருவாக்குகின்றன.
3. கார உலோகங்களைப் போன்றே, ஹைட்ரஜனும் ஒடுக்க வினைபொருளாகச் செயல்படுகிறது.
கார உலோகங்களில் இருந்து மாறுபாடு :
கார உலோகங்களின் அயனியாக்கும் ஆற்றலின் மதிப்பு 377 முதல் 520KJmol−1 வரை உள்ளது. ஆனால், ஹைட்ரஜனின் அயனியாக்கும் ஆற்றல் கார உலோகங்கள் போலன்றி 1314KJmol−1 என்ற அதிக மதிப்பினைக் கொண்டுள்ளது.
(i) ஹேலஜன்கள், ஹேலைடு அயனிகளை (x−1) உருவாக்குவதைப் போல, ஹைட்ரஜனும் ஒரு எலக்ட்ரானை ஏற்றுக்கொண்டு ஹைட்ரைடு அயனியை (H−) உருவாக்குகிறது.
(ii) இந்த அயனியின் எலக்ட்ரான் அமைப்பு. மந்த வாயுவான ஹீலியத்தின் எலக்ட்ரான் அமைப்பினை ஒத்துள்ளது.
(iii) இருப்பினும் ஹைட்ரஜனின் எலக்ட்ரான் நாட்ட மதிப்பானது ஹேலஜன்களை விடக் குறைவாக உள்ளது.
(iv) ஹைட்ரஜன், ஹைட்ரைடு அயனியை உருவாக்கும் இயல்பானது ஹேலஜன்கள், ஹேலைடு அயனியினை உருவாக்கும் இயல்பினைக் காட்டிலும் குறைவாகவே உள்ளது.
(v) இதனை கீழ்க்கண்டுள்ள வினைகளைச் சான்றாகக் கொண்டு அறியலாம்.
(vi) ஹைட்ரஜன் கார உலோகங்கள் மற்றும் ஹேலஜன்களின் பண்புகளோடு ஒத்துள்ளது. எனவே, தனிம வரிசை அட்டவணையில் சிறப்பான இடத்தில் ஹைட்ரஜன் இடம் பெற்றுள்ளது.
½ H2 + e− → H− ∆H = +36 kcalmol−1
½ Br2 + e− → Br− ∆H = −55 kcalmol−1
32. ஐசோடோப்புகள் [மாற்றியங்கள்] என்றால் என்ன? ஹைட்ரஜனின் ஐசோடோப்புகளின் பெயர்களை எழுதுக.
ஒத்த அணு எண் மாறுபட்ட நிறை எண் கொண்ட ஒரே தனிமத்தின் அணுக்கள் ஐசோடோப்புகள் எனப்படும். ஹைட்ரஜனின் ஐசோடோப்புகள்
1) புரோட்டியம் (1H1 அல்லது H)
2) டியூட்டிரியம் (1H2அல்லது D)
3) டிரிட்டியம் (1H3 அல்லது T)
33. கனநீரின் பயன்களைத் தருக.
1. அணுக்கரு உலைகளில் வேகமாகச் செல்லும் நியூட்ரான்களின் ஆற்றலை, கனநீர் குறைப்பதால் இது மட்டுப்படுத்தியாக பயன்படுகிறது.
2. கரிம வினைகளின் வினைவழி முறைகளை கண்டறிதல் மற்றும் உடல் செயற் வினைகளின் வழிமுறைகளை தீர்மானிப்பதில் இது சுவடறிவானாகப் பயன்படுகிறது.
3. அணுக்கரு உலைகளில், வெளிப்படும் வெப்ப ஆற்றலை உறிஞ்சும் தன்மையினை இது பெற்றிருப்பதால் குளிர்விப்பானாகப் பயன்படுகிறது.
34. டியூட்டிரியத்தின் பதிலீட்டு வினைகளை விளக்குக.
CH4 +2D2 → CD4 + 2H2
2NH3 + 3D2 → 2ND3 + 3H2
35. பாரா ஹைட்ரஜனை, ஆர்த்தோ ஹைட்ரஜனாக எவ்வாறு மாற்றலாம்?
1. பிளாட்டினம், இரும்பு (அயர்ன்) போன்ற வினைவேக மாற்றிகளைச் சேர்ப்பதன் மூலம்
2. மின் பாய்ச்சல் மூலமாகவும்.
3. 800°Cக்கும் அதிகமான வெப்பநிலைக்கு வெப்பப்படுத்துதல்.
4. O2, NO, NO2 போன்ற பாரா காந்தத் தன்மையுள்ள மூலக்கூறுகளைச் சேர்த்தல்.
5. பிறவி நிலை / அணு நிலை ஹைட்ரஜனைச் சேர்த்தல்.
36. டியூட்ரியத்தின் பயன்களைக் கூறுக.
அணுக்கரு உலைகளில் மட்டுப்படுத்தியாக, வேதிவினை வழிமுறை கண்டறிதலில் சுவடறிவானாக. டியுட்டிரோ சேர்மங்கள் தயாரிக்க செயற்கை கதிரியக்க வினைகளில் தாக்கும் துகளாக பயன்படுகிறது.
37. மின்னாற் பகுப்பு முறையில் ஹைட்ரஜன் தயாரித்தலை விளக்குக.
மிகச் சிறிதளவு அமிலம் அல்லது காரம் கலந்த நீரினை மின்னாற் பகுத்தல் மூலம் மிகத் தூய்மையான (>99.9%) ஹைட்ரஜனைப் பெறலாம் அல்லது சோடியம் ஹைட்ராக்சைடு, பொட்டாசியம் ஹைட்ராக்சைடு போன்றவற்றின் நீர்க்கரைசலை மின்னாற்பகுத்தும் ஹைட்ரஜனைப் பெறலாம்.
இம்மின்னாற்பகுப்பில் நிக்கல் நேர்மின் வாயாகவும், இரும்பு (iron) எதிர்மின்வாயாகவும் செயல்படுகிறது.
நேர்மின் வாயில் : 2OH− → H2O + ½ O2 + 2e−
எதிர்மின் வாயில்: 2H2O + 2e− → 2OH− + H2
ஒட்டுமொத்த வினை : H2O → H2 + ½ O2

38. பொதுவாக பயன்படுத்தப்படும் உப்பில் உள்ள ஒரு முதல் தொகுதி உலோகம் (A) ஆனது (B) உடன் வினைபுரிந்து (C) என்ற சேர்மத்தினைத் தருகிறது. இச்சேர்மத்தில் ஹைட்ரஜன் -1 ஆக்சிஜனேற்ற நிலையில் காணப்படுகிறது. (B) ஆனது (D) என்ற வாயுவுடன் வினைப்பட்டு அனைத்துக் கரைப்பானான (E) ஐத் தருகிறது. சேர்மம் (D) ஆனது (A) உடன் வினைப்பட்டு (F) என்ற ஒரு வலிமையான காரத்தினைத் தருகிறது. A, B, C, D, E மற்றும் F யைக் கண்டறிக. வினைகளை விளக்குக.
பொதுவாகப் பயன்படும் உப்பு − NaCl
இதில் உள்ள முதல் தொகுதி உலோகம் (A) − Na
Na + (B) → (C)
இதில் ஹைட்ரஜனின் ஆக்ஸிஜனேற்ற நிலை − 1

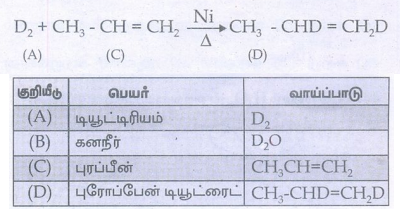
39. ஹைட்ரஜனின் (A) என்ற ஐசோடோப்பானது 16ம் தொகுதி, 2வது வரிசையில் உள்ள ஈரணு மூலக்கூறுகளுடன் வினைபுரிந்து அணுக்கரு உலைகளில் மட்டுப்படுத்தியாகச் செயல்படும் (B) என்ற சேர்மத்தினைத் தருகிறது. (A) ஆனது (C) – C3H6 உடன் சேர்க்கை வினைக்கு உட்பட்டு (D)யைத் தருகிறது. A, B, C மற்றும் Dயைக் கண்டறிக.
ஹைட்ரஜனின் ஐசோடோப்பு ஆக்ஸிஜனுடன் வினைபுரிந்து கனநீரைத் தருகிறது.
2D2 + O2 → 2D2O
(A) (B)
டியூட்ரியம் (A) ஆனது புரப்பீனுடன் சேர்க்கை வினைக்குட்பட்டு புரோப்பேன் டியூட்ரைட்டைத் தருகிறது.
40. NH3 ஆனது, 15ம் தொகுதியில் உள்ள பிற தனிமங்களின் ஹைட்ரைடுகளைக் காட்டிலும் அதிக உருகுநிலை மற்றும் கொதிநிலையைக் கொண்டுள்ளது - விளக்குக.
(i) சகப்பிணைப்பு ஹைட்ரைடான் NH3 மூலக்கூறில் தனித்த ஜோடி எலக்ட்ரான், அதிக எலக்ட்ரான் கவர் திறன் கொண்ட N அணுவின் மீது உள்ளது.
(ii) இதனால், NH3 மூலக்கூறுகளுக்கிடைப்பட்ட ஹைட்ரஜன் பிணைப்பைப் பிற NH3 மூலக்கூறுடன் ஏற்படுத்தும் தன்மை பெறுகிறது.
(iii) (NH3)n போன்ற தொகுப்பு மூலக்கூறாக இருப்பதால் பிற தனிமங்களின் ஹைட்ரைடுகளைக் காட்டிலும் அதிக உருகுநிலை மற்றும் கொதிநிலையைக் கொண்டுள்ளது.
41. இடைச் செருகல் ஹைட்ரைடுகள் அதில் உள்ள உலோகங்களைக் காட்டிலும் குறைவான அடர்த்தியினைப் பெற்றுள்ளது ஏன்?
இடைச் செருகல் ஹைட்ரைடுகள் வேதி வினைக்கூறு விகிதத்தில் அமையாத மாறுபடும் இயைபினை (TiH1.5−1.8 மற்றும் PdH0.6 − 0.8) பெற்றுள்ளன. எனவே இவை குறைவான அடர்த்தியைப் பெற்றுள்ளன.
42. ஹைட்ரஜனை சேமித்து வைக்க உலோக ஹைட்ரைடுகள் எவ்வகையில் பயன்படும் என நீ எதிர்பார்க்கின்றாய்?
(i) இத்தகைய ஹைட்ரைடுகள் வேதிவினைக் கூறு விகிதத்தில் அமையாத மாறுபடும் இயைபினை (TiH1.5−1.8 மற்றும் PdH0.6−0.8) பெற்றுள்ளன.
(ii) ஒப்பீட்டு அளவில் சில ஹைட்ரைடுகள் இலேசானதாகவும், வெப்ப நிலைப்புத்தன்மை அற்றதாகவும், விலை மலிவானதாகவும் இருப்பதால் ஹைட்ரஜனை சேமிக்கப் பயன்படுகிறது.
43. NH3, H2O மற்றும் HF ஆகியவற்றை அவற்றின் ஹைட்ரஜன் பிணைப்புத் தன்மையின் ஏறு வரிசையில் வரிசைப்படுத்துக தங்களது வரிசைப்படுத்தலுக்கான அடிப்படையினை விளக்குக.
(i) ஹைட்ரஜன் பிணைப்புத் தன்மையின் ஏறுவரிசை NH3 < H2O < HF
(ii) ஏனெனில் F, O மற்றும் N ஆகியவற்றின் எலக்ட்ரான் கவர்தன்மை வரிசை F > O > N
44. H2O மற்றும் H2O2ன் வடிவமைப்புகளை ஒப்பிடுக.
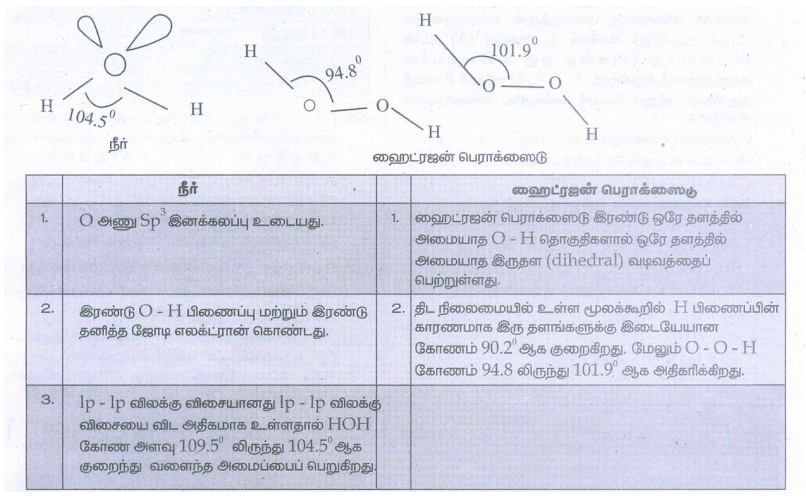
நீர்
1. O அணு Sp3 இனக்கலப்பு உடையது.
2. இரண்டு O − H பிணைப்பு மற்றும் இரண்டு தனித்த ஜோடி எலக்ட்ரான் கொண்டது.
3. lp − 1p விலக்கு விசையானது 1p − 1p விலக்கு விசையை விட அதிகமாக உள்ளதால் HOH கோண அளவு 109.5° லிருந்து 104.5° ஆக குறைந்து வளைந்த அமைப்பைப் பெறுகிறது.
ஹைட்ரஜன் பெராக்ஸைடு
1. ஹைட்ரஜன் பெராக்ஸைடு இரண்டு ஒரே தளத்தில் அமையாத O − H தொகுதிகளால் ஒரே தளத்தில் அமையாத இருதள (dihedral) வடிவத்தைப் பெற்றுள்ளது.
2. திட நிலைமையில் உள்ள மூலக்கூறில் H பிணைப்பின் காரணமாக இரு தளங்களுக்கு இடையேயான கோணம் 90.2° ஆக குறைகிறது. மேலும் O − O − H கோணம் 94.8 லிருந்து 101.9° ஆக அதிகரிக்கிறது.