11 வது வேதியியல் : அலகு 4 : ஹைட்ரஜன்
பாடச்சுருக்கம்
பாடச்சுருக்கம்
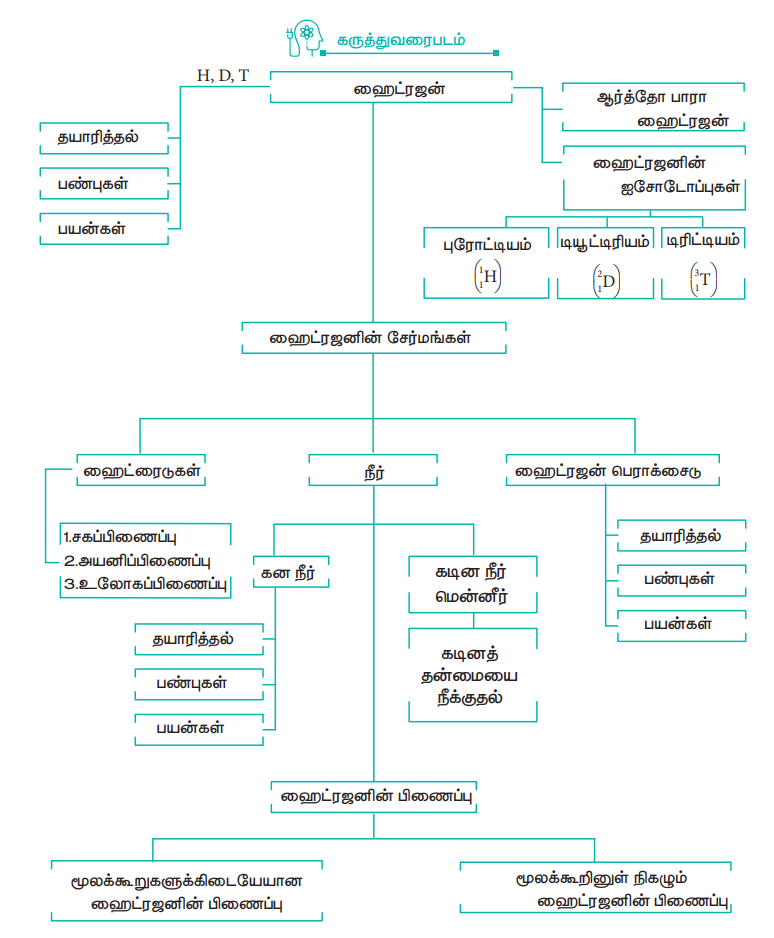
ஹைட்ரஜனானது ஒரு எலக்ட்ரான் மற்றும் ஒரு புரோட்டானைக் கொண்ட ஒரு எளிய அணுவாகும். இது புரோட்டியம், டியூட்டிரியம் மற்றும் டிரிட்டியம் ஆகிய மூன்று ஐசோடோப்புகளைக் கொண்டுள்ளது. ஹைட்ரஜன் வாயு நிலையில் ஈரணு மூலக்கூறாகக் காணப்படுகிறது, இது ஆர்த்தோ ஹைட்ரஜன், பாரா ஹைட்ரஜன் ஆகிய இரு அணுக்கரு சுழற்சி மாற்றியங்களைக் கொண்டுள்ளது, அணு நிலையில் உள்ள ஹைட்ரஜனின் எலக்ட்ரான் அமைப்பு 1s1. இதன் பண்புகளானது, கார உலோகங்கள் மற்றும் ஹேலஜன்களின் பண்புகளை ஒத்துள்ளது இதன் எலக்ட்ரான் அமைப்பு மற்றும் பெரும்பாலான சேர்மங்களில் இதனுடைய ஆக்சிஜனேற்ற எண் +1 ஆக இருப்பதால் தனிம வரிசை அட்டவணையில் கார உலோகங்களுடன் முதல் தொகுதியில் வைக்கப்பட்டுள்ளது.
ஆய்வகத்தில், உலோகங்களை, அமிலங்களுடன் வினைபுரியச் செய்து ஹைட்ரஜன் தயாரிக்கப்படுகிறது. தொழில் ரீதியாக ஹைட்ரோ கார்பன்களை நீராவி - மீட்டுருவாக்கம் செய்வதன் மூலம் ஹைட்ரஜன் தயாரிக்கப்படுகிறது. கனநீரை மின்னாற்பகுத்தல் செய்வதன் மூலம் டியூட்டிரியத்தினைப் பெற முடியும், கதிரியக்கத் தன்மை உடைய டிரிட்டியத்தை, லித்தியத்தினை மெதுவான நியூட்ரான்களைக் கொண்டு தாக்கும் அணுக்கரு மாற்ற வினைகள் மூலம் தயாரிக்கலாம்.
ஹைட்ரஜனானது, ஆக்சிஜன் மற்றும் ஹேலஜன்கள் ஆகிய அலோகங்களுடன் வினைபுரிந்து முறையே நீர் மற்றும் ஹேலைடுகளைத் தருகின்றன. இது சிறந்த ஒடுக்கும் காரணியாகும். டியூட்டிரியம் ஹைட்ரஜனுடன் பதிலீட்டு வினைகளில் ஈடுபடுகிறது.
12.3 வருடங்கள் அரைவாழ்காலம் உடைய டிரிட்டியம், β துகள்களை தன்னிச்சையாக உமிழ்கிறது. அம்மோனியா, மெத்தனால் போன்றவை தயாரித்தல் மற்றும் எண்ணெயை ஹைட்ரஜனேற்றம் செய்தல், உலோக ஆக்ஸைடுகளை ஒடுக்குதல் ஆகியவற்றிற்கு ஹைட்ரஜன் பெருமளவில் பயன்படுகிறது. இதனை எரிபொருளாகவும் பயன்படுத்தலாம்.
நீரானது, ஹைட்ரஜனின் ஈரியல்புத் தன்மை உடைய ஆக்சைடாகும் இது பொதுவான கரைப்பானாகப் பயன்பட்டு வருகிறது, இது ஆக்சைடுகளை நீராற்பகுப்பு அடையச் செய்கிறது மேலும் சோடியம் மற்றும் பேரியம் போன்ற உலோகங்களுடன் உலோக ஹைட்ராக்சைடுகளைத் தருகிறது
கால்சியம் மற்றும் மெக்னீசியத்தின் உப்புகள் நீரில் கரைந்துள்ளதால் நீரானது கடினத்தன்மை உடையதாக இருக்கிறது. கிளார்க் முறையினைப் பயன்படுத்தி தற்காலிகக் கடினத்தன்மையை நீக்கலாம். ஹைட்ரஜன் பெராக்சைடு ஆனது நீரைப் போலவே ஹைட்ரஜனின் மற்றும் ஒரு முக்கியமான ஆக்சைடு ஆகும்.
ஹைட்ரஜன் பெராக்சைடு வீரியம் குறைந்த புரைத்தடுப்பானாகவும் மற்றும் காகித துணித் தொழிற்சாலைகளில் வெளுக்கும் வினை பொருளாகவும் பயன்படுகிறது. புளூரின், நைட்ரஜன், ஆக்சிஜன் போன்ற எலக்ட்ரான் கவர்த்தன்மை அதிகம் உடைய அணுக்களுடன் ஹைட்ரஜனானது வலிமை குறைந்த ஹைட்ரஜன் பிணைப்பினை ஏற்படுத்துகிறது. ஹைட்ரஜன் பிணைப்பானது உயிரி மூலக்கூறுகளான புரோட்டீன், DNA போன்றவற்றில் காணப்படுகிறது.
கருத்துவரைபடம்