தனிம வரிசை அட்டவணையில் இடம், ஹைட்ரஜனின் ஐசோடோப்புகள், ஆர்த்தோ மற்றும் பாரா ஹைட்ரஜன் | வேதியியல் - ஹைட்ரஜன் | 11th Chemistry : UNIT 4 : Hydrogen
11 வது வேதியியல் : அலகு 4 : ஹைட்ரஜன்
ஹைட்ரஜன்
அலகு 4
ஹைட்ரஜன்

Hydrogen, third most abundant on the surface of the Universe, is being visualised as the major feature source of energy

லவாய்சியர் (1743-1794)
ஹைட்ரஜன் மற்றும் ஆக்ஸிஜன் ஆகியவற்றை பெயரிட்டார். 1787ல் வேதிப் பெயரிடுதலுக்கான புதிய முறையை அறிமுகப்படுத்தினார்.
கற்றலின் நோக்கங்கள்
இப்பாடப் பகுதியைக் கற்றறிந்த பின்னர்
● தனிம வரிசை அட்டவணையில் ஹைட்ரஜனின் இடத்தினை நியாயப்படுத்துதல்.
● ஹைட்ரஜனின் வெவ்வேறு ஐசோட்டோப்புகளை மீட்டறிதல்.
● ஹைட்ரஜன் தயாரிக்கும் முறைகளை விளக்குதல்.
● ஹைட்ரஜனின் பண்புகளை விளக்குதல்.
● ஹைட்ரஜனின் பயன்களை உணர்ந்தறிதல்.
● பல்வேறு வகை ஹைட்ரைடுகளை வேறுபடுத்தி அறிதல்.
● நீரின் வடிவமைப்புப் பற்றிய அறிவின் மூலம் அதன் இயற் மற்றும் வேதிப் பண்புகளை விளக்குதல்
● கடின நீர் மற்றும் மென்நீரை வேறுபடுத்தி அறிதல் மேலும் நீரின் கடினத் தன்மையை நீக்க தகுந்த முறையினைத் தெரிவு செய்தல்.
● கன நீரை மீட்டறிதல் மற்றும் அதன் பண்புகளை விளக்குதல்.
● ஹைட்ரஜன் பெராக்சைடு தயாரித்தல் மற்றும் அதன் பண்புகளை விளக்குதல்
● ஹைட்ரஜன் பெராக்சைடின் பயன்களைப் பட்டியலிடுதல்
ஆகிய திறன்களை மாணவர்கள் பெற இயலும்.
பாட அறிமுகம்
ஹைட்ரஜன் என்பது, ஒரு எலக்ட்ரான் மற்றும் ஒரு புரோட்டானைக் கொண்டுள்ள மிக எளிமையான அணுவாகும். மேலும் மற்ற தனிமங்களைப் போலன்றி (ஹீலியம் தவிர) இதன் ஒற்றை இணைதிறன் எலக்ட்ரான், அணுக் கருவின் நேரடி விசைக்கு உட்படும் பகுதியில் அமைந்துள்ளது. நாம் அன்றாடம் பயன்படுத்தக் கூடிய நீர், கார்போஹைட்ரேட் மற்றும் புரதம் போன்ற பெரும்பாலான சேர்மங்களில் ஹைட்ரஜன் உள்ளது. ஒரு தனித்த எலக்ட்ரானைப் பெற்றிருப்பதினால், இது அதிக வினைதிறன் மிக்கதாகவும், ஈரணு மூலக்கூறாகவும் (H2) காணப்படுகிறது. எனினும், வளிமண்டலத்தில் ஹைட்ரஜன் வாயு மிகக்குறைந்த அளவே உள்ளது.
1. தனிம வரிசை அட்டவணையில் இடம்
ஹைட்ரஜனின் எலக்ட்ரான் அமைப்பு 1s1 ஆகும். இது கார உலோகங்களின் பொதுவான இணைதிறன் கூட்டு எலக்ட்ரான் அமைப்பான ns1ஐ ஒத்திருக்கிறது. மேலும் ஹைட்ரஜன் கீழ்க்கண்டவாறு கார உலோகங்களின் பண்புகளையும் ஒத்துள்ளது.
1) கார உலோகங்களைப் போன்றே (Na+, K+, Cs+) ஒற்றை நேர்மின் சுமை உடைய அயனியை (H+) உருவாக்குகிறது.
2) கார உலோகங்களைப் (NaX, Na2O, Na2O2, Na2S) போன்றே ஹைட்ரஜனும் ஹேலைடுகள் (HX), ஆக்சைடுகள் (H2O), பெராக்சைடுகள் (H2O2) மற்றும் சல்ஃபைடுகளை (H2S) உருவாக்குகின்றன.
3) கார உலோகங்களைப் போன்றே, ஹைட்ரஜனும் ஒடுக்க வினைபொருளாகச் செயல்படுகிறது.
கார உலோகங்களின் அயனியாக்கும் ஆற்றலின் மதிப்பு 377 முதல் 520 kJmol-1 வரை உள்ளது. ஆனால், ஹைட்ரஜனின் அயனியாக்கும் ஆற்றல், காரஉலோகங்கள் போலன்றி 1314 kJ mol-1 என்ற அதிக மதிப்பினைக் கொண்டுள்ளது.
ஹேலஜன்கள், ஹேலைடு அயனிகளை (x-) உருவாக்குவதைப்போல, ஹைட்ரஜனும் ஒரு எலக்ட்ரானை ஏற்றுக் கொண்டு ஹைட்ரைடு அயனியை (H-) உருவாக்குகிறது. இந்த அயனியின் எலக்ட்ரான் அமைப்பு, மந்த வாயுவான ஹீலியத்தின் எலக்ட்ரான் அமைப்பினை ஒத்துள்ளது. இருப்பினும், ஹைட்ரஜனின் எலக்ட்ரான் நாட்ட மதிப்பானது ஹேலஜன்களைவிடக் குறைவாக உள்ளது. ஹைட்ரஜன், ஹைட்ரைடு அயனியை உருவாக்கும் இயல்பானது ஹேலஜன்கள், ஹேலைடு அயனியினை உருவாக்கும் இயல்பினைக் காட்டிலும் குறைவாகவே உள்ளது. இதனை கீழ்க்கண்டுள்ள வினைகளைச் சான்றாகக் கொண்டு அறியலாம்.
1/2 H2 + e- → H- ΔH = + 36 kcal mol-1
1/2 Br2 + e- → Br- ΔH = - 55 kcal mol-1
ஹைட்ரஜனானது, கார உலோகங்கள் மற்றும் ஹேலஜன்கள் ஆகியவைகளுடன் ஒத்திருப்பதால், தனிம வரிசை அட்டவணையில் சரியானதொரு இடத்தை தீர்மானிப்பது கடினமாகும். எனினும் பெரும்பாலான சேர்மங்களில் ஹைட்ரஜன் +1 ஆக்ஸிஜனேற்ற நிலையை கொண்டிருப்பதால், IUPAC – அமைப்பால் வெளியிடப்பட்டுள்ள தனிம வரிசை அட்டவணையில் உள்ளவாறு கார உலோகங்களுடன் ஹைட்ரஜனை இடம்பெறச் செய்வது சரியானதாக இருக்கும்.
2. ஹைட்ரஜனின் ஐசோடோப்புகள்
ஹைட்ரஜன் இயற்கையில் கிடைக்கப்பெறும் மூன்று ஐசோடோப்புகளைப் பெற்றுள்ளது. அவையாவன, புரோட்டியம் (1H1 அல்லது H) டியூட்டிரியம் (1H2 அல்லது D) மற்றும் டிரிட்டியம் (1H3அல்லது T). இவற்றுள் அதிக அளவில் (99.985%) புரோட்டியம் காணப்படுகிறது. இது நியூட்ரானை பெற்றிருக்காத ஒரே ஐசோடோப்பாகும்.
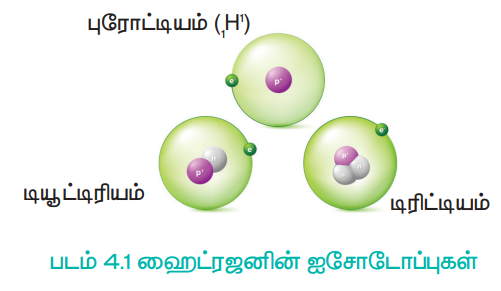
படம் 4.1 ஹைட்ரஜனின் ஐசோடோப்புகள்
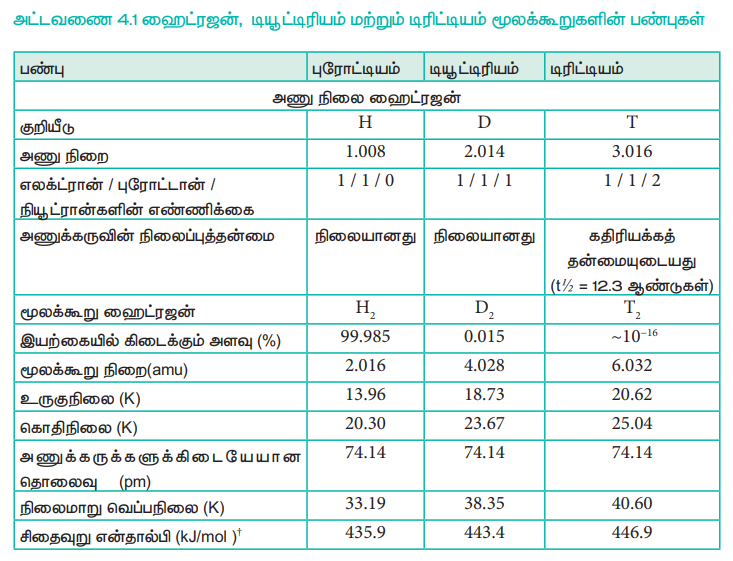
டியூட்டிரியத்தை கன ஹைட்ரஜன் என்றும் அழைக்கலாம். இது 0.015% அளவே கிடைக்கிறது. ஹைட்ரஜனின் மூன்றாவது ஐசோடோப்பான டிரிட்டியம் மிகச் சிறிதளவே கிடைக்கப்பெறும் கதிரியக்கத் தன்மையுடைய ஐசோடோப்பாகும். இது தோராயமாக 1018 ஹைட்ரஜன் அணுக்களுக்கு, ஒரு டிரிட்டியம் அணு என்ற விகிதத்தில் உள்ளது. இவ்வாறு ஹைட்ரஜன் ஐசோடோப்புகளை பெற்றிருப்பதினால், இயற்கையில் கிடைக்கக் கூடிய ஹைட்ரஜனானது H2, HD, D2, HT, T2 மற்றும் DT ஆகியனவாகக் காணப்படுகின்றன. இந்த ஐசோடோப்புகளின் பண்புகள் அட்டவணை 4.1ல் கொடுக்கப்பட்டுள்ளன.
அட்டவணை 4.1 ஹைட்ரஜன், டியூட்டிரியம் மற்றும் டிரிட்டியம் மூலக்கூறுகளின் பண்புகள்
● பிணைப்பு பிளவுறு ஆற்றல்
3. ஆர்த்தோ மற்றும் பாரா ஹைட்ரஜன்
ஹைட்ரஜன் அணுவின் அணுக்கரு சுழன்று கொண்டு இருக்கிறது. மூலக்கூறு ஹைட்ரஜன் உண்டாகும் போது, இரண்டு ஹைட்ரஜன் அணுக்கருக்களின் சுழற்சி ஒரே திசையிலேயோ அல்லது எதிரெதிர் திசைகளிலோ, படத்தில் கண்டுள்ளவாறு அமையலாம். இந்த இரண்டு விதமான ஹைட்ரஜன் மூலக்கூறுகள் முறையே ஆர்த்தோ மற்றும் பாரா ஹைட்ரஜன்கள் என்று அழைக்கப்படுகின்றன.
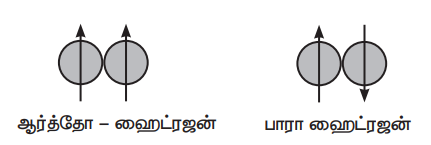
அறை வெப்பநிலையில், சாதாரண ஹைட்ரஜனில் 75% ஆர்த்தோ, 25% பாரா வகையும் உள்ளன. ஆர்த்தோ வகையானது, பாரா வகையைவிட அதிக நிலைப்புத் தன்மையுடையது ஒருவகை ஹைட்ரஜனானது மற்றொரு வகை ஹைட்ரஜனாக மாறும் செயல்முறை மிகவும் மெதுவானதாகும். எனினும் குறைவான வெப்பநிலையில் பாரா ஹைட்ரஜன் உருவாவதற்கு சமநிலை சாதகமாக உள்ளது. பிளாட்டினம், இரும்பு (அயர்ன்) போன்ற வினைவேக மாற்றிகளைச் சேர்ப்பதன் மூலம், பாரா ஹைட்ரஜனை, ஆர்த்தோ ஹைட்ரஜனாக மாற்றலாம். மின் பாய்ச்சல் மூலமாகவும் பாரா ஹைட்ரஜனை, ஆர்த்தோ ஹைட்ரஜனாக மாற்றலாம். 800°Cக்கும் அதிகமான வெப்பநிலைக்கு வெப்பப்படுத்துதல், O2, NO, NO2, போன்ற பாரா காந்தத் தன்மையுள்ள மூலக்கூறுகளைச் சேர்த்தல் அல்லது பிறவி நிலை/அணு நிலை ஹைட்ரஜனைச் சேர்த்தல் ஆகியமுறைகளிலும் பாரா ஹைட்ரஜனை ஆர்த்தோ ஹைட்ரஜனாக மாற்றலாம்.
ஆர்த்தோ மற்றும் பாரா ஹைட்ரஜன்கள், ஒரே விதமான வேதிப்பண்புகளையும் ஒரு சில மாறுபட்ட இயற்பண்புகளையும் பெற்றுள்ளன. எடுத்துக்காட்டாக பாரா ஹைட்ரஜனின் உருகுநிலை 13.83K ஆனால், ஆர்த்தோ ஹைட்ரஜனின் உருகுநிலை 13.95K ஆகும். பாரா ஹைட்ரஜனின் கொதிநிலை 20.26K, ஆனால் ஆர்த்தோ ஹைட்ரஜனின் கொதி நிலை 20.39K ஆகும். பாரா ஹைட்ரஜனில், அணுக்கருக்களின் சுழற்சி எதிரெதிர் திசையில் அமைவதால், அதன் காந்தத் திருப்புத் திறன் பூஜ்ஜியமாகும். ஆர்த்தோ ஹைட்ரஜனின் காந்தத் திருப்புத் திறன், ஒரு புரோட்டானின் காந்தத் திருப்புத் திறனைப் போல் இரண்டு மடங்கு ஆகும்.