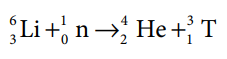ஆய்வகத் தயாரிப்பு, தொழில் முறை தயாரிப்பு - ஹைட்ரஜன் தயாரித்தல் | 11th Chemistry : UNIT 4 : Hydrogen
11 வது வேதியியல் : அலகு 4 : ஹைட்ரஜன்
ஹைட்ரஜன் தயாரித்தல்
ஹைட்ரஜன் தயாரித்தல்
மிகச் சிறிதளவு அமிலம் அல்லது காரம் கலந்த நீரினை மின்னாற் பகுத்தல் மூலம் மிகத் தூய்மையான (>99.9%) ஹைட்ரஜனைப் பெறலாம் அல்லது சோடியம் ஹைட்ராக்சைடு, பொட்டாசியம் ஹைட்ராக்சைடு போன்றவற்றின் நீர்க்கரைசலை மின்னாற் பகுத்தும் ஹைட்ரஜனைப் பெறலாம். இம்மின்னாற்பகுப்பில் நிக்கல் நேர்மின் வாயாகவும், இரும்பு (iron) எதிர் மின்வாயாகவும் செயல்படுகிறது. இருப்பினும் இம்முறை மூலம் அதிக அளவு ஹைட்ரஜனைத் தயாரித்தல் பொருளாதார ரீதியாக சிறந்த முறையன்று.
நேர்மின்வாய் : 2OH- → H2O + 1/2 O2 + 2e-
எதிர்மின்வாய்: 2 H2O + 2e- → 2 OH- + H2
ஒட்டு மொத்த வினை: H2O → H2 + 1/2 O2
1. ஆய்வகத் தயாரிப்பு
ஆய்வகத்தில் துத்தநாகம் (zinc), இரும்பு (iron) வெள்ளீயம் (tin) போன்ற உலோகங்களை, நீர்த்த அமிலங்களுடன் வினைபுரியச் செய்வதன் மூலம் ஹைட்ரஜனை எளிதில் தயாரிக்க இயலும்.
Zn + 2 HCl → ZnCl2 + H2 ↑
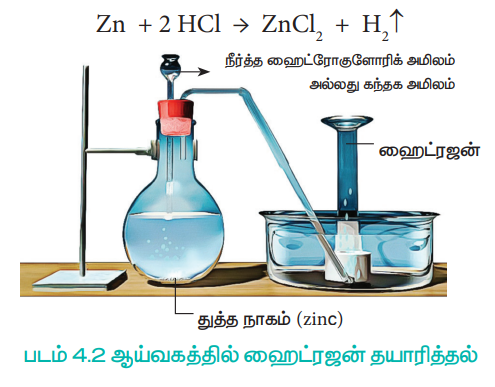
படம் 4.2 ஆய்வகத்தில் ஹைட்ரஜன் தயாரித்தல்
2. தொழில் முறை தயாரிப்பு
நீர்வாயு தயாரித்தல்
ஹைட்ரோ கார்பன்களை, நீராவியைக் கொண்டு மறு உருவாக்கம் செய்யும் முறையில், அதிக அளவில் ஹைட்ரஜனைத் தயாரிக்கலாம். இம் முறையில் மீத்தேனைப் போன்ற ஹைட்ரோ கார்பன்களை நீராவியுடன் கலந்து, 800-900°C வெப்பநிலையில், 35 atm அழுத்தத்தில் நிக்கல் வினை வேக மாற்றியின் மீது செலுத்தி ஹைட்ரஜன் பெறப்படுகிறது.
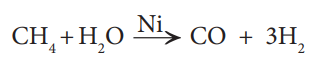
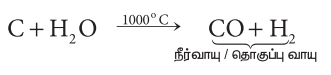
மற்றொரு முறையில் செஞ்சூட்டு வெப்பநிலைக்கு வெப்பப்படுத்தப்பட்ட கல்கரியின் மீது, நீராவியைச் செலுத்தி கார்பன் மோனாக்சைடும், ஹைட்ரஜனும் பெறப்படுகின்றன. இம்முறையில் பெறப்படும் வாயுக்கள் அடங்கிய கலவை நீர் வாயு எனப்படுகிறது. இதனை தொகுப்பு வாயு எனவும் அழைக்கலாம். மெத்தனால் மற்றும் சில எளிய ஹைட்ரோகார்பன்களைப் போன்ற கரிமச்சேர்மங்களைத் தொகுப்பு முறையில் தயாரிக்க இவ்வாயுக்கலவை பயன்படுவதால் இதனை தொகுப்புவாயு என்று அழைக்கின்றோம்.
நீர் வாயுவில் உள்ள கார்பன் மோனாக்சைடை கார்பன்-டை-ஆக்சைடாக மாற்றுதல்:
நீர்வாயுக் கலவையுடன், அதிக அளவு நீராவியினைச் சேர்த்து 400°C வெப்பநிலையில், இரும்பு (iron] / தாமிரம் (copper) வினைவேக மாற்றியைக் கொண்டுள்ள மாற்று உலையின் (shift Converter) வழியாகச் செலுத்துவதன் மூலம் நீர்வாயுக் கலவையில் உள்ள கார்பன் மோனக்சைடை, கார்பன் டை ஆக்சைடாக மாற்றலாம்.
CO + H2O → CO2 + H2
மேற்கண்டுள்ள முறையில் உருவான CO2 வாயுவானது, பொட்டாசியம் கார்பனேட் கரைசலால் உறிஞ்சப்படுகிறது.
CO2 + K2CO3 + H2O → 2 KHCO3
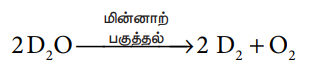
3. டியூட்டிரியம் தயாரித்தல்
கன நீரை மின்னாற் பகுத்தல்
சாதாரண நீரில் 1.6 × 10-4 சதவீதம் கனநீர் உள்ளது. கன நீரைவிட புரோட்டிய நீர் (H2O) அதிக அளவு பிரிகை அடையக்கூடியது. எனவே நீரை மின்னாற் பகுக்கும் போது D2வை விட H2 விரைவாக வெளியேறுகிறது. எஞ்சியுள்ள கரைசலில் கனநீரின் செறிவு குறிப்பிடத்தக்க அளவு இருக்கும் வரை, மின்னாற்பகுத்தல் தொடர்ந்து நிகழ்த்தப்படுகிறது. இவ்வாறு கனநீரை தொடர்ச்சியாக மின்னாற் பகுத்தல் செய்வதன் மூலம் டியூட்டிரியம் பெறப்படுகிறது.
4. டிரிட்டியம் தயாரித்தல்
முன் பாடப்பகுதியில் குறிப்பிட்டுள்ளதைப் போன்று, டிரிட்டியம் மிகக் குறைந்த அளவே காணப்படுகிறது. எனவே, அணுக்கரு பிளவு உலையில், லித்தியத்தின் மீது மெதுவாக இயங்கும் நியூட்ரானை மோதச் செய்து, செயற்கை முறையில் டிரிட்டியம் பெறப்படுகிறது. இச்செயல் முறைக்கான அணுக்கரு மாற்ற வினை பின்வருமாறு :-