11 வது வேதியியல் : அலகு 4 : ஹைட்ரஜன்
கடின நீர் மற்றும் மென்னீர்
கடின நீர் மற்றும் மென்னீர்
கடின நீர் அதிக அளவு கனிம அயனிகளைக் கொண்டுள்ளது. நீரில் கரையக்கூடிய கால்சியம் மற்றும் மெக்னீசியம் ஆகிய உலோகங்களின் நேர் அயனிகளே பெரும்பாலும் கடின நீரில் காணப்படுகின்றன. ஒருசில இடங்களில் காணப்படும் கடின நீரில் இரும்பு (iron), அலுமினியம் மற்றும் மாங்கனீஸ் போன்ற உலோகங்களின் அயனிகளும் உள்ளன. இவ்வுலோகங்களின் பைகார்பனேட், குளோரைடு மற்றும் சல்பேட் உப்புகள் நீரில் காணப்படுவதால், நீர் கடினத் தன்மையடைகிறது. கடின நீரை கொதிக்க வைக்கும் போது, அதிலுள்ள மெக்னீசியம் மற்றும் கால்சியம் உலோகங்களின் கார்பனேட்டுகள் வீழ்படிவாகின்றன. கால்சியம் மற்றும் மெக்னீசியத்தின் நீரில் கரையும் உப்புகள் இல்லாத நீர் மென்னீர் என அழைக்கப்படுகிறது. நீரின் கடினத் தன்மை இரண்டு வகைப்படும். அவைகள் தற்காலிக கடினத்தன்மை மற்றும் நிரந்தர கடினத்தன்மை ஆகும்.
தற்காலிக கடினத்தன்மை மற்றும் அதனை நீக்குதல்
நீரில் கரையக்கூடிய, கால்சியம் மற்றும் மெக்னீசியம் ஆகியவற்றின் பைகார்பனேட் உப்புகள் காணப்படுதலே தற்காலிக கடினத் தன்மைக்கு முதன்மையான காரணமாகும். இவ்வகை நீரை கொதிக்க வைத்து பின் வடிகட்டுவதன் மூலம் கடினத் தன்மையை நீக்கலாம். கொதிக்க வைக்கும்போது, இந்த பைகார்பனேட் உப்புகள், கரையாத கார்பனேட் உப்புகளாகச் சிதைவடைந்து, வீழ்படிவாகின்றன. இவ்வாறு உருவான மெக்னீசியம் கார்பனேட் மேலும் நீராற்பகுப்பு அடைந்து கரையாத மெக்னீசியம் ஹைட்ராக்சைடைத் தருகிறது.
Ca (HCO3)2 → CaCO3 + H2O + CO2
Mg (HCO3)2 → MgCO3 + H2O + CO2
MgCO3 + H2O → Mg(OH)2 + CO2
வடிகட்டுதல் மூலமாக இவ்வீழ்படிவுகளை நீக்கலாம்.
நாம், கிளார்க் முறையினைப் பயன்படுத்தியும், தற்காலிக கடினத் தன்மையை நீக்கலாம். இம்முறையில் கணக்கிடப்பட்ட அளவு சுண்ணாம்பு நீரானது கால்சியம் மற்றும் மெக்னீசியம் அயனிகளைக் கொண்டுள்ள கடின நீருடன் சேர்க்கப்படுகிறது. இதனால் உருவாகும் ஹைட்ராக்சைடுகள் மற்றும் கார்பனேட்டுகள் வடிகட்டி நீக்கப்படுகின்றன.
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 + 2H2O
Mg (HCO3)2 + 2 Ca(OH)2
↓
2 CaCO3 + Mg(OH)2 + 2 H2O
நிரந்தர கடினத்தன்மை
மெக்னீசியம் மற்றும் கால்சியம் ஆகிய உலோகங்களின் நீரில் கரையக்கூடிய, குளோரைடு மற்றும் சல்பேட் உப்புகளினால் நிரந்தர கடினத் தன்மை ஏற்படுகிறது. சலவைச் சோடாவைச் சேர்த்து இதனை நீக்கலாம். சலவைச் சோடாவானது கடின நீரில் கரைந்துள்ள கால்சியம் மற்றும் மெக்னீசியத்தின் குளோரைடு மற்றும் சல்பேட்டுடன் வினைபுரிந்து அவற்றின் கரையாத கார்பனேட்டுகளைத் தருகிறது.
MCl2 + Na2CO3 → MCO3 + 2 NaCl
MSO4 + Na2CO3 → MCO3 + Na2SO4
(M = Ca, Mg)
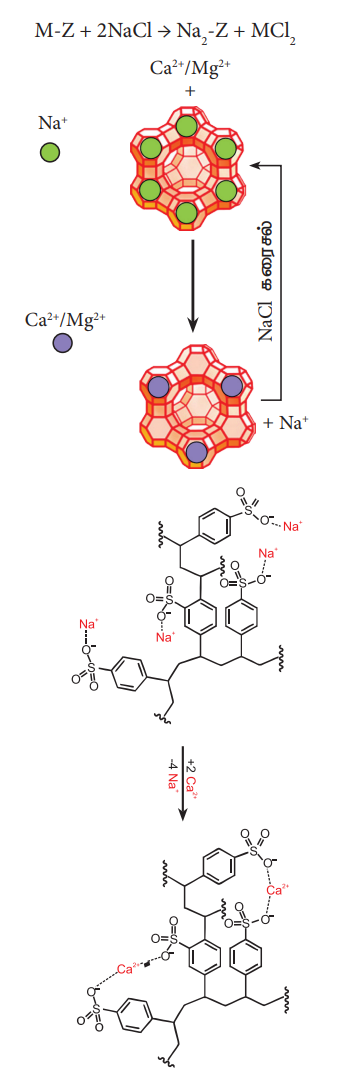
கடின நீரை மென்னீராக மாற்றப் பயன்படும் மற்றொரு முறை அயனிப் பரிமாற்ற முறையாகும். இம்முறையில், கடின நீரானது, சியோலைட் போன்ற அயனிப்பரிமாற்றப் பொருள் நிரப்பப்பட்ட குழாய் வழியே செலுத்தப்படுவதன் மூலம் கடினத்தன்மை நீக்கப்படுகிறது. சியோலைட்டுகள் என்பன நீரேற்றம் பெற்ற சோடியம் அலுமினோ சிலிக்கேட்டுகள் ஆகும். இவை Na2O.Al2O3.XSiO2YH2O (X = 2 முதல் 10, மற்றும் Y = 2 முதல் 6) என்ற பொதுவான வாய்பாட்டினைப் பெற்றுள்ளன. சியோலைட்கள் நுண்துளை வடிவமைப்பினைப் பெற்றுள்ளன. இவற்றிலுள்ள ஒற்றை இணை திறன் பெற்றுள்ள சோடியம் அயனிகள் எளிதாக பிணைக்கப்பட்டுள்ளன. இவ் அயனிகள், நீரின் கடினத் தன்மைக்குக் காரணமான உலோக அயனிகள் (M = Ca2+ அல்லது Mg2+) உடன் பரிமாற்றம் அடைகிறது. அணைவு வடிவத்தினை Na2 - Z எனக் குறிப்பிட இயலும். இதில் சோடியம் ஆனது பரிமாற்றமடையும் நேர் அயனியாகும்.
Na2 - Z + M2+ → M – Z + 2 Na+
அயனிப்பரிமாற்றம் முழுமையடைந்த பின்னர், நீர்த்த சோடியம் குளோரைடினைச் செலுத்துவதன் மூலம் மீண்டும் சியோலைட்டினைப் பெறலாம். இந்நிகழ்வில் சியோலைட்டினால் ஈர்த்துக் கொள்ளப்பட்ட Ca2+ மற்றும் Mg2+ அயனிகள், சோடியம் அயனிகளால் பரிமாற்றம் செய்யப்படுகிறது.
M - Z + 2 NaCl → Na2 - Z + MCl2