இயற்பண்புகள், வேதிப்பண்புகள், பயன்கள், அமைப்பு - ஹைட்ரஜன் பெராக்சைடு | 11th Chemistry : UNIT 4 : Hydrogen
11 வது வேதியியல் : அலகு 4 : ஹைட்ரஜன்
ஹைட்ரஜன் பெராக்சைடு
ஹைட்ரஜன் பெராக்சைடு
ஹைட்ரஜன் பெராக்சைடு (H2O2) ஒரு முக்கியமான பெராக்சைடாகும். உலோக பெராக்சைடுகளை, நீர்த்த அமிலங்களுடன் வினைப்படுத்துவதன் மூலம் இதனை தயாரிக்கலாம்.
BaO2 + H2SO4 → BaSO4 + H2O2
Na2O2 + H2SO4 → Na2SO4 + H2O2
தொழிற்முறையில், 2 - ஆல்கைல் ஆந்த்ர குயினாலை சுய ஆக்சிஜனேற்றம் அடையச் செய்வதன் மூலம் தற்போது ஹைட்ரஜன் பெராக்சைடு தயாரிக்கப்படுகிறது.
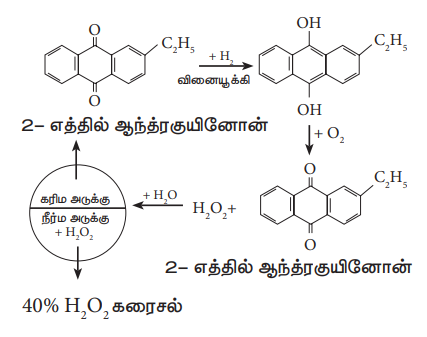
1. இயற்பண்புகள்
தூய்மையான ஹைட்ரஜன் பெராக்சைடு ஏறத்தாழ நிறமற்ற திரவமாகும். (வெளிர்ந்த நீல நிறம்), நீரைவிட அதிக பாகுநிலைத் தன்மையும், குறைவாக ஆவியாகும் தன்மையினையும் கொண்டுள்ளது.
ஹைட்ரஜன் பெராக்சைடின் 30% கரைசலானது '100-கனஅளவு' ஹைட்ரஜன் பெராக்சைடு எனக் குறிப்பிடப்படுகிறது. திட்டவெப்ப அழுத்த நிலையில் (S.T.P.ல்) 1 mL அளவுள்ள இந்த ஹைட்ரஜன் பெராக்சைடை சூடுபடுத்தும்போது 100 mL ஆக்சிஜன் வெளியேறுகிறது.
2. வேதிப்பண்புகள்
ஹைட்ரஜன் பெராக்சைடு மிகவும் நிலைப்புத்தன்மை அற்றது. இதன் நீர்க்கரைசல் தானாகவே, விகித சிதைவடைந்து ஆக்சிஜன் மற்றும் நீரைத்தருகிறது. இவ்வினை மெதுவாக நிகழ்வதாக இருந்த போதிலும், உலோகம் வினையூக்கியாக பயன்படுத்தப்படும் நிலையில் வெடிக்கும் தன்மையுடையதாகும். இதனைக் கண்ணாடி கலன்களில் சேகரித்து வைக்கும் போது, கண்ணாடியில் உள்ள கார உலோகங்களை இது கரைக்கிறது. இது விகிதச் சிதைவு வினைக்கு வினையூக்கியாகிறது. இக்காரணத்தினால் தான் H2O2 கரைசலானது நெகிழி கலன்களில் சேமித்து வைக்கப்படுகிறது.
H2O2 → H2O + 1/2 O2
ஹைட்ரஜன் பெராக்சைடு, ஆக்சிஜனேற்றி மற்றும் ஆக்சிஜன் ஒடுக்கி ஆகிய இரண்டு வினைபொருட்களாகவும் செயல்படும் தன்மையுடையது. வழக்கமாக ஆக்சிஜனேற்ற வினைகள் அமில ஊடகத்திலும், ஆக்சிஜன் ஒடுக்க வினைகள் கார ஊடகத்திலும் நிகழ்த்தப்படுகின்றன.
அமில ஊடகத்தில்
H2O2 + 2 H+ + 2 e- → 2 H2O (E0 = +1.77 V)
எடுத்துக்காட்டாக,
2 FeSO4 + H2SO4 + H2O2 → Fe2 (SO4)3 + 2 H2O
கார ஊடகத்தில்,
HO2- + OH- → O2 + H2O + 2 e-
(E0 = + 0.08 V)
எடுத்துக்காட்டாக,
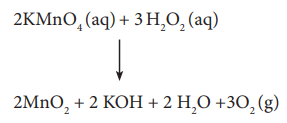
3. ஹைட்ரஜன் பெராக்சைடின் பயன்கள்
ஹைட்ரஜன் பெராக்சைடின் ஆக்சிஜனேற்றும் திறன் மற்றும் இதனால் உருவாகும் வினைபொருட்களான நீர் மற்றும் ஆக்சிஜனின் தீங்கற்ற தன்மையாலும், இது பல்வேறு பயன்களைக் கொண்டுள்ளது. நீரைச் சுத்திகரிக்கும் செயல்முறைகளில் மாசுக்களை ஆக்சிஜனேற்றம் அடையச் செய்யவும், வீரியம் குறைந்த புரைத்தடுப்பானாகவும், துணி, காகிதம், முடி பாதுகாப்பு தொழிற்சாலைகளில் வெளுக்கும் பொருளாகவும் பயன்படுகிறது.
பழங்கால ஓவியங்களில் வெண்மை நிறத்திற்கு பயன்படுத்தப்படும் நிறமிப் பொருளான Pb3 (OH)2 (CO3)2 ஆனது காற்றில் உள்ள ஹைட்ரஜன் சல்பைடுடன் வினைபுரிவதால் கருமை நிற லெட்சல்பைடு உருவாவதன் காரணமாக, வெண்மை நிறம் இழக்கப்படுகிறது. ஹைட்ரஜன் பெராக்சைடானது கருமைநிற லெட்சல்பைடினை வெண்மைநிற லெட்சல்பேட்டாக மாற்றுவதால், ஓவியங்களின் நிறம் மீளப் பெறப்படுகிறது.
PbS + 4 H2O2 → PbSO4 + 4 H2O
4. ஹைட்ரஜன் பெராக்சைடின் அமைப்பு
வாயு நிலைமை மற்றும் திட நிலைமை ஆகிய இரு நிலைமைகளிலும் இம் மூலக்கூறு, சாய்வு வசஅமைப்பினைக் கொண்டுள்ளது. ஒவ்வொரு ஆக்சிஜன் மீதுள்ள தனித்த எலக்ட்ரான்களுடன், OH பிணைப்பின் விலக்கு இடைவினை காரணமாக இவ்வமைப்பு ஏற்படுகிறது. மேலும், இது ஒற்றைப் பிணைப்பின் வழியே ஏற்படும் சுழற்சித் தடையினை பெற்றுள்ள சிறிய மூலக்கூறாகும்.
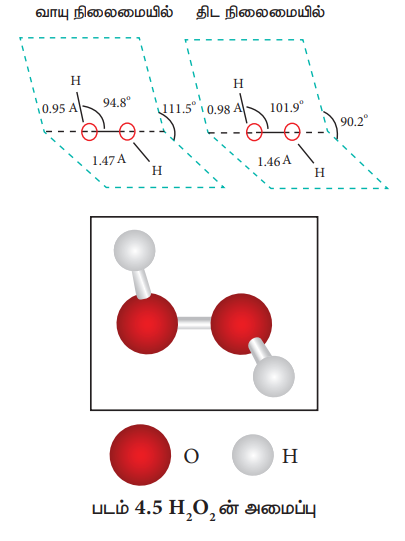
படம் 4.5 H2O2 ன் அமைப்பு
H2O2 ஆனது ஒரே தளத்தில் அமையாத வடிவமைப்பினைப் பெற்றுள்ளது. வாயு நிலைமை மற்றும் திட நிலைமையில் மூலக்கூறு வடிவமைப்பின் பரிமாணங்கள் படம் 4.5ல் கொடுக்கப்பட்டுள்ளது. வடிவமைப்பினைப் பொருத்தவரையில், இரண்டு OH- தொகுதிகளும் ஒரே தளத்தில் அமையாத இருதள (dihedral) வடிவமைப்பின் மூலம் H2O2 வை குறிப்பிடலாம். பகுதியளவு திறந்து வைக்கப்பட்டுள்ள புத்தகத்தின், அச்சில் ஆக்சிஜன் அணுக்களும், இரு பக்கங்களிலும் ஹைட்ரஜன் அணுக்கள் இருப்பதாக இதன் வடிவமைப்பினை உருவகப்படுத்தலாம். திட நிலைமையில் உள்ள மூலக்கூறில் ஹைட்ரஜன் பிணைப்பின் காரணமாக இரு தளங்களுக்கும் இடையேயான கோணம் 90.2° ஆக குறைகிறது. மேலும் -O-O-H கோணம் 94.8° லிருந்து 101.9° ஆக அதிகரிக்கிறது.