11 வது வேதியியல் : அலகு 2 : அணுவின் குவாண்டம் இயக்கவியல் மாதிரி
ஆர்பிட்டால்களின் ஆற்றல்கள்
2. ஆர்பிட்டால்களின் ஆற்றல்கள்
ஹைட்ரஜன் அணுவில் ஒரே ஒரு எலக்ட்ரான் மட்டுமே உள்ளது. இத்தகைய ஒரு எலக்ட்ரானை மட்டுமே பெற்றுள்ள அமைப்பிற்கு, nஆவது வட்டப்பாதையின் உள்ள எலக்ட்ரானின் ஆற்றல் பின்வருமாறு தரப்படுகிறது.
En = [ (-1312.8) Z2] / n2 kJ mol-1
இச்சமன்பாட்டிலிருந்து ஆற்றலானது முதன்மைக் குவாண்டம் எண்ணை மட்டுமே பொருத்து அமைகிறது என நாம் அறிகிறோம். nன் மதிப்பு அதிகரிக்கும் போது, ஆர்பிட்டாலின் ஆற்றலின் மதிப்பும் அதிகரிக்கும். பல்வேறு ஆர்ப்பிட்டால்களுக்கான ஆற்றலின் வரிசை பின்வருமாறு அமைகிறது.
1s < 2s = 2p < 3s = 3p = 3d < 4s = 4p = 4d = 4f < 5s = 5p = 5d = 5f < 6s = 6p = 6d = 6f < 7s
ஹைட்ரஜன் அணுவில் உள்ள ஒருஎலக்ட்ரான் குறைந்தபட்ச ஆற்றலைப் பெற்றுள்ள 1s ஆர்பிட்டாலில் உள்ளது. இந்நிலை இயல்பு ஆற்றல் நிலை (graund state) என அழைக்கப்படுகிறது. இந்த எலக்ட்ரான் சிறிதளவு ஆற்றலை பெறும் போது 2s, 2p போன்ற அதிக ஆற்றலுடைய ஆர்பிட்டால்களுக்குச் செல்லும். இந்த உயர் ஆற்றல் நிலைகள் கிளர்வுற்றநிலைகள் (excited state) என அழைக்கப்படுகின்றன. எனினும் ஹைட்ரஜனைத் தவிர்த்த பிற அணுக்களுக்கு (பல எலக்ட்ரானை கொண்ட அமைப்புகளுக்கு) மேற்கண்டுள்ள ஆற்றல் வரிசை உண்மையல்ல. அத்தகைய அமைப்புகளுக்கு ஷ்ரோடிங்கர் அலைச் சமன்பாடு சிக்கலானதாகும். இத்தகைய அமைப்பில் உள்ள பல்வேறு ஆர்பிட்டால்களின் ஒப்பீட்டு அளவிலான ஆற்றல் வரிசையினை (n+l) விதி தருகிறது. இவ்விதிப்படி, ஆர்பிட்டாலின் (n+l) மதிப்பு குறைவாக இருப்பின் அதன் ஆற்றலும் குறைவாக இருக்கும். இரு ஆர்பிட்டால்களின் (n+l) மதிப்பு சமமாக இருப்பின், அவ்விரு ஆர்பிட்டால்களில் எந்த ஆர்பிட்டாலுக்கு n மதிப்பு குறைவாக உள்ளதோ அந்த ஆர்பிட்டால் குறைந்த ஆற்றலைப் பெற்றிருக்கும். இவ்விதியினைப் பயன்படுத்தி பல்வேறு ஆர்பிட்டால்களின் ஆற்றலின் வரிசையினை பின்வருமாறு குறிப்பிடலாம்.
அட்டவனை 2.2 பல்வேறு ஆர்பிட்டால்களின் (n+l) மதிப்புகள்
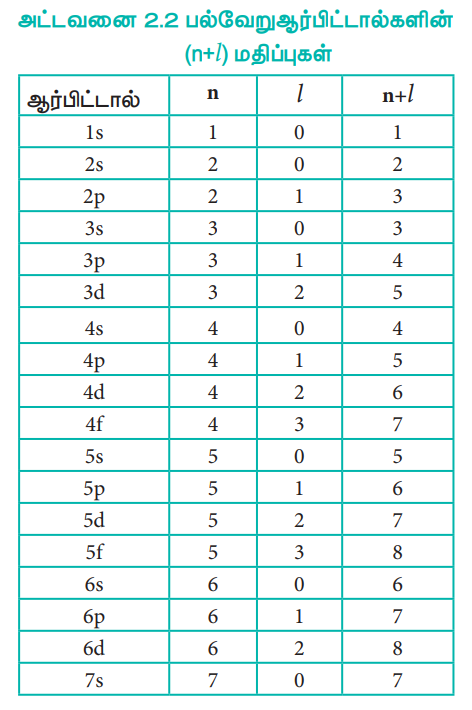
(n+l) விதியின் அடிப்படையில், ஆர்பிட்டால்களின் ஆற்றலின் ஏறுவரிசை பின்வருமாறு
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s < 5f < 6d
ஒரு p ஆர்பிட்டாலுக்கு, மூன்று வகையான திசையமைப்புகள் உள்ளன என்பதனை நாம் அறிவோம். அதாவது Px, Py, மற்றும் Pz ஆகிய இம்மூன்று ஆர்பிட்டால்களின் ஆற்றலும் சமம். இவைகள் சம ஆற்றல் ஆர்பிட்டால்கள் (degenerate orbitals) என அழைக்கப்படுகின்றன. எனினும் மின் மற்றும் காந்தப்புலங்களின் இந்த சமஆற்றல் பண்பு (degeneracy) இழக்கப்படுகிறது.
பல எலக்ட்ரான்களைப் பெற்றுள்ள ஒரு அணுவில், அணுக்கருவிற்கும், எலக்ட்ரான்களுக்கும் இடையேயான நிலை மின்னியல் கவர்ச்சி விசை மட்டுமல்லாமல், எலக்ட்ரான்களுக்கிடையேயான விலக்குவிசையும் காணப்படுகிறது. இவ்விருவிசைகளும் ஒன்றுக்கொன்று எதிரெதிர் திசைகளில் செயல்படுகின்றன. இதன் விளைவாக அணுக்கருவானது எலக்ட்ரான் மீது செலுத்தும் கவர்ச்சி விசை குறைகிறது. எலக்ட்ரானால் உணரப்படும் நிகர அணுக்கரு மின்சுமையானது செயலுறு அணுக்கரு மின் சுமை (effective nuclear charge) என்றழைக்கப்படுகிறது. இந்த நிகர அணுக்கரு மின்சுமை ஆர்ப்பிட்டால்களின் வடிவமைப்பினைப் பொருத்து அமைகிறது. மேலும் கோண உந்தக் குவாண்டம் எண் ‘l’ ன் மதிப்பு அதிகரிக்கும் போது இதன் மதிப்பு குறைகிறது.
ஒரு குறிப்பிட்ட கூட்டினுள், உள்ள ஆர்பிட்டால்களில் காணப்படும் எலக்ட்ரானால் உணரப்படும் நிகர அணுக்கரு மின்சுமையின் மதிப்பு s > p > d > f என்ற வரிசையில் அமையும். நிகர அணுக்கரு மின்சுமையின் மதிப்பு அதிகமாக இருப்பின், ஆர்பிட்டால்களின் நிலைப்புத் தன்மை அதிகமாக இருக்கும். எனவே, கொடுக்கப்பட்ட ஆற்றல் மட்டத்தில், ஆர்பிட்டால்களின் ஆற்றலின் வரிசை பின்வருமாறு அமையும். s < p < d < f
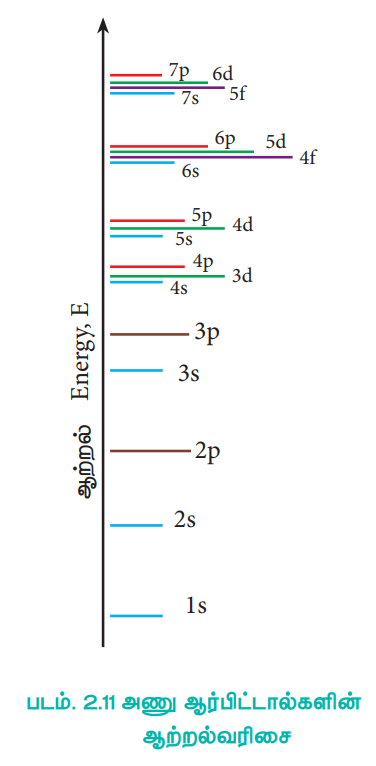
படம். 2.11 அணு ஆர்பிட்டால்களின் ஆற்றல்வரிசை
ஒரே வகையான ஆர்பிட்டால்களின் ஆற்றலானது அணு எண் அதிகரிக்கும் போது குறையும். உதாரணமாக ஹைட்ரஜனின் 2s ஆர்பிட்டாலின் ஆற்றலானது, லித்தியத்தின் 2s ஆர்பிட்டாலின் ஆற்றலை விட அதிகம், இதைப் போலவே லித்தியத்தின் 2s ஆர்பிட்டாலின் ஆற்றல் சோடியத்தின் 2s ஆர்பிட்டாலின் ஆற்றலை விட அதிகம். அதாவது, E2s (H) > E2s (Li) > E2s (Na) > E2s (K).