11 வது வேதியியல் : அலகு 2 : அணுவின் குவாண்டம் இயக்கவியல் மாதிரி
பெளலி தவிர்க்கை தத்துவம்
2. பெளலி தவிர்க்கை தத்துவம்
ஒரு அணுவில் உள்ள எந்த இரு எலக்ட்ரான்களுக்கும், அவற்றின் நான்கு குவாண்டம் எண்களின் மதிப்பின் தொகுப்பும் ஒன்றாக இருக்காது என்ற தவிர்க்கைத் தத்துவத்தினை பௌலி கூறினார். அதாவது ஒவ்வொரு எலக்ட்ரானும் அதற்கென தனித்த நான்கு குவாண்டம் எண்களின் (n, l, m மற்றும் s) மதிப்பினை பெற்றிருக்க வேண்டும் என்பதே இதன் பொருளாகும்
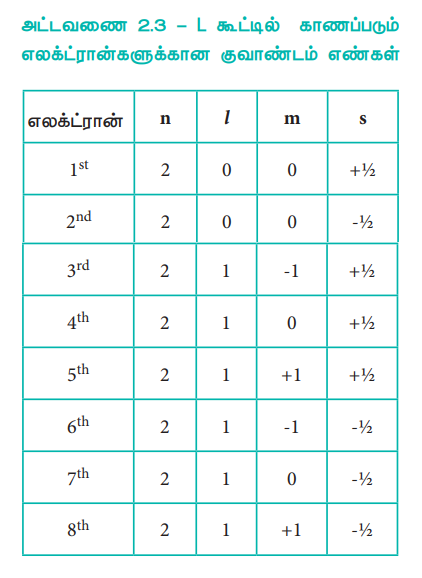
ஹைட்ரஜனில் உள்ள ஒரு தனித்த எலக்ட்ரானிற்கு, நான்கு குவாண்டம் எண்களின் மதிப்புகள், n = 1; l = 0; m = 0 மற்றும் s = +1/2. ஹீலியத்தின் உள்ள இரு எலக்ட்ரான்களில் ஒரு எலக்ட்ரான் ஹைட்ரஜனைப் போலவே, n = 1, l = 0, m = 0 மற்றும் s = +1/2. மதிப்பினையும், மற்றொரு எலக்ட்ரானைப் பொருத்த வரையில், நான்காவது குவாண்டம் எண் மட்டும் மாறுபட்டு காணப்படுகிறது. அதாவது n = 1, l = 0, m = 0 மற்றும் s = -1/2. தற்சுழற்சி குவாண்டம் எண் +1/2 மற்றும் -1/2 ஆகிய இருமதிப்புகளை மட்டுமே பெற இயலும் எனநாம் அறிவோம். எனவே, பெளலி தத்துவப்படி, கொடுக்கப்பட்ட ஒரு ஆர்பிட்டாலில் அதிகபட்சமாக இரு எலக்ட்ரான்களை மட்டுமே நிரப்ப முடியும். L கூட்டில் அதிக பட்சமாக காணப்படும் எட்டு எலக்ட்ரான்களுக்கும், நான்கு குவாண்டம் எண்களையும் எழுதுவதன் மூலம் இதனை நாம் புரிந்து கொள்ளமுடியும்.
அட்டவணை 2.3 -L கூட்டில் காணப்படும் எலக்ட்ரான்களுக்கான குவாண்டம் எண்கள்